А.В. Мартюшев-Поклад, К.В. Савельева, М.В. Качанова, Ю.Л. Дугина, С.А. Тарасов, О.И. Эпштейн, С.А. Сергеева
Введение
Лекарственные средства, применяемые в настоящее время для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ), имеют две основные молекулярные мишени: это 5-альфа-редуктаза и альфа-адренорецепторы нижних мочевыводящих путей. Применение ингибиторов 5-альфа-редуктазы, наиболее эффективное при выраженной гиперплазии (большом объеме) простаты, практически не влияет на клинические симптомы ДГПЖ в течение первых 3-4 месяцев лечения, однако значительно улучшает долгосрочный прогноз течения заболевания. Альфа-адреноблокаторы, практически не влияя на саму ткань простаты, эффективно воздействуют на динамический компонент обструкции и достаточно быстро облегчают клинические симптомы ДГПЖ. При этом клинические симптомы (общий балл опросника IPSS International Prostate Symptom Score) улучшаются на 20-50%, а показатели уродинамики на 20-30% (Madersbacher S, et al., 2004). Применение альфа-адреноблокаторов может обеспечивать быстрое улучшение симптомов на 20-50% улучшение уродинамики (скорость потока мочи) на 20-30%.
Из фитотерапевтических препаратов наиболее изучен экстракт Serenoa repens, который, по данным ряда исследований, не уступает по эффективности финастериду (Wilt T, 2004).
Мишень S.repens не определена, его эффекты считаются многокомпонентными (обмен холестерина, антиэстрогенный и антиандрогенный, противовоспалительный эффекты и др.).
Интересной молекулярной мишенью при ДГПЖ является простатоспецифический антиген ПСА (Balk SP, 2003; Diamandis EP, 2000). Выявлено, что эта сериновая протеаза, экспрессия которой регулируется андрогенами, обладает антиангиогенной активностью (Fortier AH, 1999), а также участвует в регуляции роста стромальных клеток простаты (Sutkowski DM, 1999).
При ДГПЖ отмечается активная реакция иммунной системы на ПСА, которая может быть как фактором патогенеза, так и «свидетелем» других процессов (Zisman A, 1995, 1999).
Таким образом, в целом роль ПСА в патогенезе ДГПЖ неоднозначна и требует дальнейшего исследования.
Компанией «Материа Медика Холдинг» (Россия) разработан препарат Афала, активным компонентом которого являются поликлональные кроличьи антитела к ПСА (сверхмалые дозы для перорального применения). В доклинических исследованиях препарат снижал выраженность острого и хронического асептического воспаления простаты (Боровская Т.Г., 2002), а также уменьшал выраженность гиперплазии простаты в условиях гиперпролактинемии, вызванной сульпиридом (неопубликованные данные). Механизм действия препарата, предположительно, заключается в модификации функциональной активности эндогенного ПСА, измененной в условиях ДГПЖ.
В настоящей статье суммированы результаты двух контролируемых рандомизированных параллельных исследований эффективности и безопасности афалы при ДГПЖ (Павлов В.Н. и др., 2005; Петров В.И. и др., 2006; Martyushev-Poklad A. et al, 2005; Юрмазов З.А. и др., 2005).
Материалы и методы
Каждое из двух исследований было проведено в различных клинических центрах (в городах Волгоград, Уфа, Томск, Москва) по сходному дизайну. Исследования проводились в следующих учреждениях: Волгоградский государственный медицинский университет, Башкирский государственный медицинский университет, НИИ фармакологии Томского научного центра СО РАМН, 32-й Центральный Военно-морской клинический госпиталь. Пациенты включались в группы афалы, плацебо или открытую группу сравнения. После 4 недель плацебо-контролируемой фазы группу афалы раскрывали, и далее исследование проходило как открытое сравнительное рандомизированное с активным препаратом сравнения. Общая продолжительность лечения составила 16 недель.
В исследование включались пациенты 40-70 лет с умеренно выраженными симптомами хронического заболевания простаты ДГПЖ I-II стадии (общий балл IPSS 9-25), у которых диагноз был подтвержден трансректальным ультразвуковым исследованием (ТРУЗИ), с объемом простаты >25 см3, Qmax (максимальная скорость потока мочи) 5-15 мл/с, давшие письменное информированное согласие. Основные критерии исключения: предшествующие хирургические вмешательства на предстательной железе или мочевом пузыре; объем остаточной мочи более 150 мл; подозрение на рак предстательной железы; уровень ПСА в сыворотке более 4 нг/мл и др.
Пациенты получали афалу (16 недель) или плацебо (4 нед) в форме таблеток для рассасывания во рту по 2 таблетки 4 раза в сутки. В параллельной открытой группе сравнения пациенты получали активный препарат, содержащий экстракт Serenoa repens (простамол уно, 320 мг/сутки).
В ходе последующих визитов (4, 8, 12 и 16 недель) оценивали выраженность симптомов заболевания (общий балл IPSS International Prostate Symptom Score), специфическое качество жизни (интегральный вопрос IPSS), уродинамику методом урофлоуметрии, а также проводили ТРУЗИ простаты и оценивали сывороточный ПСА. На каждом визите фиксировали наличие нежелательных явлений. Общий анализ крови и мочи, а также уровень глюкозы и креатинина в сыворотке оценивались до и после исследования.
Критериями эффективности проводимой терапии являлось уменьшение выраженности симптомов заболевания, улучшение уродинамических показателей, а также повышение качества жизни пациентов на фоне лечения.
Рис. 1. Влияние терапии афалой и простамолом уно на максимальную объемную скорость потока мочи
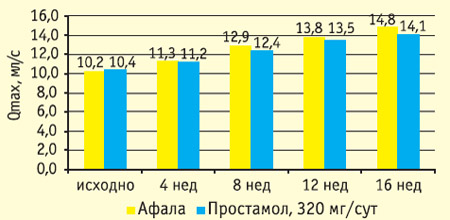
Рис. 2. Влияние терапии афалой и простамолом уно на среднюю объемную скорость потока мочи
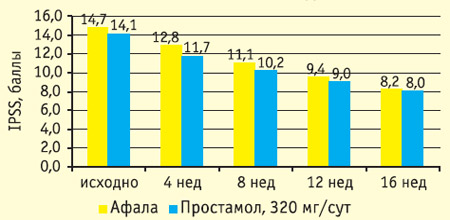
Рис. 3. Влияние терапии афалой и простамолом уно на выраженность симптомов заболевания (значение суммарного балла IPSS)
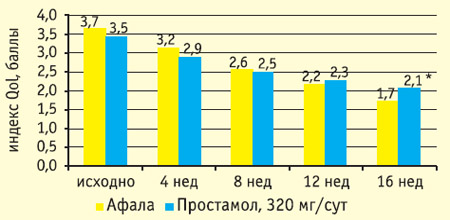
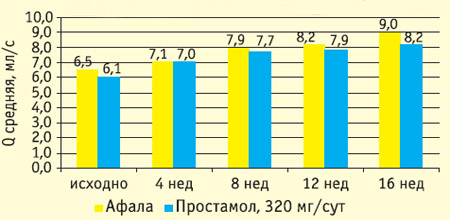
Рис. 4. Влияние терапии афалой и простамолом уно на качество жизни пациентов (значение индекса QoL)
Результаты
Всего в двух исследованиях принял участие 241 пациент с ДГПЖ I-II стадии, из которых 132 прошли курс лечения афалой, 54 курс лечения простамолом уно и 55 составили группу контроля, получавшую плацебо.
Средний возраст пациентов, включенных в исследование, составил 63,5+0,49 лет.
В обоих исследованиях уже через 4 недели после начала лечения показатели эффективности афалы достоверно отличались от группы плацебо как по клиническим проявлениям ДГПЖ, так и по уродинамике. В группе плацебо снижение IPSS составило 0,9+0,4 балла, Qmax не изменилось. В группе афалы через 4 недели лечения снижение IPSS составило 1,9+0,3 балла, Qmax повысился на 13,3+2,4%.
Результаты 16-недельной открытой сравнительной части исследования представлены на рисунках 1-4. Оба препарата значительно снизили общий балл IPSS: более чем на 40% к 16 неделе, при этом у половины пациентов IPSS снизился ниже 8 (уровень, при котором фармакотерапия может не проводиться). Улучшение уродинамики (Qmax) в группе афалы составило 45%, в группе простамола 36%. Улучшение качества жизни (вопрос о качестве жизни в IPSS) было также несколько более выраженным в группе афалы.
Кроме того, по результатам ТРУЗИ, в группе афалы к окончанию лечения наблюдалось достоверное уменьшение объема остаточной мочи (с 31,0+3,2 до 12,9+1,7 мл, р<0,001) и небольшое, но достоверное уменьшение объема простаты (с 44,6+1,3 до 41,9+1,3 см3, р<0,01).
Назначение Афалы в дозе 8 таблеток в сутки в течение 16 недель было безопасным для пациентов с ДГПЖ I-II стадии. При приеме препарата не было зарегистрировано ни одного случая возникновения нежелательных явлений, связанных с приемом афалы. Показатели общего анализа крови, общего анализа мочи и биохимического анализа крови находились в пределах нормальных значений как перед началом лечения, так и к его окончанию.
У пациентов, принимавших Афалу, уровни общего и свободного ПСА в сыворотке крови не только сохранялись в пределах нормальных значений (менее 4 нг/мл), но даже несколько снижались на 17,6% и 21,7% соответственно. Коэффициент ПСАсвободный/ПСАо6щий, на фоне лечения Афалой не изменялся, оставаясь в пределах нормальных значений. В группе простамола содержание ПСА в сыворотке не изменялось.
Таким образом, как показали результаты двух контролируемых рандомизированных клинических исследований, Афала является эффективным и безопасным средством для лечения пациентов с ДГПЖ I-II стадии.
Назначение препарата положительно влияет на клинические симптомы заболевания (прежде всего, симптомы нарушения мочеиспускания), на показатели уродинамики, а также на объем простаты и объем остаточной мочи. Влияние Афалы на уровень ПСА в сыворотке косвенно указывает на патогенетический характер действия препарата.
Представляется перспективным более длительное контролируемое исследование влияния Афалы на прогноз течения ДГПЖ.
Литература
- Боровская Т.Г., Фомина Т.И., Лоскутова О.П., Баранова О.В., Сергеева С.А., Мартюшев А.В., Эпштейн О.И. Антитела к простатоспецифическому антигену в сверхмалых дозах: влияние на морфологическое и функциональное состояние предстательной железы крыс // Бюлл. эксп. биол. мед. 2002. Прил. 4. С.104-106.
- Мартюшев-Поклад А.В., Петров В.И., Павлов В.Н., Казихинуров Р.А., Савельева К.В., Дугина Ю.Л., Эпштейн О.И., Сергеева С.А. Новый российский препарат пероральных антител для лечения ДГПЖ: первые данные контролируемого клинического исследования. // Материалы 2-й Всероссийской конференции «Мужское здоровье». Москва, 19-21.10. 2005 г. С.290-291.
- Павлов В.Н., Казихинуров Р.А., Пушкарев А.М. Изучение клинической эффективности и безопасности препарата Афала в качестве средства лечения больных с доброкачественной гиперплазией предстательной железы. // Тез. докл. XII Российского Национального конгресса «Человек и лекарство». Москва, 18-22.04. 2005 г С.503.
- Павлов В.Н., Мартюшев-Поклад А.В., Казихинуров Р.А., Сергеева С.А. Клиническая эффективность Афалы нового препарата для лечения ДГПЖ: данные сравнительного исследования // Тез. докл. Пятой международной конференции «Клинические исследования лекарстенных средств». М. 2005. С.126-127.
- Петров В.И., Павлов В.Н., Савельева К.В., Фролов М.Ю., Пушкарев А.М., Мухин А.Б., Казихинуров Р.А., Тарасов С.А., Мартюшев-Поклад А.В., Сергеева С.А., Эпштейн О.И. Сравнительное исследование эффективности препарата Афала в терапии доброкачественной гиперплазии предстательной железы. // Тез. докл. XIII Российского Национального конгресса «Человек и лекарство». Москва, 3-7.04. 2006 г. С.437.
- Юрмазов З.А., Савельева К.В., Дугина Ю.Л., Сергеева С.А., Удут В.В. Афала новое средство терапии доброкачественной гиперплазии предстательной железы. // Тез. докл. Пятой Международной конференции «Клинические исследования лекарственных средств». Москва, 13-14.10.2005. С.166-168.
- Balk SP, Ko YJ, Bubley GJ. Biology of prostate-specific antigen. J Clin Oncol. 2003 Jan 15;21(2):383-91.
- Diamandis EP. Prostate-specific antigen: a cancer fighter and a valuable messenger? Clin Chem. 2000 Jul;46(7):896-900.
- Fortier A.H., Nelson B.J., Grella D.K. et al. Antiangiogenic activity of prostatespecific antigen. // J. Natl. Cancer Inst. 1999. Vol. 91. P. 1635-1640.
- Heidtmann H.H., Nettelbeck D., Mingels A. et al. Generation of angiostatinlike fragments from plasminogen by prostate-specific antigen. // Br. J. Cancer. 1999. Vol. 81, N 8. P. 1269-1273.
- Madersbacher S, Alivizatos G, Nordling J, Sanz CR, Emberton M, de la Rosette JJ. EAU 2004 guidelines on assessment, therapy and follow-up of men with lower urinary tract symptoms suggestive of benign prostatic obstruction (BPH guidelines). Eur Urol. 2004 Nov;46(5):547-54.
- Martyushev-Poklad A., Petrov V., Dugina J., Epstein O., Sergeeva S. A Novel Oral Antibody Therapeutic for Treatment of BPH: Primary Findings of a Controlled Clinical Trial. / In: Proceedings of the VIIIth International Congress of Andrology (Sae Chul Kim, Grootegoed J.A., Chemes H.E. eds), Medimond, Bologna, Italy, 2005. P.183-188
- Sutkowski D.M., Goode R.L., Baniel J. et al. Growth regulation of prostatic stromal cells by prostate-specific antigen. // J. Natl. Cancer Inst. 1999. Vol. 91. P. 1663-1669.
- Zisman A, Lindner A, Zisman E, Lindner U, Mozes E. Prostate-specific antigen induces proliferation of peripheral blood lymphocytes and cytokine secretion in benign prostate hypertrophy patients. Eur Urol. 1999 Sep;36(3):258-65.
- Zisman A, Zisman E, Lindner A, Velikanov S, Siegel YI, Mozes E. Autoantibodies to prostate specific antigen in patients with benign prostatic hyperplasia. J Urol. 1995 Sep;154(3):1052-5.









Комментарии