Говоров А.В1., Шадеркин И. А2.
1К.м.н., ассистент кафедры урологии МГМСУ, alexgovorov@newmail.ru
2Заведующий отделом телемедицины ФГУ «НИИ Урологии Росмедтехнологий», info@uroweb.ru
Введение.
Криотерапия представляет собой аблацию ткани путём локального воздействия очень низкой температуры. Более полное определение этого термина предложено B.Patel и соавт., которые считают криоаблацию процессом локального замораживания и девитализации тканей, позволяющим прицельно создать зону некроза необходимой формы и размера для деструкции поражённой ткани и прилежащих по краю здоровых клеток.
В 1996 г. Американская ассоциация урологов признала криоаблацию простаты методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной. В Guidelines Европейской ассоциации урологов 2009 года криоаблация простаты также отнесена к альтернативным методам лечения злокачественной опухоли предстательной железы. В настоящее время криоаблация простаты представляет собой минимально инвазивный, высоко эффективный способ лечения РПЖ. Лечение проводится стационарно и амбулаторно, сопровождается небольшим количеством осложнений и позволяет добиться высокой безрецидивной выживаемости.
Первая криоаблация простаты была проведена в 1966 г. M.Gonder и соавт. с использованием одного трансуретрального датчика (иглы) 26 Fr для лечения инфравезикальной обструкции, вызванной увеличением предстательной железы. В 1974 г. M.Megalli и соавт. впервые применили введение криоиглы через прокол кожи промежности.
Криобиология.
Основными факторами, обеспечивающими действие на ткань низкой температуры, являются механический и осмотический эффекты, а также клеточная гипоксия. При криоаблации происходят денатурация белка вследствие дегидратации, переход внутриклеточной воды в экстрацеллюлярное пространство и разрыв клеточных мембран из-за образования кристаллов льда. Создаётся токсическая концентрация внутриклеточных компонентов; после быстрого замораживания и медленного оттаивания наступают термальный шок, сосудистый стаз, усиливается апоптоз.
Основными параметрами, коррелирующими с вероятностью гибели опухолевых клеток, являются быстрота замораживания ткани и достигнутая минимальная температура (табл. 1).
Таблица 1. Факторы, влияющие на гибель опухолевых клеток при криотерапии.
- Длительность замораживания
- Минимальная достигнутая температура
- Число циклов замораживания и оттаивания
- Скорость замораживания
- Скорость оттаивания
Оборудование, используемое для криоаблации простаты.
Для проведения криоаблации простаты необходимо наличие бипланового ректального ультразвукового датчика, обеспечивающего визуализацию предстательной железы как в продольной, так и в поперечной проекциях, а также пошагового стабилизирующего устройства. В аппаратах для криотерапии в качестве криогена используется аргон (под очень высоким давлением). Гелий применяется для размораживания ткани.
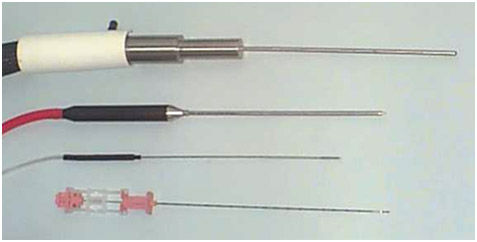
Достаточно тонкие криоиглы (17 G) позволяют создавать «ледяной шар» разной формы и диаметра (рис. 1).
Рисунок 1. Иглы для криоаблации простаты; сверху вниз – 1-го, 2-го и 3-го поколений. Самая нижняя – игла для биопсии простаты 18 G.
Для предохранения слизистой оболочки мочеиспускательного канала и наружного сфинктера от замораживания используется катетер, согревающий уретру. При помощи водяной помпы по двойному внутреннему просвету катетера в ходе всей операции циркулирует физиологический раствор, подогретый до +38-43°С со скоростью около 550 мл/мин.
Отбор пациентов для криотерапии.
Криоаблация простаты применяется как в виде первичного лечения, так и в качестве сальважной терапии.
Криотерапия простаты показана больным с локализованным РПЖ высокой степени злокачественности и / или опухолью большого объёма в том случае, если пациенты не заинтересованы в сохранении эректильной функции.
Также довольно часто криоблация используется в следующих случаях:
- у больных с клинически местнораспространённым раком (стадия Т3);
- у больных с такой стадией заболевания или степенью злокачественности опухоли, которые с высокой вероятностью будут прогрессировать без лечения (сумма баллов по Глисону ≥6, стадия >Т1а);
- у больных, не являющихся кандидатами для выполнения радикальной простатэктомии (страдающих болезнью Крона, язвенным колитом, выраженной кардиальной патологией, ожирением (вес более 150 кг));
- у больных неметастатическим раком простаты с ожидаемой продолжительностью жизни более 10 лет, которые, ознакомившись со всеми существующими методами лечения, предпочли именно криотерапию.
При помощи криоаблации предстательной железы также возможно лечение рецидива рака после лучевой терапии (дистанционной или внутритканевой).
Описано также применение криоаблации простаты при лечении местных рецидивов опухоли после радикальной простатэктомии, а также у больных местнораспространённым раком, получающих гормональную терапию, для предупреждения инфравезикальной обструкции или геморрагических осложнений.
Если объём предстательной железы превышает 50 см3, пациентам нередко назначается неоадъювантная гормонотерапия. По данным M.Ghafar и соавт., трехмесячная неоадъювантная андрогенная депривация приводит к увеличению расстояния между основанием простаты и стенкой прямой кишки, что важно для минимизации числа осложнений лечения.
Оптимальный срок для криоаблации простаты у больных с ростом уровня ПСА после лучевой терапии до конца не определён. Как правило, криотерапия не проводится раньше, чем через 18 месяцев после лучевой терапии, а решение о её начале принимается после выполнения контрольной биопсии предстательной железы.
Противопоказания к криоаблации простаты.
Относительные противопоказания к проведению криодеструкции предстательной железы аналогичны таковым при брахитерапии и включают:
- предшествующую трансуретральную резекцию (ТУР) простаты с наличием выраженного ТУР-дефекта ткани;
- наличие выраженной инфравезикальной обструкции;
- большой объём простаты;
- брюшно-промежностную резекцию прямой кишки по поводу рака в анамнезе, ректальный стеноз или другие серьёзные заболевания прямой кишки.
Перенесенная трансуретральная резекция простаты значительно повышает риск образования струпа слизистой уретры и острой задержки мочи. Инфравезикальная обструкция значительной степени выраженности также крайне затрудняет восстановление мочеиспускания после криотерапии.
Особенности техники проведения криоаблации простаты.
Перед лечением проводятся бритьё промежности и подготовка кишечника путём приёма слабительных или выполнения очистительной клизмы. Под общей или спинальной анестезией пациент укладывается в положение для операций на промежности. В мочевой пузырь по уретре устанавливается катетер Фоли, который пережимают. При помощи пошагового стабилизирующего устройства фиксируется насадка для проведения игл, после чего биплановый ультразвуковой датчик вводится в прямую кишку.
Для минимизации риска формирования в последующем уретроректальной фистулы возможно введение путём инъекции 15-30 мл физиологического раствора между стенкой прямой кишки и задней поверхностью простаты.
После определения размеров простаты криоиглы 17 G вводятся в ткань предстательной железы под ультразвуковым контролем – всего 12-20 игл на расстоянии 1 см одна от другой и от уретры (рис. 2, 3). Иглы располагаются в три или четыре горизонтальных ряда, в зависимости от высоты простаты при поперечном сканировании.
Далее в зависимости от опыта и техники врача вводятся до 5 температурных датчиков: в зону наружного сфинктера, сосудисто-нервных пучков, в средний отдел простаты и зону фасции Денонвилье.
Рисунок 2. Схематическое изображение размещения игл в простате в поперечной проекции.
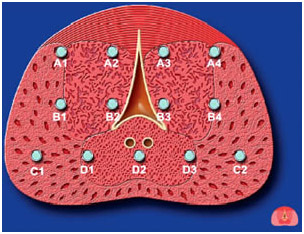
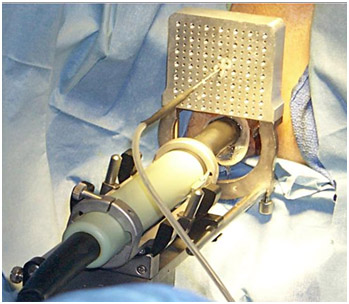
Рисунок 3. В прямую кишку введен ректальный ультразвуковой датчик, через насадку введена одна криоигла.
Температурные сенсоры в зоне наружного сфинктера и фасции Денонвилье используются для снижения риска недержания мочи или формирования уретроректальной фистулы, в то время как датчики в зоне обоих сосудисто-нервных пучков и в среднем отделе простаты позволяют контролировать адекватное замораживание ткани и достижение температуры -40°С. При этом температура в зоне наружного сфинктера, как правило, не опускается ниже 15 °С.
После введения всех игл выполняется фиброцистоскопия, чтобы убедиться, что нет перфорации стенки уретры. При необходимости осуществляется репозиция игл. Через рабочий канал фиброскопа в мочевой пузырь устанавливают проводник-струну, по которому проводится специальный катетер, согревающий уретру.
Под контролем трансректального ультразвукового сканирования начинается замораживание ткани простаты спереди назад. Сонографические характеристики замороженной и незамороженной ткани существенно различаются, что позволяет адекватно контролировать ход лечения и границу «ледяного шара». Длительность каждого их двух циклов замораживания составляет 10 минут. Процесс оттаивания может быть пассивным (15-20 минут) или активным – при помощи гелия (7-8 минут).
Если переднезадний размер (длина) простаты превышает 27 мм, перед повторным циклом замораживания иглы подтягивают ближе к верхушке предстательной железы. Сравнительно недавно появились модифицированные криоиглы 17 калибра («IceRod»), позволяющие создавать удлинённую зону холодового поражения (32 мм × 56 мм) и подходящие для лечения простат длиной более 40 мм.
После завершения циклов замораживания и оттаивания простаты, катетер, согревающий уретру, оставляется в мочеиспускательном канале ещё на 5 минут. После извлечения криоигл осуществляется механическое давление на промежность в течение 2-5 минут, а затем накладывается повязка и устанавливается катетер Фоли.
В послеоперационном периоде назначаются пероральные фторхинолоны, обезболивающие препараты и альфа-блокаторы (не менее, чем на 1 месяц). Удаление уретрального катетера проводится через 7 дней. Если у пациента имеется цистостомическая дренажная трубка, начинают её пережимать также через 5-7 дней и удаляют после восстановления самостоятельного мочеиспускания при небольшом количестве остаточной мочи.
Дальнейшее наблюдение за пациентами осуществляется путём определения уровня общего ПСА крови каждые 3 месяца. Сразу после лечения уровень ПСА значительно возрастает вследствие клеточного некроза и поступления в кровь интрацеллюлярного ПСА.
Считается, что для достижения надира ПСА требуется 3 месяца. Вместе с тем, нет единого мнения об оптимальном надире ПСА после криотерапии. Наиболее часто используется пороговое значение 0,4 нг/мл.
Некоторые авторы выполняют трансректальную биопсию простаты всем пациентам через 6-12 месяцев после криоаблации простаты.
Осложнения криоаблации простаты.
В табл. 2 представлены осложнения криоаблации простаты при использовании оборудования 2 и 3 поколения. Очевидно, что за последние годы морбидность криотерапии значительно снизилась, особенно в сравнении с результатами лечения на оборудовании 1 поколения.
Таблица 2. Осложнения криоаблации простаты в зависимости от вида лечения (первичное или сальважное) и используемого оборудования.
|
Первичная криоаблация |
Сальважная криоаблация |
||
Осложнения |
Оборудование |
Оборудование |
Оборудование |
Оборудование |
Эректильная дисфункция |
40-95 |
87 |
≈100 |
86 |
Недержание мочи* |
4-27 |
8 |
20-73 |
17 |
Отхождение струпа уретры |
4-23 |
5 |
5-44 |
11 |
Тазовая боль |
1-11 |
6 |
21-77 |
6 |
Парестезии |
2-10 |
2 |
6-10 |
6 |
Отёк мошонки |
0-5 |
2 |
0-11 |
11 |
Ректоуретральная фистула |
0-3 |
0 |
0-11 |
0 |
*Включая ургентное недержание мочи при использовании оборудования 3 поколения.
Наиболее частым осложнением криоаблации предстательной железы является эректильная дисфункция, частота которой по разным данным превышает 80%. Развитие эректильной дисфункции объясняется распространением «ледяного шара» за пределы простаты – в зону расположения сосудисто-нервных пучков.
По данным B.Donnelly, через 3 года после криодеструкции простаты у 47% пациентов эректильная функция восстанавливается (из них у 13% - без специального лечения). Авторы предположили, что данный феномен обусловлен постепенной регенерацией нервов, которые при криоаблации не пересекаются. Несмотря на эти наблюдения, считается, что криоаблация простаты не показана пациентам, заинтересованным в сохранении эректильной функции.
Отхождение струпа слизистой уретры встречается в 3,8% - 23% наблюдений. Лечение данного осложнения заключается в антибиотикотерапии и обеспечении адекватного отведения мочи. Иногда катетеризация способствует спонтанному отхождению некротических тканей, но в ряде случаев с этой целью применяется ТУРП.
Стриктура уретры или стеноз шейки мочевого пузыря редко формируются после криоаблации простаты при правильном использовании согревающего уретру катетера. При их образовании рекомендуется трансуретральная инцизия шейки мочевого пузыря и/или простаты, а также баллонная дилатация.
Ректоуретральная фистула ранее чаще имела место у больных с рецидивом рака после лучевой терапии (0 – 3%), тогда как за последние 4 – 5 лет данное осложнение практически не встречается, что обусловлено высоким качеством изображения современных ультразвуковых аппаратов, а также рутинным размещением температурных датчиков в области передней стенки прямой кишки. Диагностика уретроректальной фистулы помимо характерной клинической картины (пневматурия или выделение мочи из прямой кишки) включает в себя микционную уретрографию и компьютерную томографию, позволяющую определить локализацию свища.
Заключение.
Криоаблация предстательной железы является эффективным, минимально-инвазивным методом лечения РПЖ, который может применяться как первично, так и в случае рецидива опухоли после лучевой терапии. Благодаря усовершенствованию аппаратов для трансректальной ультрасонографии, использованию криоигл меньшего диаметра, катетера для согревания слизистой уретры, а также температурных датчиков, число осложнений криодеструкции простаты не превышает таковое при других минимально-инвазивных видах терапии РПЖ. Применение игл 17 калибра третьего поколения позволяет с высокой точностью располагать зону холодового поражения простаты для достижения максимального клинического эффекта. Изучение отдаленных результатов (наблюдение в течение 10-15 лет) криодеструкции простаты продолжается. В настоящее время «оптимальным кандидатом» для криоаблации простаты является пациент пожилого возраста, отягощённый соматически, которому не показана радикальная простатэктомия. Кроме того, учитывая растущую популярность различных видов лучевой терапии, весьма вероятен рост числа больных с рецидивом рака после её проведения. В таких случаях сальважная криоаблация простаты оказывается более эффективной, чем динамическое наблюдение и сопровождается меньшим количеством осложнений, чем спасительная радикальная простатэктомия и гормонотерапия.
16-19 марта 2010 года в ФГУ НИИ урологии Росмедтехнологий (Москва) и на кафедре урологии МГМСУ (на базе ГКБ № 50 г. Москвы) проведены первые в России операции криоаблации при раке предстательной железы и опухолях почек. Все операции прошли успешно, без осложнений. Теперь в двух ведущих клиниках России появилась еще одна возможность предложить своим пациентам малоинвазивный и высокотехнологичный метод лечения рака предстательной железы.
Криоаблация простаты – важная информация:
- Для криоаблации простаты при помощи оборудования третьего поколения используются биплановый ультразвуковой ректальный датчик, насадка-мишень и газы высокого давления – аргон для замораживания ткани и гелий – для оттаивания;
- Тонкие криоиглы 17 калибра позволяют создать «ледяной шар» необходимой формы и размера;
- Цитотоксичность криоаблации простаты обусловлена двумя основными механизмами: прямой клеточной токсичностью (разрыв клеточной мембраны кристаллами льда) и сосудистыми изменениями (тромбоз и ишемия);
- Для максимального клинического эффекта необходимо достижение минимальной температуры -40°С и поддержание её на этом уровне в течение 3 минут;
- Целесообразно использование двух циклов «замораживание – оттаивание»;
- Техника обучения криоаблации простаты сравнительно проста, в особенности для урологов, выполняющих брахитерапию, трансректальное ультразвуковое исследование и биопсию простаты;
- Ценность криоаблации простаты, как первичного метода лечения РПЖ у пациентов молодого возраста, продолжает оставаться предметом изучения. Для окончательных выводов требуются дополнительные данные и долгосрочные наблюдения;
- Число осложнений криоаблации простаты невелико;
- Нервосохраняющая методика остаётся экспериментальной;
- Сальважная криоаблация простаты – альтернатива сальважной радикальной простатэктомии;
- Возможно повторное проведение криоаблации простаты.









Комментарии