А.З. Винаров1 , А.М. Дымов2 , Н.И. Сорокин2 , В.П. Минаев3 , В.Ю. Лекарев2
1 Кафедра урологии ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России; Россия, 119992 Москва, ул. Большая Пироговская, 2, стр. 1;
2 клиника урологии ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России; Россия, 119992 Москва, ул. Большая Пироговская, 2, стр. 1;
3 ООО НТО «ИРЭ-Полюс»; Россия, 141190 Московская обл., Фрязино, пл. Введенского, 1
Контакты: Андрей Зиновьевич Винаров avinarov@mail.ru
Введение
Лазерное излучение с длиной волны ~2 мкм рассматривается в урологии в качестве одного из наиболее перспективных, поскольку оно может быть эффективно использовано и для оперативных вмешательств на мягких тканях, и для литотрипсии [1]. Неудивительно, что аппараты этого диапазона выпускаются многими производителями, каждый из которых настаивает на преимуществе своей продукции.
Цель исследования – провести сравнительный анализ свойств излучений разных лазеров с длиной волны ~2 мкм, возможностей лазерных аппаратов, разработанных на их основе, в урологии, а также осветить перспективы их совершенствования.
Типы лазеров, генерирующих излучение с длиной волны ~2 мкм
Сразу отметим, что принятое деление лазеров на «тулиевые» и «гольмиевые» не дает исчерпывающей их характеристики. Дело в том, что характеристики лазеров и возможности аппаратов, созданных на их основе, определяются не только ионом активатора лазера, но и матрицей, в которую он внедрен. В настоящее время выпускаются аппараты, использующие лазеры на:
- алюмоиттриевом гранате, активированном гольмием (АИГ:Но),
- алюмоиттриевом гранате, активированном тулием (АИГ:Тm),
- волокне, активированном тулием (Тm).
Для применения в урологии представляют интерес несколько близких по выходным параметрам аппаратов, включая отечественный аппарат «Уролаз» (регистрационное удостоверение № РЗН 2017/5446), генерирующих лазерное излучение с длиной волны ~2 мкм и максимальной выходной мощностью этого излучения 120 Вт (см. таблицу, рис. 1).
Сравнительная характеристика аппаратов, генерирующих излучение с длиной волны ~2 мкм
| Характеристика | Pulse 120H | RevoLix | Vеla-XL | «Уролаз» |
| Активная среда | Алюмоиттриевый гранат, активированный гольмием (АИГ:Но) | Алюмоиттриевый гранат, активированный тулием (АИГ:Тm) | Волокно, активированное тулием (Tm) | Волокно, активированное тулием (Tm) и эрбием (Er) |
| Длина волны λ, мкм | 2,1 | 2,01 | 1,94 | 1,94 + 1,55 |
| Мощность, Вт | 120 (средняя) | 120 | 120 | 120 + 15 |
| Режим работы | Имп. 0,2–6,0 Дж, 5–80 Гц | Имп. 50 мс – 1 с, непрерывный | Имп. 1 мс – непрерывный | Имп. 0,2 мс – 1 с, непрерывный |
| Длина волны лазера наведения, мкм | 0,53 | 0,53 или 0,635 | 0,53 | 0,53 |
| Масса, кг | 245 | 150 | 150 | <40 |
| Габариты, см | 47 × 116 × 105 | 42 × 95 × 89 | 30 × 95 × 105 | 55 × 46 × 29 |
| Питание | 200–240 В, <46А | 200–240 В, <15А | 200–240 В, <16А | 220 ± 10 %, <10А |
| Изготовитель | Lumenis, Израиль | Lisа Laser, ФРГ | StarMedTec, ФРГ | НТО «ИРЭ-Полюс», РФ |

Рис. 1. Лазерные аппараты, генерирующие излучение с длиной волны ~2 мкм: а – Pulse 120H; б – RevoLix; в – Vela-XL; г – «Уролаз»
Необходимо отметить, что в аппарате «Уролаз» в соответствии с патентом [2] реализована возможность подачи в рабочий световод дополнительного излучения с длиной волны 1,55 мкм. При этом мощности и временные режимы работы этих излучений регулируются независимо.
Для уменьшения инвазивности хирургических вмешательств желательно применение световодов с минимальным диаметром светонесущей сердцевины. Хорошее качество излучения волоконных лазеров позволяет легко вводить излучение в оптическое волокно диаметром 100 мкм и меньше. Для получения выходного излучения в световоде диаметром около 200 мкм в аппаратах на кристаллах приходится использовать так называемые тейперированные (tapered – конические, зауженные) световоды, диаметр светонесущей сердцевины которых на входном оптическом разъеме больше, чем диаметр на выходном (дистальном) конце волокна. И даже в этом случае не удается достигнуть диаметра 200 мкм, так что используемые в аппаратах компании Lumenis световоды НВ-200 и RBLF-200 имеют на выходе диаметр светонесущей сердцевины 274 мкм.
Высокая эффективность диодной накачки позволяет улучшить весогабаритные характеристики аппаратов по сравнению с аппаратами, использующими лазеры с ламповой накачкой, и уменьшить их энергопотребление. Дальнейшее улучшение этих характеристик реализуется при переходе с жидкостного охлаждения на воздушное, что применено в аппарате «Уролаз».
Лазеры на АИГ:Но с ламповой накачкой не позволяют обеспечить непрерывный режим работы и имеют только импульсно-периодический режим, причем длительность импульсов и частота их следования могут изменяться в ограниченных диапазонах. Лазеры на АИГ:Тm и Tm-активированном волокне с накачкой лазерными диодами могут функционировать как в непрерывном, так и в импульсно-периодическом режиме, в котором длительность импульсов и пауз задается временем включения и выключения накачки. Дополнительные возможности появляются при модуляции мощности питания диодов накачки, благодаря которой можно управлять формой импульсов излучения. На рис. 2 представлены для примера типичные осциллограммы импульса излучения аппарата VersaPulse Power Suite P100 (предшественника Pulse 120H с мощностью излучения 100 Вт) и аппарата «Уролаз» при генерации прямоугольных импульсов, длительность которых в «Уролазе» может изменяться от 0,05 мс до непрерывного режима.
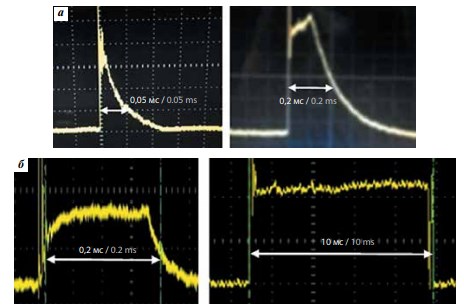
Рис. 2. Форма импульсов аппаратов: а – VersaPulse Power Suite P100 (диапазон длительностей импульсов 0,05–0,3 мс), б – «Уролаз»
Таким образом, при применении волоконных лазеров открываются широкие возможности оптимизации режимов работы лазерных аппаратов для различных применений.
Поглощение излучения
Результаты воздействия лазерного излучения на биологические объекты определяются процессом поглощения его в веществе с последующим превращением поглощенной энергии в тепло, а значит, количеством энергии, доставленной излучением в точку воздействия, и величиной той части этой энергии, которая была поглощена. При распространении излучения в биоткани происходит его поглощение хромофорами (компонентами биоткани, поглощающими излучение) и его рассеяние на неоднородностях. Оба этих процесса ведут к ослаблению излучения. При распространении излучения через прозрачные среды (вода, физиологический раствор) рассеяние отсутствует, и ослабление определяется поглощением в среде. Именно величина ослабления определяет толщину слоя, в котором будет поглощено излучение и выделится тепло.
Коэффициент поглощения в хромофорах определяет соотношение между величинами поглощенных в них энергий. Основными хромофорами для излучения рассматриваемой области инфракрасного диапазона являются вода и гемоглобин. На рис. 3 для диапазона длин волн 1,4–2,1 мкм представлена зависимость коэффициента поглощения µа излучения в воде [3]. Близкая зависимость поглощения у коэффициента поглощения в крови (рис. 4) [4].
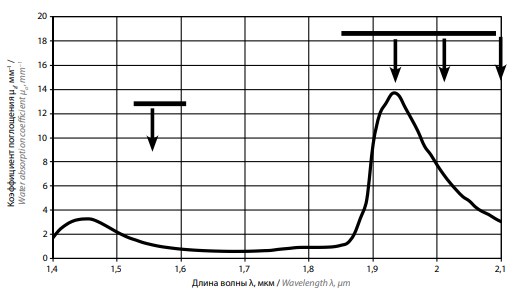
Рис. 3. Зависимость коэффициента поглощения в воде от длины волны излучения (стрелками показаны длины волн 1,55; 1,94; 2,01 и 2,1 мкм)
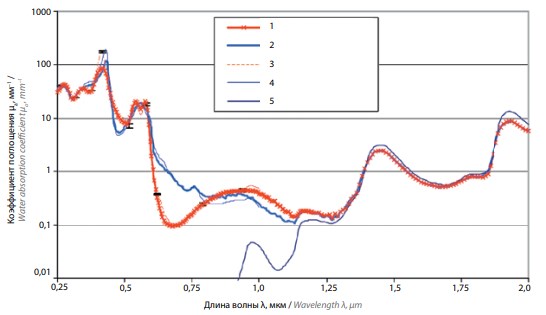
Рис. 4. Зависимость коэффициентов поглощения от длины волны излучения в суспензиях оксигенированных (1) и неоксигенированных (2) эритроцитов, моделирующих кровь с гематокритом 33,2 %, растворах окси- (3) и деоксигемоглобина (4) с концентрацией 96,5 г/л и воде (5) (адаптировано из [4])
Принципиальная разница между лазерами на кристаллах и волоконными лазерами заключается в том, что лазеры, использующие кристаллические среды, в частности АИГ:Но и АИГ:Tm, генерируют излучение с малой шириной спектра на определенной длине волны (показаны стрелками на рис. 3), в то время как волоконные лазеры способны генерировать излучение в широких полосах спектра, и можно выбрать рабочую длину волны в пределах этих полос. Широкими линиями на рис. 3 представлены области, в которых возможна реализация генерации в лазерах на Tm- и Er-активированных волокнах, – 1,86–2,09 мкм для тулия и 1,53–1,62 мкм для эрбия [5]. В частности, для медицинского применения лазеров на Tm-активированном волокне обычно выбирают длину волны рабочего излучения около 1,94 мкм (указана на рис. 3 стрелкой), соответствующую, с одной стороны, максимальной эффективности генерации и, с другой стороны, максимальной величине µа в воде и цельной крови.
Кроме того, стрелкой на рисунке отмечена длина волны излучения дополнительного лазера на Er-активированном волокне (1,55 мкм), выводимого в аппарате «Уролаз» через то же волокно, что и основное излучение (1,94 мкм).
Именно величина поглощения µа определяет глубину проникновения лазерного излучения в биоткани, а значит и область, в которой выделяется тепло при поглощении лазерного излучения.
В свою очередь, коэффициенты поглощения лазерного излучения в воде и цельной крови на длине волны 1,94 мкм, используемой в аппаратах Vеla-XL и «Уролаз», примерно в 2 раза выше, чем на длине волны 2,01 мкм (RevoLix), в 4 раза выше, чем на длине волны 2,1 мкм (VersaPulse Power Suite P100 и Pulse 120H), и примерно в 10 раз выше, чем на длине волны 1,55 мкм.
Воздействие на мягкие ткани
Применение лазерного излучения для рассечения и абляции (вапоризации) биоткани требует высокой скорости ее удаления с минимальным нежелательным тепловым повреждением окружающих тканей и надежной остановкой кровотечения. Для решения первых 2 задач требуется сильное поглощение излучения, поскольку в этом случае энергия излучения поглощается в малом объеме и происходит быстрый локальный нагрев ткани до температур, вызывающих ее абляцию. Естественно, при уменьшении области поглощения энергии уменьшается толщина зоны прилегающих к месту воздействия тканей, подвергающихся нежелательному нагреву. С этой точки зрения эффективность воздействия растет в ряду длин волн излучения 2,1; 2,01 и 1,94 мкм.
Вместе с тем для остановки кровотечения необходимо обеспечить достаточную глубину нагрева до температуры коагуляции прилегающих к области воздействия тканей. Поскольку длина волны 1,94 мкм может оказаться недостаточной для такого нагрева, в аппарате «Уролаз» предусмотрена возможность добавления к основному излучению дополнительного излучения с длиной волны 1,55 мкм, более глубоко проникающего в воду и кровь. Благодаря этому можно увеличить толщину слоя коагулированной ткани, достигая более надежной остановки кровотечения. Степень коагуляции можно изменять в некоторых пределах, поскольку мощность этого излучения может регулироваться независимо от мощности основного излучения.
Одной из актуальных проблем урологии является доброкачественная гиперплазия (аденома) предстательной железы (ПЖ). Для оперативного лечения этого заболевания применяется традиционно открытое хирургическое вмешательство, сопровождающееся большим числом осложнений по сравнению с современными малоинвазивными технологиями, которые все более широко применяются в клинической практике. Схематически ход операции с применением лазерного излучения при 2 подходах изображен на рис. 5.
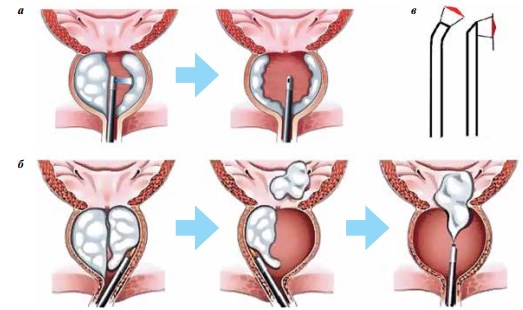
Рис. 5. Трансуретральное удаление аденоматозной ткани: а – при вапоризации; б – при энуклеации лазерным излучением; в – волоконные инструменты, используемые при вапоризации, – twister и side-fiber
В настоящее время при лечении гиперплазии ПЖ все большее внимание привлекает малоинвазивный метод трансуретральной лазерной энуклеации (рис. 5б), при котором лазерным излучением, подводимым с помощью волоконного световода, рассекают сращения аденоматозной ткани с капсулой и коагулируют кровоточащие сосуды. Эта граница хорошо дифференцируется через видеоканал эндоскопа. Отделенную ткань выталкивают в мочевой пузырь, откуда извлекают с помощью морцеллятора.
Эта методика имеет следующие преимущества по сравнению с вапоризацией:
- не требуется время и энергия лазерного излучения на испарение всей патологической ткани, что уменьшает длительность операции;
- повышается точность воздействия, особенно на границе патологической и здоровой тканей, благодаря этому возможно полное удаление патологической ткани без увеличения риска интраоперационных осложнений (повреждения капсулы ПЖ или стенки мочевого пузыря);
- появляется возможность забора ткани для гистологического исследования;
- операция выполняется с помощью самого простого и дешевого инструмента с торцевым выводом излучения, допускающего многократную стерилизацию и повторное применение.
Аналогичный подход применяется и для удаления неинвазивного рака мочевого пузыря [8].
Остановимся на характере воздействия лазерного излучения на биоткани в газовой среде и среде физиологического раствора. В газовой среде (рис. 6) при разогреве вещества до температуры выше 250 °С в месте поглощения излучения происходит карбонизация биоткани, из-за чего резко увеличивается коэффициент поглощения и уменьшается область, в которой выделяется энергия поглощенного излучения. Температура этой области возрастает до величины порядка 1000 °С. Это в свою очередь ведет к ускорению абляции биоткани. При контакте конца световода происходит и его разогрев до столь же высоких температур. В результате к действию излучения добавляется действие раскаленного конца световода [9]. При рассечении биоткани образуется дым, который необходимо отсасывать.

Рис. 6. Эндоскопическая резекция почки в газовой среде: 1 – световод; 2 – место контакта с биотканью
При энуклеации ПЖ и оперативных вмешательствах внутри мочевого пузыря воздействие осуществляется в физиологическом растворе, т. е. фактически в водной среде, а ткани слабо наполнены кровью. В данных условиях процессы оказываются более сложными. При отсутствии контакта с биотканью лазерное излучение поглощается в тонком слое жидкости вблизи выходного торца световода. Это ведет к выделению растворенных в жидкости газов и сверхинтенсивному кипению [10, 11]. В результате формируется интенсивная двухфазная (жидкостно-газовая) струя (далее просто «струя»), образуемая мелкими (около 50 мкм в диаметре) парогазовыми пузырями и разогретой жидкостью. Появление этой струи носит пороговый характер: для излучения 1,94 мкм и диаметра светонесущей сердцевины волокна 0,4 мм она проявляется при мощности излучения примерно >3 Вт. Скорость потока в этой струе быстро нарастает с мощностью излучения – от 85 ± 15 мм/с при Р = 3 Вт до 450 ± 65 мм/с при Р = 10 Вт [11]. При увеличении диаметра волокна с 0,4 до 0,6 мм мощность необходимо увеличить примерно вдвое (пропорционально площади сечения волокна). Благодаря высокой кинетической энергии струи она рассекает биоткани.
На рис. 7 представлены фотографии рассечения биоткани струей при лазерной энуклеации ПЖ, осуществляемой излучением 1,94 мкм в импульсно-периодическом режиме со средней мощностью 60 Вт, энергией импульсов 1,4 Дж и длительностью импульсов 12 мс. В некоторые моменты парогазовые микропузырьки сливаются, начинает формироваться (рис. 7б) и формируется (рис. 7в) макропузырек размером 3–5 мм.
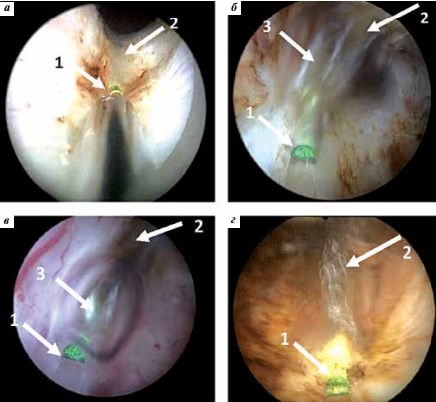
Рис. 7. Лазерное воздействие на аденоматозную ткань: а, б, в – при отсутствии контакта с тканью; г – при контакте с тканью; 1 – конец световода; 2 – струя; 3 – макропузырек
Длина секущей части струи при пиковой мощности излучения 120 Вт составляет около 3–5 мм. При конденсации пар отдает свое тепло биоткани, коагулируя прилегающие к разрезу слои. Поскольку температура струи существенно меньше температуры карбонизации (около 250 °С), то карбонизация при рассечении практически отсутствует.
Если происходит плотный контакт конца световода с биотканью, то он разогревается на короткое время (1 на рис. 7г) и начинает светиться, при этом из-за пиролиза биоткани происходит карбонизация, значительная часть обуглившейся ткани сгорает из-за повышенного поглощения излучения. При этом в течение всего времени наблюдается струя (2 на рис. 6), осуществляющая рассечение ткани.
На рис. 8 представлена фотография резекции стенки мочевого пузыря с опухолью единым блоком, выполненной излучением 1,94 мкм со средней мощностью 10 Вт (1 Дж, 10 Гц) при бесконтактном воздействии. Даже при такой небольшой мощности излучения интенсивности струи достаточно для резекции ткани.
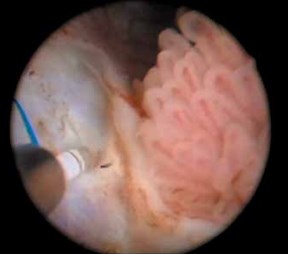
Рис. 8. Лазерная энуклеация опухоли мочевого пузыря единым блоком
На фотографии хорошо видно мышечный слой, отсутствие карбонизации в зоне воздействия. Резекция производится очень деликатно, в отличие от вапоризации опухоли, без образования фрагментов патологической ткани, которые могут стать причиной диссеминации.
Техника проведения энуклеации аденомы ПЖ или резекции стенки мочевого пузыря, а также их эффективность при применении аппаратов с лазером на АИГ:Но (Lumenis Pulse-120) и тулиевым волоконным лазером оказываются близкими. При этом не следует забывать о преимуществах отечественного аппарата «Уролаз» с лазером на Tm-активированном волокне в части веса, габаритов и удобства работы. Кроме этого, сравнение проводилось при близких режимах работы, а тулиевые лазеры позволяют оптимизировать воздействие за счет варьирования параметров. Аппарат «Уролаз», благодаря наличию 2-го излучения с длиной волны 1,55 мкм, дополнительно расширяет лечебные возможности.
При применении лазерного излучения с длиной волны ~2 мкм для хирургических вмешательств в срeде физиологического раствора характер воздействия существенно меняется по сравнению с газовой средой из-за сверхинтенсивного кипения, следствием которого является образование двухфазной струи из парогазовых микропузырьков и горячей воды.
При отсутствии контакта на стадии двухфазной струи:
- температура не поднимается выше 100 °С, практически нет карбонизации;
- практически отсутствуют оторвавшиеся частицы – причина диссеминации;
- глубина воздействия значительно превышает глубину поглощения излучения в воде.
Микропузырьки могут слиться в макропузырек, слабо поглощающий излучение, которое проходит до стенки пузырька, противоположной торцу волокна. Если дальше располагается физиологический раствор, то опять формируется двухфазная струя, которая может воздействовать на ткани.
Если в конце пузырька располагается камень, то излучение будет на него воздействовать (явление, котороe коллеги из Lumenis назвали эффектом Мозеса). При этом повышается эффективность литотрипсии и уменьшается ретропульсия камней. Большее поглощение на 1,94 мкм по сравнению с 2,1 мкм, по-видимому, приближает начало эффекта Мозеса, а значит, повышает эффективность литотрипсии и уменьшает ретропульсию, что подтверждено экспериментально.
В работе V.I. Yusupov и соавт. показано, что режим сверхинтенсивного кипения может быть реализован и при использовании лазерного излучения, слабо, по сравнению с 1,94 мкм, поглощаемого водой, например с длиной волны 0,97 мкм. Но для этого необходимо создать поглощающий слой на торце световода. Отсюда следует, что если удастся создать такой слой, обладающий достаточной прочностью, то режим гидродинамического рассечения тканей будет реализован с помощью более простых и дешевых аппаратов на основе полупроводниковых лазеров [12].
Возможно, при подаче воды в зону воздействия при использовании лазерного излучения в газовой среде можно будет реализовать режим гидродинамической резекции, избавиться от карбонизации в месте разреза и уменьшить количество дыма, образующегося в процессе лазерного рассечения в газовой среде.
Заключение
- Лазерные аппараты с длиной волны излучения ~2 мкм – эффективный инструмент для выполнения малоинвазивных трансуретральных вмешательств при гиперплазии ПЖ и неинвазивном раке мочевого пузыря.
- В отличие от воздействия в воздушной среде, рассечение биоткани в водной среде (физиологическом растворе) осуществляется двухфазной (жидкостно-газовой) струей. Она состоит из разогретой жидкости и мелких (около 50 мкм в диаметре) парогазовых пузырей, образующихся в результате сверхинтенсивного кипения в тонком (порядка 0,1 мм) слое жидкости, в котором происходит поглощение лазерного излучения.
- В аппаратах с волоконными лазерами рабочие параметры могут изменяться в более широких пределах по сравнению с лазерами на кристаллах, что позволяет продолжить исследования по оптимизации режимов работы для повышения эффективности.
- Аппараты с лазерами на Тm-активированном волокне обладают лучшими эксплуатационными характеристиками (весом, габаритами, энергопотреблением и надежностью) и практически не требуют инженерного обслуживания при эксплуатации.
Литература
- Herrmann T.R., Liatsikos E.N., Nagele U. et al. EAU guidelines on laser technologies. Eur Urol 2012;61(4): 783–795. DOI: 10.1016/j.eururo. 2012.01.010. PMID: 22285403.
- Патент на изобретение № 2535454/10.12.2014. Бюл. № 34. Минаев В.П. Способ рассечения биоткани лазерным излучением и устройство для его осуществления. [Patent RUS № 2535454/10.12.2014. Bull. No. 34. Minaev V.P. Method for biotissue incision by laser light and device for implementing it (In Russ.)]. Доступно по: http://www. freepatent.ru/images/img_patents/2/ 2535/2535454/patent-2535454.pdf. Ссылка активна на 26.04.2018.
- Kou L., Labrie D., Chylek P. Refractive indices of water and ice in the 0.65 to 2.5 µm spectral range. Appl Opt 1993;32(19):3531–40. DOI: 10.1364/ AO.32.003531. PMID: 20829977.
- Friebel M., Helfmann J., Netz U., Meinke M. Influence of oxygen saturation on the optical scattering properties of human red blood cells in the spectral range 250 to 2000 nm. J Biomed Opt 2009; 14(3):034001. DOI: 10.1117/1.3127200. PMID: 19566295.
- Курков А.С., Дианов Е.М. Непрерывные волоконные лазеры средней мощности. Квантовая электроника 2004;34(10):881–900. [Kurkov A.S., Dianov E.M. Medium-power continuouswave fiber laser. Kvantovaya elektronika = Quantum Electronics 2004;34(10):881–900. (In Russ.)].
- Fried N.M., Murray K.E. High-power thulium fiber laser ablation of the canine prostate. Progress in Biomedical Optics and Imaging: Proceedings of SPIE 2005; 5686:176–82. DOI: 10.1117/12.586358.
- Sadykov A.R., Dymov A.M., Enikeev N.N. et al. Tm fiber laser application for soft tissue surgery. In: Proceedings of the 17th International Conference “Laser Optics 2016”. Saint Petersburg, 2016. P. 77.
- Cорокин Н.И. Лазерная резекция стенки мочевого пузыря с опухолью единым блоком. В сб.: Научно-практическая конференция с международным участием «Высокие технологии в урологии». М., 2017. [Sorokin N.I. Laser resection of the bladder wall with a tumor as a single block. In: Scientific-andpractical conference with international participation “High technologies in urology”. Moscow, 2017. (In Russ.)].
- Плужников М.С., Березин Ю.Д., Иванов Б.С. Лазерный коагулятор в оториноларингологии. Вестник оториноларингологии 1986;(6):68–72. [Pluzhnikov M.S., Berezin Yu.D., Ivanov B.S. Laser coagulator in otorhinolaryngology. Vestnik otorinolaringologii = Bulletin of Otorhinolaryngology 1986;(6):68–72. (In Russ.)].
- Чудновский В.М., Буланов В.А., Юсупов В.И. Лазерное индуцирование акустогидродинамических эффектов в хирургии. Фотоника 2010;(1):30–6. [Chudnovskiy V.M., Bulanov V.A., Yusupov V.I. Laser induction of acoustic hydrodynamical effects in medicine. Fotonika = Photonics 2010;(1):30–6. (In Russ.)].
- Чудновский В.М., Юсупов В.И., Дыдыкин А.В. и др. Лазероиндуцированное кипение биологических жидкостей в медицинских технологиях. Квантовая электроника 2017;47(4):361–70. [Chudnovskiy V.M., Yusupov V.I., Dydykin A.V. Laser-induced boiling of biological liquids in medical technologies. Kvantovaya elektronika = Quantum Electronics 2017;47(4):361–70. (In Russ.)].
- Yusupov V.I., Chudnovskiy V.M., Bagratashvili V.N. Laser-induсed hydrodynamics in water-saturated biotissues. 1. Generation of bubbles in liquid. Laser Physics 2010;20(7):1–6.
Статья опубликована в журнале "Андрология и генитальная хирургия" №2 2018, стр. 21-29











Комментарии