М.Э. Ситдыкова, А.Ю. Зубков
ФГБОУ ВО «Казанский государственный медицинский университет» МЗ РФ; Казань, Россия
Введение
Радикальная цистэктомия с лимфодиссекцией и различными видами кишечной деривации мочи является золотым стандартом лечения пациентов с мышечно-инвазивным раком мочевого пузыря [1]. Несмотря на достаточно большое количество клинических наблюдений больных после цистэктомии с формированием изолированного кишечного трансплантата, остается недостаточно неизученным гистоморфологическое состояние и механизмы трансформации кишечного эпителия ортотопического мочевого пузыря [2-5].
Цель исследования – изучение морфологических адаптативно-компенсаторные изменений в стенке кишечного трансплантата (КТ) и их связь с гомеостазом на различных этапах после оперативного лечения.
Материалы и методы
Исследовано морфологическое состояние стенки КТ у 42 больных, подвергшихся операции цистэктомии с формированием ортотопического кишечного мочевого пузыря (15-подвздошная кишка, 27 – сигмовидная) на сроках от 1 до 6,5 мес. и 1 года и более после операции. У всех пациентов использована оригинальная методика «создания «У»-образного, анти- или изоперистальтического артифициального кишечного мочевого пузыря из изолированного отрезка тонкого или толстого кишечника по методике Э.Н. Ситдыкова. Гистологический материал забирался путем эндоскопической «холодной» щипковой биопсии и исследовался с помощью окраски гематоксилином, эозином по Ван-Гизону и муцикармином.
Результаты
Изменения, происходящие в стенке КТ начинаются с момента попадания в его просвет необычного для кишки содержимого, т.е. мочи, что происходит в сочетании с изменением стереотипной динамики органа. Выраженные изменения наблюдаются во всех отделах стенки тонкой кишки. Эпителий практически отсутствует во всех полях зрения, а единичные клетки эпителиального покрова обнаруживаются лишь в глубине крипт (рис. 1)
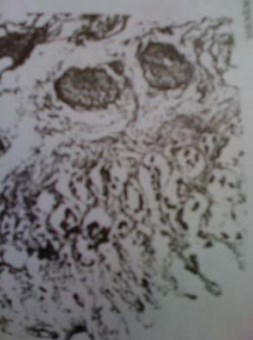
Рисунок 1. Тонкокишечный трансплантат (3 месяца после операции). Некроз поверхностных отделов ворсин, десквамация эпителия, небольшие группы эпителиальных клеток в глубине крипт
В оставшихся клетках местами наблюдается пикноз ядер с их гиперхромией, набухание или уменьшение размеров цитоплазмы, в которой отмечаются явления вакуольной дистрофии. Значительная часть оставшихся клеток теряет связь с базальной мембраной, десквамируются и находятся вблизи неё. Количество кишечных ворсин неравномерно уменьшается, высота ворсин снижается, что сопровождается расширением основания. Они представляют собой небольшие холмообразные возвышения, причём крипты не определяются за счёт выравнивания собственной пластинки кишки. Подслизистый слой и строма ворсин несколько отёчны, что сопровождается спадением лимфатических сосудов. Кровеносные сосуды, напротив, полнокровны с выраженным периваскулярным отёком. По мере приближения к просвету кишки наблюдаются тромбозы сосудов, выраженные в зонах фибриноидных некрозов поверхностных отделов слизистой, местами достигая тотального поражения (рис. 2).
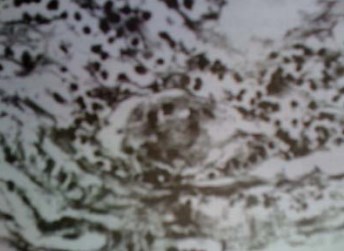
Рисунок 2. Тонкокишечный трансплантат (3 месяца после операции). Тромбоз кровеносного русла поверхностных отделов слизистой кишки
Строма ворсинок диффузно инфильтрирована с преобладанием плазмоцитов, лимфоцитов и макрофагов, с незначительным количеством эозинофилов и сегментоядерных лейкоцитов. Небольшая часть клеточного инфильтрата, диффузно располагается и в подслизистом слое, но число клеток вблизи базальной мембраны низкая, в мышечном слое встречаются лишь единичные лимфоидные элементы. С другой стороны, в подслизистом слое оказываются наиболее выраженные локальные лимфоидные скопления, местами формирующие очаги типа фолликулов без центров размножения.
Изменения, происходящие в стенке толстой кишки в период от 1 до 6,5 месяцев, имеют аналогичные по характеру и выраженности проявления, описанные в КТ, сформированном из тонкой кишки. Наблюдается выраженная десквамация эпителия слизистой оболочки в основном в апикальных отделах кишечных ворсин, сопровождающаяся некрозом стромы. У основания кишечных ворсин и криптах сохраняются небольшие пласты эпителия, а часть клеток здесь находится в состоянии некробиоза или некроза. Сами клетки меняют свои типичные продолговатые очертания и оказываются деформированными или округлыми. Эпителиальные клетки располагаются в виде монослоя цилиндрических клеточных элементов, среди которых нередки дистрофия и некрозы с полным разрушением слизистой (рис. 3).
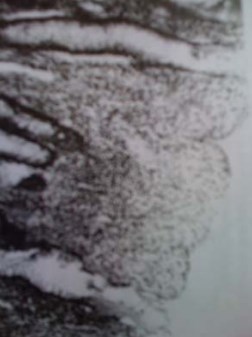
Рисунок 3. Толстокишечный трансплантат (6 месяцев после операции). Десквамация эпителия поверхностных отделов слизистой уплощенной поверхности кишки
Высота ворсин снижается, а верхние отделы их уплощаются. В некоторых участках ворсины принимают горизонтальное положение, тесно прилегая одна к другой, образуя ровную внутреннюю поверхность. На отдельных участках наблюдаются фибриноидные некрозы, которые распространяются на большую глубину и захватывают расположенные поверхностно кровеносные сосуды, часть из которых тромбирована. Большое количество кровеносных сосудов в подслизистом слое гиперемировано, в то время как лимфатические капилляры, как правило, находятся в спавшемся состоянии. В участках разрушения поверхностных отделов слизистой в зонах некрозов наблюдается интенсивная лимфоидная инфильтрация. В других участках клеточная инфильтрация носит преимущественно диффузный характер и представлена лимфоцитами и макрофагами. В строме ворсин и подслизистом слое наблюдается выраженный отёк, менее заметный в мышечном слое.
На сроках более 12 месяцев после операции наблюдается постепенное восстановление слизистой тонкокишечного КТ. Целостная эпителиальная выстилка покрывает практически всю внутреннюю поверхность резервуара, и лишь апикальные отделы единичных ворсин оказываются лишенными эпителиального покрова в виде площадок. Слизистая представлена преимущественно бокаловидными клетками. Эти клетки имеют гиперхромные ядра, расположенные в базальном отделе и цитоплазму, расширенную в виде большой капли в апикальном отделе. Между слизистыми клетками располагаются цилиндрические всасывающие клетки, имеющие признаки атрофии. В апикальной части отдельных ворсин число таких атрофичных клеток значительно возрастает, и они образуют своеобразное клеточное покрытие в виде плотного слоя («частокол») веретеновидных клеточных элементов (рис. 4).
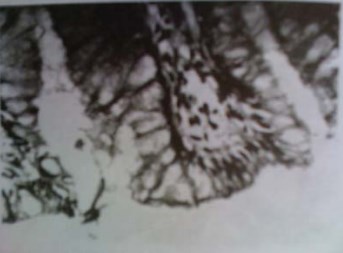
Рисунок 4. Тонкокишечный трансплантат (12 месяцев после операции). Слой («частокол») веретеновидных цилиндрических клеток на утолщенной верхушке ворсины
В тоже время уплощенные апикальные отделы части ворсин оказываются лишенными эпителиального покрова. В этих участках нередко наблюдаются фибриноидные некрозы и тромбозы сосудов поверхностной зоны. Размеры ворсин, особенно их высота, заметно снижаются, что сопровождается уменьшением их поперечного размера. Соответственно снижается и число ворсин на единицу площади КТ
Слизистая толстокишечного ортотопического мочевого пузыря через 12 месяцев восстанавливалась в большей части, лишь ламинарные отделы ворсин иногда оказывались лишенными эпителиальной выстилки. Клетки, выстилающие как поверхностные отделы, так и большую часть в глубине крипт, по своему морфологическому строению идентичны слизистым (бокаловидным) (рис. 5).
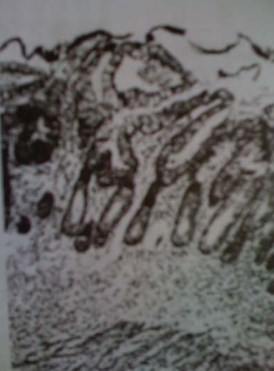
Рисунок 5. Толстокишечный трансплантат (12 месяцев после операции). Слизистые клетки, образующие выстилку кишечного резервуара
В строме ворсин и подслизистом слое с небольшим количеством рыхловолокнистой соединительной ткани диффузно располагаются единичные лимфоциты, макрофаги и лимфоидные фолликулы. Лимфатические сосуды не определяются, а количество кровеносных снижено и часть из них склерозирована и тромбирована в поверхностных отделах стенки КТ. Мышечный слой не претерпевает значительных морфологических изменений, кроме небольшой атрофии мышечных элементов. В отдельных участках поверх уплощенных ворсин и кишечных ямок нарастает монослой из кишечного эпителия с большим количеством цилиндрических клеток (рис. 6).
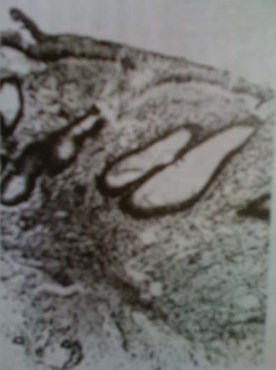
Рисунок 6. Толстокишечный трансплантат (12 месяцев после операции). Монослой цилиндрических клеток нарастающий на поверхность слизистой.
Обнаруженные изменения идентичны острому альтеративно-десквамативному энтериту и колиту, что предполагает нарушение всасывания преимущественно за счет потери эпителиального покрова кишки. С другой стороны, резкое венозное полнокровие способствует не только нарушению всасывания, но и, напротив, может приводить к выделению определенного количества жидкости из стенки поврежденной кишки. Следовательно, уже на ранних этапах повреждение слизистой КТ сопровождается блокированием всасывания, что делает физиологичным выполнение им своих функций при определенных вторичных изменениях стенок.
Через год происходит регенерация и перестройка эпителия, выражающаяся в атрофии и уменьшении числа всасывающих цилиндрических клеток и увеличении количества слизеобразующих бокаловидных элементов. Это в сочетании с уменьшением числа и размеров ворсин и крипт, редукцией лимфатического русла и склерозом кровеносных сосудов и стромы блокирует всасывание. Увеличение количества слизеобразующих бокаловидных клеток, обеспечивает создание барьера, защищающего слизистую КТ от воздействия мочи.
Заключение
Морфологические изменения, происходящие в стенке КТ под воздействием мочи, способствуют сохранению гомеостаза и являются идентичными при толсто- и тонкокишечном варианте пластики мочевого пузыря.
Литература
- Рак мочевого пузыря (классика и новации). Под ред. Когана М.И. М.:Медфорум; 2017.
- Цветов Е.П. Морфологические изменения трансплантата при кишечной пластике мочевого пузыря. Новый хирург. Архив. 1961;1:48-54.
- Шахов Е.В. Гистологическая характеристика тонкокишечного трансплантата используемого для пластики мочевого пузыря в эксперименте. Материалы 2-го Всесоюз.симпозиума. Горький; 1973.
- Комяков Б.К., Аничков Н.М., Бодарева Н.В. Морфологическая адаптация артифициального мочевого пузыря. Материалы Пленума РОУ. Краснодар, 2010.
- Перепечай В.А. Оптимизация хирургического лечения мышечно-инвазивного и местно распространенного рака мочевого пузыря. Дисc. …докт.мед.наук. Ростов-на-Дону. 2016:420.
- Yuan J, Lin H, Li P, Zhang R, Luo A, Berardinelli F, Dai Y, Wang R. Molecular mechanisms of vacuum therapy in penile rehabilitation: a novel animal study. EurUrol. 2010;58:773-80. DOI:10.1016/j.eururo.2010.07.005
- Lin H, Yang W, Zhang J, Dai Y, Wang R. Penile rehabilitation with a vacuum erectile device in an animal model is related to an antihypoxic mechanism: blood gas evidence. Asian J Androl. 2013;15:387. DOI:10.1038/aja.2013.18
- Yuan J, Hoang A, Romero C, Lin H, Dai Y, Wang R. Vacuum therapy in erectile dysfunction-science and clinical evidence. Int J Impot Res. 2010;22:211-9. DOI:10.1038/ ijir.2010.4
Статья опубликована в журнале "Вестник урологии" №2 2018, стр. 38-43











Комментарии