Колмацуй И.А., Левицкий Е.Ф.
В структуре урологической заболеваемости хронический простатит (ХП) занимает одно из ведущих мест. По данным российских исследований им страдают 8-35% мужчин в возрасте до 40 лет [1, 2]. Данные мировых эпидемиологических исследований противоречивы и колеблются от 2,5% -16% [3, 4]. Рецидивирующее течение заболевания и часто наблюдаемые при ХП репродуктивные и копулятивные нарушения обуславливают значимое снижение качества жизни пациентов [1, 2, 4]. Абактериальный ХП является самой распространенной (до 90%) и наиболее тяжело поддающейся лечению формой заболевания [5, 6, 7].
В рекомендациях EAU 2012 года по диагностике и лечению синдрома хронической тазовой боли (СХТБ) предложено изменить терминологию «абактериальный хронический простатит» (категории III, по классификации NIH, 1995) на синдром хронической тазовой боли/«простатический болевой синдром» (СХТБ/ПБС) [8]. От термина «простатит» рекомендовано отказаться, если нет доказательств, что данное заболевание вызвано инфекцией или воспалительным процессом. Кроме того утверждается, что на сегодняшний день отсутствуют клинически релевантные диагностические исследования или терапевтические результаты, которые позволяли бы отличить воспалительный ХП/СХТБ (категории IIIA, 1995) от невоспалительного ХП/СХТБ (категория IIIB, 1995). Поэтому, в настоящее время в клинической практике не различают воспалительный и невоспалительный варианты заболевания [8].
Предложенная в данных рекомендациях классификация ХП/СХТБ не отражает клиническое течение заболевания. Воспалительные и невоспалительные варианты ХП/СХТБ могут быть стадиями одного и того же патологического процесса и динамически меняться во времени и при проводимой терапии. Российские урологи предлагают оценивать клиническое течение ХП по активности воспалительного процесса как фазы активного, латентного воспаления и ремиссии [1, 2]. Однако оценка степени активности воспалительного процесса при ХП затруднена, что обусловлено отсутствием достоверных диагностических критериев. Проведенные исследования выявили, что применяемые диагностические тесты при ХП характеризуются низким методологическим уровнем [9]. Доказано, что уровень лейкоцитов в секрете предстательной железы (ПЖ) не коррелирует ни с частотой, ни с выраженностью симптомов, ни с показателем качества жизни пациентов и эффективностью лечения [10, 11, 12].
Оценка эффективности лечения у больных ХП, представляет актуальную проблему в связи с отсутствием интегрального показателя, объективно отражающего состояние и динамику клинических, лабораторных и функциональных показателей [13, 14].
Рекомендуемое в стандартах при ХП медикаментозное лечение (α-адреноблокаторы, антибиотики, НПВС и т.д.) недостаточно эффективно и зачастую обладает большим количеством побочных эффектов. Остается не решенным вопрос и о показаниях к назначению антибиотикотерапии у больных ХП/СХТБ, т.к. повышение концентрации лейкоцитов в простатическом секрете (ПС) не является однозначным критерием обострения и показанием к назначению антибактериальных препаратов.
В последнее время большинство исследователей признают наибольшую эффективность комплексных методов лечения ХП с применением различных методов физиотерапии [1, 15, 16]. Однако большинство методов физиотерапии противопоказано для лечения ХП в стадии обострения [15, 17]. Разработка критериев дифференцированного подхода в физиотерапии больных ХП в зависимости от активности воспалительного процесса является актуальной проблемой.
Целью исследования явилась разработка методов дифференцированного физиолечения у больных ХП/СХТБ в зависимости от активности воспалительного процесса с применением сочетанных физиотерапевтических факторов с оптимизированными параметрами воздействия в комплексе с медикаментозной терапией.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Под наблюдением находилось 135 больных ХП/СХТБ (категории III, по классификации NIH, 1995). В зависимости от активности воспалительного процесса пациенты были распределены на группы: неполной ремиссии или латентного воспаления (контрольная группа) (54 чел.) и в фазе активного воспаления (81 чел.). Методом случайной выборки больные ХП/СХТБ в фазе активного воспаления были распределены на группу сравнения (38 чел.) и основную группу (43 чел.). Данные группы были сопоставимы по основным исходным показателям. Средний возраст пациентов составил 33,2±7,4 лет, средняя продолжительность заболевания – 6,7±2,8 лет.
Критерии включения в исследование: больные ХП/СХТБ, абактериальный характер воспаления (микробное число < 103 КОЕ/мл), возраст до 50 лет, наличие информированного согласия. Критерии исключения: наличие общих противопоказаний к проведению физиолечения, инфекции, передающиеся половым путем (ИППП), доброкачественная гиперплазия предстательной железы (ДГПЖ). Верификация диагноза и оценка эффективности лечения осуществлялась на основании данных опросников (NIH-CPSI, QoL, IPSS), пальцевого ректального исследования (ПРИ) ПЖ, микроскопии простатического секрета (ПС), постмассажной мочи («четырехстаканная проба» по Meares-Stamey или «двухстаканная» по Nickel), трансректального ультразвукового исследования (ТРУЗИ) органов малого таза, урофлоуметрии. Для исключения бактериального простатита проводили исследование постмассажной мочи (3-й порции) бактериологическим методом и молекулярно-биологическую диагностику методом ПЦР. Об активности процессов перекисного окисления липидов (ПОЛ) и антиоксидантной защиты (АОЗ) судили по содержанию малонового диальдегида (МДА), церулоплазмина и активности каталазы в сыворотке крови. Степень напряженности неспецифических адаптационных механизмов определяли по типу реакции адаптации и уровню реактивности по Л.Х. Гаркави и соавт. [18]. Микроциркуляторное звено сосудистого русла ПЖ оценивали методом лазерной допплеровской флоуметрии (ЛДФМ).
Интегральную оценку клинического состояния и ее динамику в процессе лечения проводили на основании унифицированной системы, в основу которой положен принцип стандартизации значений качественных и количественных показателей по шкале Харрингтона и интегрально-модульной оценки состояния здоровья в модификации В.Ф. Казакова, В.Г. Серебрякова [19]. Оценку эффективности лечения определяли по интегральному показателю составляющему «улучшение» (20,1-30%) и «значительное улучшение» (более 30%). Оценку результатов лечения проводили непосредственно по окончании курса лечения и через 3-4 недели после его завершения, что было обусловлено «эффектом последействия» физиолечения и более объективно отражало эффективность проведенной терапии.
МЕТОДЫ ЛЕЧЕНИЯ
Больным ХП/СХТБ в фазе ремиссии и латентного воспаления, составившим контрольную группу, проводили комплексное физиолечение: светодиодную терапию (инфракрасного и красного диапазонов) ректально на проекцию предстательной железы с последующим сапропелевым тампоном (Т 40-42°С) и электростимуляцией синусоидальными модулированными токами (СМТ). СМТ терапию пациентам контрольной группы проводили по перинеально-сакральной методике, род работы 3 и 2 (последовательно по 5 процедур каждым), частота модуляции 30 (50) Гц, глубина модуляции 75 (100)%, длительность полупериодов 2:3 с.
Больным ХП/СХТБ в активной фазе воспаления составившим основную группу и группу сравнения проводилась медикаментозная терапия: антибиотики группы фторхинолонов, нестероидные противовоспалительные средства (при выраженном болевом синдроме коротким курсом, не более 5 дней) и α-адреноблокаторы. Пациентам основной группы с первого дня медикаментозной терапии дополнительно проводили комплексное физиолечение: светодиодную терапию (инфракрасного и синего диапазонов) ректально на проекцию ПЖ в сочетании с магнитотерапией постоянным магнитным полем (ПМП) с последующим сапропелевым тампоном (Т 37-38°С) в сочетании с ПМП и электростимуляцией СМТ. СМТ терапию пациентам основной группы проводили 3 и 4 родом работы (по 5 мин каждым), частота модуляции 80 (100) Гц, глубина модуляции 25 (50)%, длительность полупериодов 1:1,5 с. Пациенты, вошедшие в группу сравнения, дополнительно получали физиолечение аналогичное контрольной группе, но только с 7-9 дня медикаментозной терапии (по мере стихания остроты воспалительной реакции).
Воздействие светодиодным излучением осуществлялось от аппарата генерирующим светодиодное излучение инфракрасного (840-950 нм), красного (660 нм) или синего (420-450 нм) диапазонов с суммарной плотностью мощности излучения 5 мВт/см² и ПМП с величиной магнитной индукции 30 мТл.
Для проведения статистической обработки использовали статистический пакет SРSS 15.0 [20]. Проверку на нормальность распределения признаков проводили с использованием критериев Колмогорова-Смирнова и Шапиро-Уилкса. Данные представлены как «среднее±среднее квадратичное отклонение» (М±σ). Если распределение признаков было отличным от нормального, данные представляли в виде «среднее±стандартное отклонение» (М±SD). Если данные были представлены в баллах, применяли Т-критерий Вилкоксона. Если распределение изучаемых выборок отличалось от нормального или данные были представлены в баллах, применяли непараметрический U-критерий Манна-Уитни. Критический уровень значимости при проверке статистических гипотез в исследовании принимался равным 0,05 [21].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для больных ХП/СХТБ в фазе активного воспаления составивших основную группу и группу сравнения было характерно более выраженное по сравнению с пациентами контрольной группы проявление клинической симптоматики, что нашло отражение в повышении индекса симптомов ХП по шкале NIH-CPSI, снижение качества жизни (QoL) (табл. 1). При пальцевом исследовании ПЖ отмечалась более выраженная болезненность и изменение консистенции (неоднородность с участками уплотнения и отечность) по сравнению с пациентами контрольной группы. Количество лейкоцитов в ПС было выше в 2,4 раза, чем у больных в фазе ремиссии и латентного воспаления, отмечалось снижение эффективного объема мочеиспускания, и повышение объема остаточной мочи (табл. 1). Для больных ХП в активной фазе воспаления было характерно более частое нарушение уровня реактивности и адаптационных реакций (по Л.Х. Гаркави), что проявлялось снижением количества пациентов с реакцией спокойной активации и увеличением с реакцией повышенной активации, при низком уровне реактивности (рис. 1). При обострении ХП установлено увеличение в сыворотке крови концентрации внеклеточной каталазы (40,3±4,2 мккатал/л), МДА (3,4±0,2 ммоль/мл) и церулоплазмина (402,0±9,7 ммоль/мл), что указывало на активацию процессов ПОЛ и снижение потенциала АОЗ.
Таблица 1. Сравнительная динамика показателей в исследуемых группах (М±σ)
| Показатель | Контрольная группа n=54 |
Основная группа n=43 |
Основная группа n=38 |
|||
|---|---|---|---|---|---|---|
| д/л | п/л | д/л | п/л | д/л | п/л | |
| NIH-CPSI (S) | 12,7±1,8 | 4,3±1,6** | 18,8±2,5^ | 6,7±2,2** # | 18,5±2,8^ | 12,2±2,4* |
| NIH-CPSI (QoL) | 3,4±0,8 | 2,0±0,5* | 5,2±0,6^ | 2,4±0,4* | 5,1±0,6^ | 3,1±0,4* |
| IPSS (S) | 10,4±2,5 | 4,7±1,4* | 14,2±2,3 | 6,3±1,3** | 14,4±2,1 | 8,1±1,4* |
| МИЭФ-5 (S) | 18,5±2,0 | 21,5±1,2* | 17,3±2,1 | 20,8±1,0* | 17,5±2,2 | 19,3±1,1 |
| ПРИ, болезненность (балл) |
2,7±0,2 | 1,4±0,3** | 3,8±0,1^ | 1,8±0,2** # | 3,7±0,2^ | 2,5±0,3* |
| ПРИ, консистенция (балл) |
2,8±0,1 | 1,5±0,3** | 3,7±0,2^ | 1,8±0,2** # | 3,6±0,3^ | 2,4±0,3* |
| Лейкоциты ПС (кол-во в пз) |
19,2±7,4 | 5,4±2,6** | 3,7±0,2^ | 9,7±3,4** # | 43,6±12,3^ | 17,9±3,7** |
| Qmax (мл/с) | 18,3±2,4 | 24,7±1,9* | 14,2±3,1 | 19,7±1,8* | 14,5±3,2 | 16,4±2,1 |
| V (мл) | 309,3±23,5 | 354,3±19,2* | 247,4±19,7^ | 314,2±18,7* | 252,3±19,1^ | 273,8±18,5 |
Примечание: * – критерий значимости различий внутри групп при р<0,05; ** – при р<0,01; # – критерий
значимости различий с группой сравнения, при р<0,01; ^ – критерий значимости различий с контрольной
группой, при р<0,01
ПС – простатический секрет, V – объем мочеиспускания, пз – в поле зрения, ПРИ – пальцевое ректальное
исследование
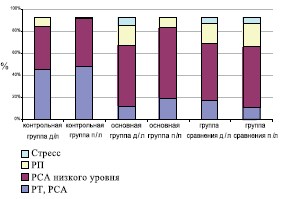
Рис. 1. Сравнительная динамика уровня реактивности и адаптационных реакций по Гаркави
Примечание: РП – реакция переактивации, РСА – реакция спокойной активации, РТ – реакция тренировки
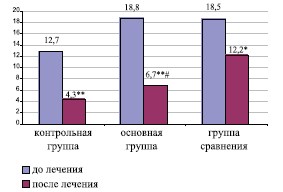
Рис.2. Сравнительная динамика индекса симптомов ХП по шкале NIH-CPSI
Примечание: * критерий значимости различий
внутри групп, при р<0,05; ** при р<0,01; # критерий значимости различий с группой сравнения, при р<0,01
При проведении ЛДФМ ПЖ у больных ХП в активной фазе воспаления выявлялось преобладание пациентов (51 чел., 62,9%, р < 0,05) с исходным значением показателя микроциркуляции (М) ниже нормы в сочетании с уменьшением значений среднеквадратичного отклонения амплитуды (СКО), коэффициента вариации (Kv), колебаний амплитуд (Amax М) в эндотелиальном, нейрогенном и миогенном диапазонах и резерва капиллярного кровотока.
В результате проведенного лечения у большинства больных ХП/СХТБ в фазе обострения купировались болевой и дизурический симптомы. Однако у пациентов основной группы положительная динамика была более выражена, что нашло отражение в значимом снижении суммарного балла по шкале NIH-CPSI с 18,8±2,5 до 6,7±2,2 (р< 0,01) (рис. 2). У пациентов основной группы в процессе лечения отмечалось более значимое снижение суммарного балла по шкале IPSS, индекса оценки качества жизни QoL и улучшение копулятивной функции, что проявлялась повышением суммарного балла опросника МИЭФ-5 (табл. 1).
При пальцевом ректальном исследовании ПЖ у пациентов основной группы в результате лечения выявлено более значимое уменьшение болезненности и улучшение консистенции ПЖ (табл. 1). Исследование ПС спустя 3-4 недели после проведенного лечения более объективно отражало динамику его эффективности. Так, количество лейкоцитов в секрете ПЖ в основной группе непосредственно сразу после курса лечения было повышенным в 34,9% случаев, что было обусловлено улучшением дренажной функции ацинусов, так как сопровождалось улучшением пальпаторных параметров ПЖ (болезненности и консистенции). Нормализация содержания лейкоцитов (менее 10 в пз.) происходила спустя месяц после проведенного лечения у 93,0% больных основной группы и составила 9,7±3,4 в пз. (р< 0,01). У исследуемых в группе сравнения не происходило нормализации содержания лейкоцитов в простатическом секрете (рис. 3).
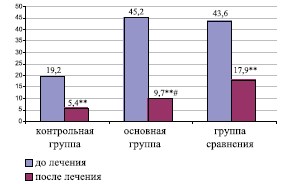
Рис. 3. Сравнительная динамика содержания лейкоцитов в простатическом секрете Примечание: ** критерий значимости различий внутри групп, при р< 0,01; # критерий значимости различий с группой сравнения, при р< 0,01; (пз) – в поле зрения
Количество лейкоцитов в секрете предстательной железы необходимо рассматривать только во взаимосвязи с субъективными и объективными показателями – нормальное содержание лейкоцитов при обострении воспалительного процесса может быть обусловлено нарушением оттока из ацинусов ПЖ. Кроме того, неравномерность воспалительного процесса в ПЖ приводит к нарушению оттока секрета из участков с более активным воспалением, что снижает его диагностическую значимость. Увеличение количества лейкоцитов ПС в процессе лечения при положительной динамике жалоб и параметров пальцевого исследования ПЖ не являлось признаком обострения, а свидетельствовало об улучшении дренажной функции ПЖ.
В процессе лечения нормализация адаптационной реактивности происходила относительно чаще у пациентов основной группы, что свидетельствовало о лучшей переносимости лечения (рис. 1).
По данным урофлоуметрии отмечалось увеличение максимальной скорости мочеиспускания (Qmax) и эффективной емкости мочевого пузыря только у пациентов основной группы (табл. 1). При ультразвуковом исследовании ПЖ отмечено некоторое уменьшение ее размеров за счет снижения отечности; улучшение эхоструктуры ПЖ было более выражено в основной группе больных.
В процессе лечения нормализация показателей микроциркуляции ПЖ по данным ЛДФМ в основной группе и группе сравнения отмечалась в 86,0% и 36,8% случаев, соответственно (р< 0,05). Так, в основной группе пациентов с исходным значением показателя микроциркуляции (М) ниже нормы (27 чел., 62,8%) в процессе лечения выявлено увеличение данного показателя на 34% (р< 0,01), т. е. до нормальных значений, среднеквадратичного отклонения амплитуды колебания кровотока от среднего арифметического значения М (σ или СКО) на 47% (р< 0,001), максимальных амплитуд колебаний в эндотелиальном диапазоне на 41% (р< 0,05), нейрогенном на 38% (р< 0,05) и миогенном на 34% (р< 0,05). Данные изменения являются следствием улучшения микроциркуляции ПЖ и свидетельствуют о нормализации функционирования регуляторных механизмов. У пациентов основной группы (16 чел., 37,2%) с исходно нормальным и выше нормативных значений М в процессе лечения происходило его снижение на 19% (р< 0,05). Уменьшение показателя микроциркуляции в сочетании с тенденцией к снижению максимальной амплитуды колебаний в дыхательном диапазоне (в среднем на 15%) свидетельствовало о снижении венозного застоя в исследуемой области и преобладании активных механизмов регуляции сосудистого тонуса. В группе сравнения не выявлено достоверного улучшения микроциркуляции ПЖ в процессе лечения.
У 14 (36,8%) пациентов группы сравнения в процессе проводимого лечения отмечалось обострение воспалительного процесса, что проявлялось усилением болей и дизурии, повышением концентрации лейкоцитов в простатическом секрете и болезненности при ПРИ и требовало отмены на 2-3 дня физиолечения. В основной группе подобная патологическая реакция на проводимое физиолечение не наблюдалась (р<0,01).
Предложенный интегральный показатель позволяет наиболее объективно оценить состояние и динамику клинических, лабораторных и функциональных показателей у больных ХП/СХТБ. Интегральный показатель эффективности лечения («улучшение» и «значительное улучшение») у больных основной группы и группы сравнения составил 93,0% и 73,7%, соответственно (р<0,01).
При анализе отдаленных результатов в течение года после проведенного лечения рецидивы обострения ХП наблюдались у 8 (18,6%) больных основной группы и у 18 (47,4%) больных группы сравнения (в 2,5 раза чаще, р< 0,01).
Таким образом, оптимизация физиолечения у больных ХП/СХТБ в активной фазе воспаления происходила путем применения низкоэнергетических (нетепловых) дозировок физиотерапевтических факторов, исключение методов местного физиовоздействия стимулирующих гиперемию и отек, применение субфоновых параметров воздействия не вызывающих патологических физиореакций и срыва адаптационных процессов, использование сочетанных методов физиолечения, что позволяло снизить интенсивность воздействия. Применение низкоэнергетических факторов воздействия, благодаря отсутствию теплового эффекта имеет определенные преимущества у категории больных, физиолечение которым было ограничено, либо противопоказано в связи с обострением воспалительного процесса. Низкие уровни энергетической плотности (0,01-1,0 Дж/см²) оказывают нормализующее регуляторное (адаптационное) действие в пределах физиологических возможностей организма и являются оптимальными для оптического свойства тканей. Терапевтический эффект низкоэнергетической светодиодной терапии обуславливает противовоспалительное, трофическое и улучшающее микроциркуляцию воздействие. В зависимости от длины волны, светотерапия обладает специфичностью действия [15, 22]. Красный спектр излучения проявляет стимулирующее влияние и противопоказан при острых воспалительных заболеваниях. Синий свет подавляет альтеративную и экссудативную фазы воспаления, стимулирует фагоцитоз, улучшает кровообращение и реологические свойства крови, оказывает бактерицидное действие, поэтому может быть использован в период обострения [22]. Магнитотерапия выражено уменьшает отек тканей, благодаря чему может применяться в период обострения. Магнитное поле заметно уменьшает поглощение биотканью электромагнитных колебаний, увеличивая глубину проникновения света и уменьшая коэффициент отражения, тем самым потенцируя эффекты воздействия [15, 23]. Пелоидотерапия является одним из наиболее значимых лечебных факторов, оказывающим выраженный противовоспалительный эффект [15]. При воздействии ПМП происходит изменение физико-химических параметров сапропеля, активация его биологических свойств, что проявляется повышением ферментативной активности. Терапевтическая эффективность лечебной грязи при сочетании с ПМП существенно повышается, что делает возможным ее применение при температуре 37-38°С (исключая тепловой фактор воздействия) [24]. СМТ терапия обеспечивает выраженный обезболивающий эффект, улучшает микроциркуляцию, ликвидирует венозный застой [15, 17].
ЗАКЛЮЧЕНИЕ
Разработанный метод комплексного лечения больных ХП/СХТБ в зависимости от клинического течения заболевания (активного, латентного воспаления и ремиссии) включает дифференцированное назначение сочетанных физиотерапевтических факторов: низкоэнергетической светотомагнитотерапии, магнитопелоидотерапии, электростимуляции с оптимизимированными параметрами воздействия и медикаментозное лечение. Применение в лечении у больных ХП/СХТБ в фазе обострения оптимизированных методов физиотерапевтического воздействия в комплексе с медикаментозным лечением позволило расширить показания к его назначению, повысило эффективность, сократило сроки лечения, обеспечило хороший профиль переносимости терапии и увеличило период ремиссии.
ЛИТЕРАТУРА
1. Лоран О.Б., Сегал А.С. Хронический простатит / // Материалы Х Российского съезда урологов. М., 2002. С. 209-223.
2. Ткачук В.Н. Хронический простатит. М.: Медицина для всех, 2006. 112с.
3. Yang M, Zhao X. Advances in the treatment of chronic prostatitis/chronic pelvic pain syndrome. // Zhonghua Nan Ke Xue. 2008. Vol. 14, N 12. P. 1130– 1134.
4. Nickel J, Patel M, Cameron M. Chronic prostatitis/chronic pelvic pain syndrome: finding a way forward. // Rev Urol. 2008. Vol. 10, N 2. P. 160–163.
5. Roberts R, Lieber M, Rhodes T, Girman CJ, Bostwick DG, Jacobsen SJ. et al. Prevalence of a physician-assigned diagnosis of prostatitis: the Olmsted County Study of Urinary Symptoms and Health Status Among Men // Urol. 1998. Vol. 51, N 4. P. 578–584.
6. Nickel J, Shoskes D. Links Phenotypic approach to the management of chronic prostatitis/chronic pelvic pain syndrome // Curr Urol Rep. 2009. Vol. 10, N 4. P. 307–312.
7. Wenninger K, Heiman JR, Rothman I, Berghuis JP, Berger RE. Sickness impact of chronic nonbacterial prostatitis and its correlates.. // J Urol. 1996. Vol. 155, N 3. P. 965-968.
8. Guideline on Chronic Pelvic Pain Syndrome. EAU, 2012. 132 р.
9. Логвинов Л.А. Клинико-морфологические характеристики хронического простатита: Дисс. … канд. мед. наук. М., 2007. 115 с.
10. Schaeffer AJ, Knauss JS, Landis JR, Propert KJ, Alexander RB, Litwin MS, Nickel JC, O'Leary MP, Nadler RB, Pontari MA, Shoskes DA, Zeitlin SI, Fowler JE Jr, Mazurick CA, Kusek JW, Nyberg LM. Leukocyte and bacterial counts do not correlate with severity of symptoms in men with chronic prostatitis: the National Institutes of Health Chronic Prostatitis Cohort Study // J Urol. 2002. Vol. 168, N 3. P. 1048–1053.
11. Аляев Ю.Г., Пшихачев А.М., Варшавский В.А., Стойлов С.В., Винаров А.З. Клинико-морфологические аспекты хронического простатита. // Врач. 2010. N 6. С.17-19.
12. Ощепков В.Н. Дарий Е.В., Сивков А.В. Стандартизированная оценка симптомов хронического простатита. // Сб. научных трудов НИИ уро-логии. Т. XI «Вопросы андрологии в урологии». М., 2000. С. 100-109
13. Лямин Б.А., Ощепков В.Н., Сивков А.В., Аполихин О.И., Дарий Е.В. Стандартизированная оценка результатов лечения хронического простатита. // Материалы Х съезда урологов России. М., 1-3 окт. 2002. М., 2002. С. 298-299.
14. Аполихин О.И., Абдуллин И.И., Сивков А.В., Ощепков В.Н., Егоров А.А. Хронический простатит. // Материалы пленума правления Российского общества урологов. Саратов, 8-10 июня 2002. М., 2004. С. 5-12.
15. Карпухин И.В. , Миненков А.А., Ли С.М. Физиотерапия в андрологии. М.: Галлея-Принт, 1999. 343с.
16. Ушаков А.А. Бронников И.Ю Анализ эффективности применения некоторых физических методов в комплексном лечении хронического простатита и доброкачественной гиперплазии предстательной железы. // Лечащий врач. 1999. N 6. С.50-53.
17. Частная физиотерапия: Учебное пособие [Под ред. Г. Н. Пономаренко]. М.: Медицина, 2005. 744с.
18. Гаркави Л.Х. Квакина Е.Б., Кузьменко Т.С. Антистрессорные реакции и активационная терапия. М.: ИМЕДИС, 1998. 656 с.
19. Казаков В.Ф., Серебряков В.Г. Бальнеотерапия ишемической болезни сердца. М.: Медицина, 2004. 256 с.
20. Наследов А.Д. SPSS 19. Профессиональный статистический анализ данных. Питер, 2008. 412 с.
21. Гланц С. Медико-биологическая статистика. McGraw-Hill, 1994; М.: Практика, 1999. 459 с.
22. Фототерапия. Руководство для врачей. [Под ред. Н. Р. Палеева]. М., Медицина, 2001. 390 с.
23. Улащик В.С., Лукомский И.В. Общая физиотерапия: Учебник. Минск: Интерпрессервис; Книжный Дом, 2003. 510 с.
24. Левицкий Е.Ф., Кузьменко Д.И., Лаптев Б.И. Комплексное применение природных лечебных факторов и поля постоянных магнитов в эксперименте и клинике. Томск: Изд-во Том. ун-та, 2001. 150 с.











Комментарии