Гаджиев Г.Д., Григорьев В.Е., Мазуренко Д.А., Малхасян В.А., Обидняк В.М., Писарев А.В., Тагиров Н.С., Попов С.В., Петров С.Б.
Со времени первой чрескожной операции на почке, выполненной E. Rupel, и R. Brown в 1941 году [1], данный вид хирургии претерпел значительные изменения, и на сегодняшний день является предпочтительным («золотым стандартом») в лечении крупных и коралловидных камней почек.
Для успешного выполнения перкутанной нефролитотомии (ПНЛ) необходимо тщательное предоперационное обследование с оценкой общего состояния здоровья пациента, наличия сопутствующих заболеваний, а также выбора оптимального метода визуализационного исследования.
В настоящее время методом выбора визуализации конкрементов при мочекаменной болезни является компьютерная томография (КТ) с контрастным усилением или без него [2]. КТ с контрастированием, несмотря на высокую лучевую нагрузку, позволяет не только измерить плотность камня, расстояние от кожных покровов до камня, но и оценить полостную систему почки [3]. С этой целью могут выполняться различные варианты реконструкции изображений, которые затем можно использовать во время операции [4]. Однако периодическое сопоставление интраоперационных данных с данными КТ, которыми при условии отсутствия в операционной системы передачи и архивации изображений (PACS – PictureArchiving andCommunication System) будут отпечатанные пленки, не дает полного представления о полостной системе почки.
По данным литературы стереолитографическое биомоделирование с использованием лазера или 3D печати чашечно-лоханочной системы имело достаточно высокую эффективность [5, 6]. Однако, несмотря на полученные результаты, вышеуказанные методики не получили широкого распространения в виду дороговизны и затрат времени на производство моделей.
Изготавливаемая хирургом биомодель, путем лепки из пластилина на основании трехмерной реконструкции КТ-изображений чашечнолоханочной системы почки, имеет ряд преимуществ: минимальные финансовые затраты, быстрота и легкость выполнения. Но самое главное заключается в том, что данный способ позволяет хирургу на предоперационном этапе подробно изучить анатомию полостной системы почки конкретного больного.
Целью данного исследования явилась оценка эффективности использования структурной пластилиновой биомодели при проведении перкутанной нефролитотомии у пациентов со сложными формами камней почек.
МАТЕРИАЛЫ И МЕТОДЫ
С 2012 по 2015 гг. проанализированы результаты лечения 76 пациентов со сложными формами камней почек (полные коралловидные камни или неполные коралловидные камни с множественными чашечковыми камнями согласно классификации AUA) [7]. Из исследования были исключены пациенты с нарушениями свертываемости крови и наличием признаков активного воспалительного процесса в мочевых путях.
Характеристика пациентов представлена в таблице 1.
Таблица 1. Характеристика пациентов
| Показатели | Значение |
|---|---|
| Средний возраст, годы | 61 (±4) |
| Пол: Муж. (чел., %) Жен. (чел., %) |
45 (59%) 31 (41%) |
| Тип камня (чел., %): полный коралловидный камень неполный коралловидный камень (с множественными камнями чашечек) |
28 (37%) 48 (63%) |
| Наличие открытых вмешательств на почке в анамнезе (чел., %) | 23 (30%) |
| Сторона расположения конкремента: левая правая билатеральные |
37 (48.6%) 23 (30,4%) 16 (21%) |
| ASA класс (классификация физического состояния больных перед операцией согласно американского общества анестезиологов: I II III |
33 (43,4%) 24 (31,6%) 19 (25%) |
На предоперационном этапе всем пациентам выполнялись: клинический и биохимический анализы крови, коагулограмма, общий анализ мочи, посев мочи. Пациенты имели либо стерильный посев мочи, либо, при невозможности эрадикации возбудителя, получали антибактериальный препарат по спектру чувствительности в течение 7 дней перед операцией [8].
КТ выполнялась на 64-срезовом томографе Somatom Definition AS (Germany) в положении больного на спине.
Типы камней были разделены на коралловидные камни с или без множественных чашечковых камней. Полные коралловидные камни были определены как камни, занимающие 80% и более полостной системы. Неполные коралловидные камни определялись как камни, занимающие почечную лоханку, и, как минимум, 2 чашечки [9].
Перед операцией хирургом на основании трехмерных КТ реконструкций изготавливалась пластилиновая биомодель полостной системы ипсилатеральной почки (рис. 1). Среднее время, необходимое для создания модели, составляло 18 (±5) минут. Цена бытового пластилина, необходимого для изготовления модели, не превышала 150 рублей. Пошаговый процесс создания модели отображен на рисунке 2. Готовая модель использовалась, как референсный инструмент в стерильном полиэтиленовом пакете во время операции (рис. 3).
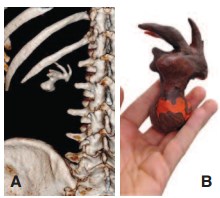
Рис. 1. Предоперационное 3D КТ-реконструкция (А) и пластилиновая биомодель (B) полного коралловидного камня
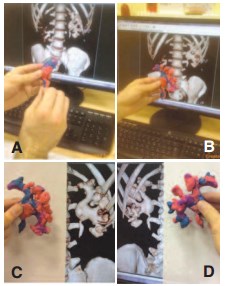
Рис. 2. Пошаговое отображение моделирования А. Создание лоханки. B. Создание задних чашечек С. Создание передних чашечек D. Оценка конечной модели
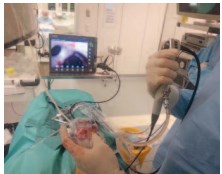
Рис. 3. Интраоперационная навигация
Все пациенты были прооперированы одной хирургической бригадой (Н.К. Гаджиев, С.С. Бровкин). Операции выполнялись под общим (эндотрахеальным) обезболиванием. На начальном этапе оперативного лечения в литотомическом положении в ипсилатеральную почку устанавливался мочеточниковый катетер под контролем цистоскопа. Затем пациент переворачивался в положение «на животе», либо в положение «на спине» при условии наличияморбидного ожирения (индекс массы тела>35), заболеваний сердечно-сосудистой и дыхательной систем (на усмотрение оперирующего хирурга и анестезиолога).
Чрезкожный доступ осуществлялся под рентгени ультразвуковым контролем. После пункции чашечки 0,035″ гидрофильная струна проводилась в полостную систему почки. Для предотвращения случайного выпадения струны из полостной системы почки максимально старались завести струну в мочеточник. Следующим этапом выполнялось бужирование фасциальным бужом 11 Ch, после чего на проводник надевался ангиокатетер 8 Ch, на котором выполнялось бужирование с установкой кожуха Амплатц 30 Ch.
Нефроскопия выполнялась ригидным нефроскопом 28 Ch (Karl Storz, Germany). Фрагментация камня осуществлялась ультразвуковым и, по необходимости, пневматическим литотриптором (Swiss LithoClast Master, Switzerland). Для экстракции камней использовались двузубые щипцы (Karl Storz, Germany) и/или Perc NCircle нитиноловый экстрактор камней (Cook Medical, Bloomington, IN).
При необходимости выполнялись дополнительные доступы. Длительность нефроскопии была ограничена 2 часами. Состояние «Stone Free» оценивалось в конце операции путем использования рентген-, ультразвукового контроля и финальной нефроскопии гибким видео-цистоскопом (Karl Storz, Germany).
В конце операции в большинстве случаев устанавливалась нефростома 9 Ch. Если во время операции интенсивность кровотечения была высокой, рассматривался вариант установки нефростомы более широкого калибра. В конце операции для снижения послеоперационной боли проводилось перитубарное обезболивание раствором Ропивокаина 0,25% [10]. В 1-е сутки после операции выполнялся клинический анализ крови, определение уровня креатинина, электролитов сыворотки крови. Производилось удаление уретрального катетера и активизация пациента.
Всем пациентам через 24 часа после операции выполнялась КТ по низкодозовому протоколу. Эффективность удаления конкрементов почки у пациентов с неинфекционным уролитиазом определялась, как полное отсутствие камней или наличие клинически незначимых фрагментов, менее 4 мм в диаметре [11].
При наличии резидуальных фрагментов более 4 мм выполнялась повторная нефролитотомия/нефроскопия через 2-3 дня при условии отсутствия у пациента гипертермии.
При отсутствии резидуальных фрагментов нефростомический дренаж удалялся через 24-48 часов после операции с предварительным контролем проходимости мочевых путей путем пережатия нефростомы либо антеградной пиелоуретерографии. Длительность операции определялась с момента пункции почки до установки нефростомы.
В исследовании оценивалось следующее: полнота освобождения почки от камня (с клинически незначимыми фрагментами более 4 мм), наличие и характер осложнений (модифицированная шкала Clavien) [12].
РЕЗУЛЬТАТЫ
Во всех случаях чрескожный доступ был осуществлен успешно. 56 (73,6 %) пациентов были оперированы в положении на животе и 20 (19,4%) пациентов – на спине. У 41 (54%) пациента был выполнен один доступ, у 22 (28,9%) – два доступа, 6 (7,8%) пациентов – три доступа, 5 (6,5%) пациентам потребовалось 4 доступа и только у 2 (2,8%) больных произведено 5 доступов. Средняя продолжительность оперативного лечения составила 86±21 минут. Повторная нефроскопия потребовалась 35 (46%) из 76 пациентов. Все повторные операции выполнялись в срок от 2 до 3 дней при отсутствии гипертермии у пациента. 12 (42,8%) из 28 пациентов с полными коралловидными камнями нуждались в повторной перкутанной нефролитотомии (нефроскопии). Полное освобождение почки от конкремента, подтвержденное компьютерной томографией, проведенной по низкодозовому протоколу через 24 часа после операции, составило 84,4% у пациентов, перенесших один сеанс ПНЛ и 92% – после повторной ПНЛ, в среднем – 88,2% (табл. 2).
Таблица 2. Характеристики ПНЛ
| Показатели | Значение |
|---|---|
| Средняя длительность операции, мин | 86 (±21) |
| Положение больного: На животе, чел (%). На спине, чел. (%) |
56 (73,6%) 20 (19,4%) |
| Повторные ПНЛ, чел.(%): с полным коралловидным камнем с неполным коралловидным камнем |
35 (46 %) 12 из 28 (42.8%) 23 из 48 (47,9%) |
| Количество чрескожных доступов, чел. (%): 1 2 3 4 5 |
41 (54%) 22 (28,9 %) 6 (7,8%) 5 (6,5%) 2 (2,8%) |
| «Stone free» за одноэтапный ПНЛ «Stone free» за более чем одноэтапный ПНЛ Общий «Stone free» |
84.4% 92% 88.2% |
К осложнениям первого уровня относились: транзиторная послеоперационная лихорадка, чаще всего резорбтивного характера – наблюдалась у 14 (18,4%) пациентов. У 5 (6,5%) пациентов был отмечен транзиторный подъем креатинина. К осложнениям второго уровня относились кровотечения, требующие гемотрансфузии, наблюдались у двух (2,6%) пациентов и не требовали дополнительных методов остановки кровотечения (таких, как суперселективная эмболизация и др.). Необходимо отметить, что кровотечения встречались у пациентов с полными коралловидными камня и были сопряжены с длительностью операции. Послеоперационная гипертермия (более 38° С) развилась у 9 (11,8%) пациентов и была успешно устранена дополнительным назначением антибиотиков. Осложнения 3-его уровня отмечены у 4 (5,26%) пациентов, которым потребовалась установка стента по поводу обструкции мочеточника сгустком крови после удаления нефростомы, а также у одного (1,3%) пациента возникла необходимость установки дренажа в плевральную полость, при этом доступ у данного пациента выполнялся через 10-е межреберье (табл. 3).
Таблица 3. Характер осложнений после ПНЛ по шкале Clavien
| Показатели | Значение |
|---|---|
| Общее количество осложнений, чел. (%): | 35 (46%) |
| Уровень 1 Транзиторная послеоперационная лихорадка Транзиторный подъем креатинина |
19 (25%) 14 (18,4%) 5 (6,5 %) |
| Уровень 2 Кровотечение Послеоперационная лихорадка >380С |
11 (14,4% ) 2 (2,6%) 9 (11,8%) |
| Уровень 3 Пневмоторакс Необходимость установки стента |
5 (6,5%) |
ОБСУЖДЕНИЕ
Согласно Российскими Европейским клиническим рекомендациям ПНЛявляется первой линией лечения пациентов с камнями почек более 2 см [13,14]. Успешность ПНЛ в основном зависит от предоперационного планирования, точного знания анатомии полостной системы почки и скрупулезного соблюдения техники операции [6]. Также на эффективность лечения влияютметодывизуализационных исследований, используемых урологами, к которымобычно относят экскреторную урографию и КТ. Последний метод выгодно отличается качеством получаемого изображения и потому, невзирая на лучевую нагрузку, повсеместно замещает экскреторную урографию [12, 13, 15-17]. При этом необходимо отметить, что знание и понимание месторасположения конкрементов в полостной системе почки играет решающую роль в исходе операции. Информацию об этом можно получить при помощи трехмерной реконструкции КТ с усилением [4]. Именно поэтому данный метод является предпочтительным визуализационным исследованием у пациентов с крупными коралловидными/множественными камнями почек. Ввиду индивидуальных особенностей ЧЛС каждого пациента во время выполнения ПНЛ, хирургу зачастую требуется сверяться с даннымиКТ, что приводит к увеличению длительности операции.
По данным CROES (Clinical Research Office of the Endourological Society) эффективность ПНЛ составила всего 76% случаев [18]. Этот невысокий показатель определяет необходимость поиска новых методик повышения эффективности проводимых операций. Последние сообщения об использовании технологии расширенной реальности с использованием iPad [19], системы «Локатор» [20], системы трекеров [21] и др. отражают потребность эндоурологического сообщества в эффективных решениях.
Другое направления для улучшения результатов – это использование реплик полостной системы: 3D печать полостной системы [6], модель из органического материала с использованием лазерной установки [5]. Эти модели можно использовать как тренажерыперед операцией, либо как референсныемодели во время операции. Несмотря на то, что достижения в технологии позволили легко производить 3D-модели, их изготовление требует специального принтера, специальных программ, которые также приводят к дополнительным затратам. Производство органической биомодели с использованием лазерной установки также финансово обременительно. Более того, такаямодель требует большего количества времени на изготовление, что препятствует ее повсеместному распространению.
Учитывая вышеуказанные факты, мы провели оценку эффективности пластилинового биомоделирования в чрескожной хирургии камней почек. Данная идея не нова, и уже использовалась в других областях медицины, таких как ортопедия и травматология, краниофасцилярная реконструктивная пластическая хирургия и нейрохирургия [21, 22, 24].
Перед нами возник вопрос – возможно ли эффективно использовать биомоделирование, которое должно облегчить ментальную реконструкцию чашечно-лоханочной системы и улучшить ознакомление с полостной системой почки. Наше внимание привлек интересный опыт в областимедицинского обучения: используя модели тазобедренного сустава, участники прикрепляли структуры (мышцы, сухожилия и др.) к костным образованиям. По оценке участников такой интерактивный опыт позволил улучшить трехмерное знание анатомии соответствующей области [25].
Нами был использован тот же принцип для создания пластилиновой биомодели на основе трехмерных КТреконструкций перед каждой операцией. Создание модели занимало в среднем18-20минут.Создаваямодель, хирург получал исчерпывающее представление о полостной системе почки конкретного пациента, при этомпонимание «дорожной карты почки», является ключом к полному удалению конкрементов при финальной нефроскопии. Таким образом, готовая пластилиновая модель в стерильном полиэтиленовом пакете использовалась нами, как референсный инструмент в ходе операции. 3D-реконструкции КТ с соответствующими моделями и послеоперационными КТ продемонстрированы на рисунке 4.

Рис. 4. А. Трехмерная реконструкция B. Пластилиновая модель C. Послеоперационное КТ
Пластилиновое структурное биомоделирование с учетом наших предварительных данных оказалось весьма полезным подспорьем, в особенности при ПНЛ сложных случаев, обеспечивая должный вклад в планирование и интраоперационную тактику. В нашем исследовании пластилиновая биомодель позволила увеличить эффективность ПНЛ до 88%.
К недостаткам нашего исследования можно отнести необходимость применения КТ с усилением, что сопряжено с резким увеличением дозы облучения, а также дизайн исследования, которое представляет собой описание серии клинических случаев.
Пластилиновое биомоделирование конкрементов и ЧЛС почки имеет ряд положительных сторон: изготовление данной модели не требует от врача специального навыка лепки, требует минимальных финансовых и трудовых затрат, хирург получает лучшую осведомленность об индивидуальных особенностях полостной системой каждого пациента, что в свою очередь повышает эффективность оперативного лечения и может способствовать уменьшению риска интраоперационных осложнений.
ЗАКЛЮЧЕНИЕ
Предложенный метод пластилинового биомоделирования обеспечивает лучшую оценку полостной системы почки и может служить референсным инструментом в операционной, улучшая результаты ПНЛ и снижая риск развития осложнений.
ЛИТЕРАТУРА
1. Rupel E, Brown R. Nephroscopy with removal of stone following nephrostomy for obstructive calculous anuria. J Urol 1941;47:177–82.
2. Olcott EW, Sommer FG, Napel S. Accuracy of detection and measurement of renal calculi: in vitro comparison of three-dimensional spiral CT, radiography, and nephrotomography. Radiology 1997;204:19–25.
3. Türk C, Knoll T, Petrik A, Sarica K, Skolarikos A, Straub M, Seitz C. Guidelines on urolithiasis. European Association of Urology (EAU), 2014. P. 62-99. Available from: https://uroweb.org/wp-content/uploads/22-
4. Ghani KR, Pilcher J, Patel U, Anson K. Three-dimensional imaging in urology. BJU Int 2004;94:769–73.
5. Radecka E, Brehmer M, Holmgren K, Palm G, Magnusson P, Magnusson A. Pelvicaliceal biomodeling as an aid to achieving optimal access in percutaneous nephrolithotripsy. J Endourol 2006;20:92–101.
6. Turney BW. A new model with an anatomically accurate human renal collecting system for training in fluoroscopy-guided percutaneous nephrolithotomy access. J Endourol 2014;28:360–363.
7. Preminger GM, Dean Assimos CG, James Lingeman VE, Nakada SY, Pearle MS, Stuart Wolf J, et al. Report on the Management of Staghorn Calculi n.d. J Urol. 2005;173(6):1991-2000.
8. Mariappan P, Smith G, Moussa SA, Tolley DA. One week of ciprofloxacin before percutaneous nephrolithotomy significantly reduces upper tract infection and urosepsis: a prospective controlled study. BJU Int 2006;98:1075–1079.
9. Mishra S, Bhattu AS, Sabnis RB, Desai MR. Staghorn classification: Platform for morphometry assessment. Indian J Urol 2014;30:80–83.
10. Jonnavithula N, Pisapati MVLN, Durga P, Krishnamurthy V, Chilumu R, Reddy B. Efficacy of peritubal local anesthetic infiltration in alleviating postoperative pain in percutaneous nephrolithotomy. J Endourol 2009;23:857–860.
11. Opondo D, Gravas S, Joyce A, Pearle M, Matsuda T, Sun Y-H, et al. Standardization of patient outcomes reporting in percutaneous nephrolithotomy. J Endourol 2014;28:767–774.
12. de la Rosette JJMCH, Opondo D, Daels FPJ, Giusti G, Serrano A, Kandasami S V, et al. Categorisation of complications and validation of the Clavien score for percutaneous nephrolithotomy. Eur Urol 2012;62:246–255.
13. Turk C, Petrik A, Sarica K, Seitz C, Skolarikos A, Straub M, et al. EAU Guidelines on Urolithiasis. Eur Urol 2016;69(3):475–482.
14. Григорьев Н.А., Семенякин И.В., Малхасян В.А., Гаджиев Н.К., Руденко В.И. Мочекаменная болезнь. Урология 2016;(S2):37–69.
15. Miller OF, Rineer SK, Reichard SR, Buckley RG, Donovan MS, Graham IR, et al. Prospective comparison of unenhanced spiral computed tomography and intravenous urogram in the evaluation of acute flank pain. Urology 1998;52:982–987.
16. Memarsadeghi M, Heinz-Peer G, Helbich TH, Schaefer-Prokop C, Kramer G, Scharitzer M, et al. Unenhanced multi-detector row CT in patients suspected of having urinary stone disease: effect of section width on diagnosis. Radiology 2005;235:530–536.
17. Park S, Pearle MS. Imaging for percutaneous renal access and management of renal calculi. Urol Clin North Am 2006;33:353–364.
18. Kamphuis GM, Baard J, Westendarp M, de la Rosette JJ. Lessons learned from the CROES percutaneous nephrolithotomy global study. World J Urol 2015;33(2):223-233 19 Rassweiler JJ, Müller M, Fangerau M, Klein J, Goezen AS, Pereira P, et al. iPad-assisted percutaneous access to the kidney using marker-based navigation: initial clinical experience. Eur Urol 2012;61:628–31.
20. Lazarus J, Williams J. The Locator: novel percutaneous nephrolithotomy apparatus to aid collecting system puncture--a preliminary report. J Endourol 2011;25:747–750.
21. Rodrigues PL, Vilaça JL, Oliveira C, Cicione A, Rassweiler J, Fonseca J, et al. Collecting system percutaneous access using real-time tracking sensors: first pig model in vivo experience. J Urol 2013;190:1932–1977.
22. Yau YY, Arvier JF, Barker TM. Technical note: maxillofacial biomodelling--preliminary result. Br J Radiol 1995;68:519–523.
23. D’Urso PS, Askin G, Earwaker JS, Merry GS, Thompson RG, Barker TM, et al. Spinal biomodeling. Spine (Phila Pa 1976) 1999;24:1247–1251.
24. Byram IR, Khanna K, Gardner TR, Ahmad CS. Characterizing bone tunnel placement in medial ulnar collateral ligament reconstruction using patient-specific 3-dimensional computed tomography modeling. Am J Sports Med 2013;41:894–902.
25. Asp ARM, Myint Y, Gandhe A. Back to school anatomy: just add Plasticine. BMJ 2013;347:f6924–f6924.













Комментарии