Н.И. Сорокин1,2, В.К. Карпов1,2,3,4, Б.М. Шапаров1,4
1Факультет фундаментальной медицины МГУ имени М.В. Ломоносова, кафедра урологии и андрологии, Москва, Россия
2МНОЦ МГУ имени. М.В. Ломоносова, Москва, Россия
3ГБУЗ «ГКБ №31 ДЗМ», Москва, Россия
4ГБУЗ «ГКБ №17 ДЗМ», Москва, Россия
Сорокин Н.И., д.м.н., врач-уролог МНОЦ МГУ имени М.В. Ломоносова, профессор кафедры урологии и андрологии ФФМ МГУ имени М.В. Ломоносова, ведущий научный сотрудник отдела урологии и андрологии МНОЦ МГУ имени М.В. Ломоносова

Карпов В.К., к.м.н., врач-уролог ГКБ №31 ДЗМ, доцент кафедры урологии и андрологии ФФМ МГУ имени М.В. Ломоносова, ведущий научный сотрудник отдела урологии и андрологии МНОЦ МГУ имени М.В. Ломоносова

Шапаров Б.М., врач-уролог ГКБ №17 ДЗМ, сотрудник кафедры урологии и андрологии ФФМ МГУ имени М.В. Ломоносова
Трансуретральные оперативные методы являются стандартом оперативного лечения гиперплазии простаты. Внедрение в практику современных эндоурологических вмешательств в лечении больных доброкачественной гиперплазией предстательной железы (ДГПЖ) привело к значительному снижению количества послеоперационных осложнений, однако стало причиной развития рубцовой деформации шейки мочевого пузыря (РДШМП). Детальное изучение факторов риска РДШМП позволит в дальнейшем минимизировать частоту ее развития после трансуретральных вмешательств, тем самым способствуя улучшению качества жизни пациентов.
Введение
Основные методы лечения пациентов с РДШМП, включающие трансуретральную инцизию или резекцию с использованием лазерной или электроэнергии, в большинстве случаев оказываются неэффективными, и частота рецидивов РДШМП достигает 50–80%. Отсутствие стойкого эффекта от проводимого лечения РДШМП делает эту проблему весьма актуальной и определяет необходимость поиска более эффективных методов, что невозможно без понимания патогенеза и факторов риска развития склеротического процесса в шейке мочевого пузыря.
Рубцовая деформация шейки мочевого пузыря
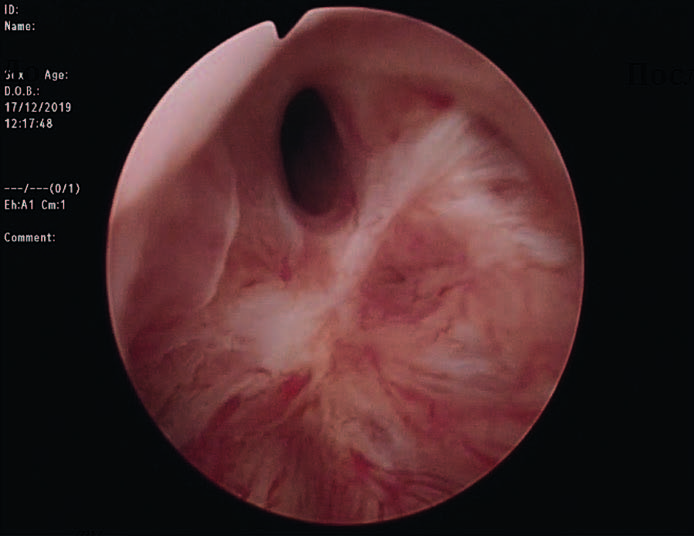
РДШМП представляет собой процесс фиброза в области ложа удалённой гиперплазированой ткани простаты и шейки мочевого пузыря с постепенным сужением просвета простатического отдела уретры (рис. 1). В зависимости от техники операции и используемого вида энергии частота развития РДШМП варьируется от 0 до 9,9% при первичном вмешательстве. По результатам исследования Christian Gilfrich et al. (2020) наибольшая частота повторных вмешательств по поводу рубцовых осложнений после эндоурологических методов лечения пациентов с гиперплазией простаты характерна для фотоселективной вапоризации (PVP) с использованием лазера Green Light, частота развития РДШМП при этом достигает 10%, что существенно превышает аналогичные показатели при других трансуретральных методиках. При этом риски развития РДШМП после HoLEP, ThuLEP и ТУРП остаются сопоставимыми.
Этиология
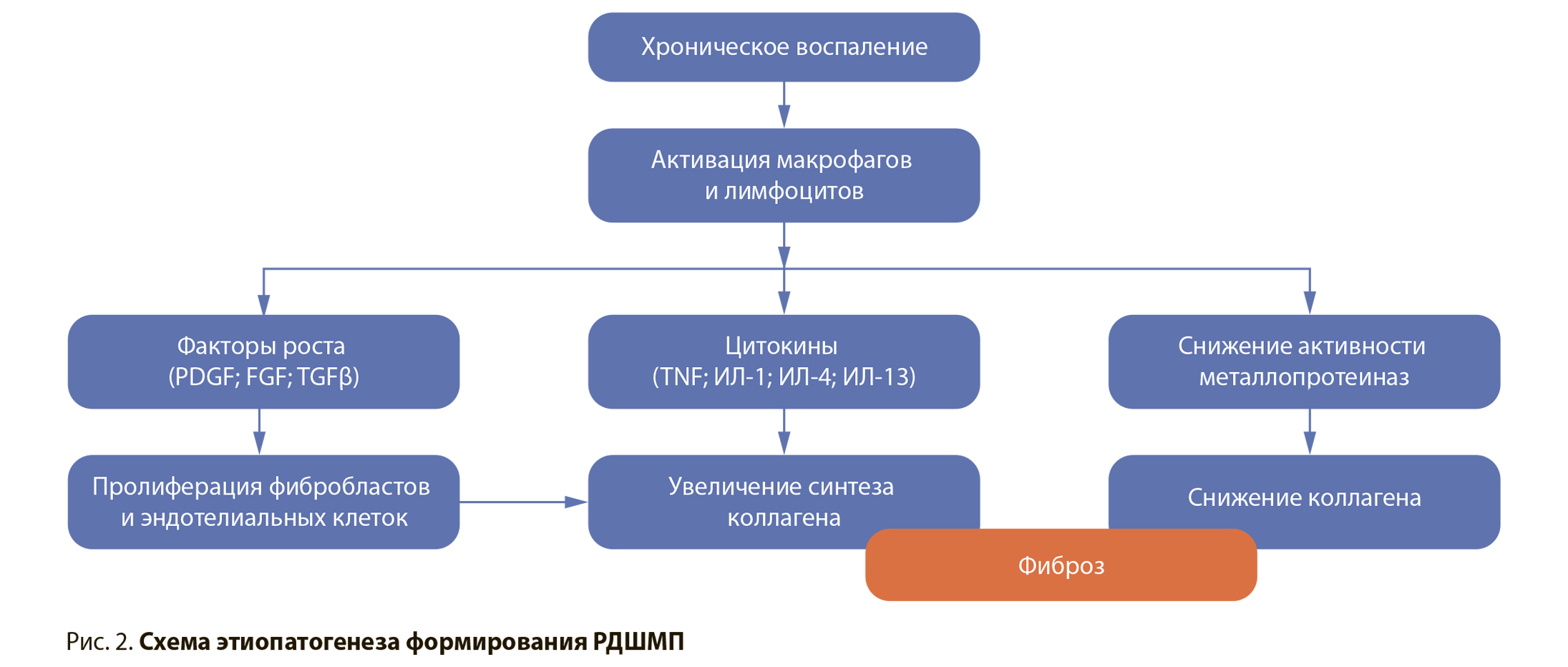
Этиопатогенез и механизмы, приводящие к возникновению РДШМП, до конца не выяснены. На сегодняшний день наиболее приемлемой концепцией считается полиэтиологичность данного патологического состояния. По данным ряда исследований, наличие простатита, а также хронической инфекции мочевыводящих путей служат фактором риска развития РДШМП после трансуретральных вмешательств на предстательной железе. В работе Huang Tao et al. (2016) установлено, что наличие бактерий в бактериологическом анализе мочи в течение 6 нед. после трансуретральной резекции простаты по поводу ее гиперплазии является независимым предиктором развития рубцовых изменений уретры и шейки мочевого пузыря. Рубцовые изменения обнаружены у 32,2% пациентов с хронической инфекцией, в то время как при стерильной моче распространенность стриктур и РДШМП не превышала 6% [2]. Похожие данные получены A. Grechenkov et al. в 2018 г. Наличие хронического простатита в анамнезе признано независимым фактором риска формирования РДШМП. Помимо этого, у пациентов с наличием цистостомического дренажа или уретрального катетера на дооперационном этапе, которые, как известно, являются входными воротами для инфекции, отмечалась предрасположенность к развитию РДШМП. Для 29,5% пациентов с предварительно дренированным мочевым пузырем после устранения инфравезикальной обструкции характерно развитие РДШМП, в то время как для пациентов с самостоятельным мочеиспусканием данный показатель составлял 17,9%. Полученные результаты были подтверждены в исследовании O. G. Doluoglu et al. (2012). Авторы отметили, что 29,8% пациентов с простатитом в анамнезе, прооперированных по поводу ДГПЖ, в дальнейшем потребовалось повторное оперативное вмешательство в связи с развитием рубцовых изменений в области шейки мочевого пузыря. В группе пациентов без сопутствующих воспалительных заболеваний необходимость повторной операции была значительно ниже и составила 8,6% [4]. Похожая тенденция наблюдалась в исследовании Anuj Deep Dangi et al. (2017). У пациентов с простатитом в анамнезе РДШМП в послеоперационном периоде после ТУРП встречалась в 5% случаев, в то время как в отсутствие простатита лишь в 2,8% случаев [5]. На основании полученных данных можно предположить, что процесс заживления ложа удаленных гиперплазированных тканей простаты на фоне уже имеющегося воспаления характеризуется более обширным рубцеванием в связи с гиперактивацией рекрутированных фибробластов. Процесс нормальной регенерации под действием инфицированной мочи при наличии сопутствующего воспаления резко замедляется, происходит образование грубой рубцовой ткани, повышающее таким образом риск развития РДШМП (рис. 2).
Факторы риска
Общепринятым фактором риска развития РДШМП считается больший объем гиперплазии простаты, причем малый объем удаляемой ткани сопряжен с повышенной частотой РДШМП после трансуретральных вмешательств. По данным Huang Tao et al. (2016), пороговым значением, ниже которого повышается риск развития РДШМП после ТУРП, является объем предстательной железы, равный 46,2 см3 [6]. Относительно небольшой объем предстательной железы сопряжен с развитием РДШМП и после гольмиевой лазерной энуклеации гиперплазированной ткани простаты. Похожие результаты получены в исследовании K. S. Kim et al. (2016). Для пациентов с объемом предстательной железы менее 40 см3, перенесших фотоселективную вапоризацию простаты по поводу ДГПЖ с использованием лазера GreenLight, РДШМП являлся распространенным осложнением в послеоперационном периоде, чего не наблюдалось при ДГПЖ большего объема. После проведения детального анализа K. S. Kim et al. (2016) установили, что малый объем предстательной железы служит независимым фактором риска склеротических изменений в шейке мочевого пузыря [7].
Считается, что при небольшом объеме простаты пролиферация эпителиальных клеток как причина ирритативных и обструктивных расстройств уходит на второй план. Ведущее место в патогенезе расстройств мочеиспускания в такой ситуации принадлежит фиброзу и нарушению сократимости гладкомышечных волокон в области шейки мочевого пузыря на дооперационном этапе, которые еще более усугубляются при наличии сопутствующего воспаления в предстательной железе. В такой ситуации шейка мочевого пузыря более восприимчива к травме, что приводит к формированию гипертрофического рубца из-за чрезмерного нагревания и термического повреждения ткани. В связи с этим энуклеация гиперплазированной ткани предстательной железы с точки зрения безопасности является более подходящим методом лечения больных ДГПЖ, так как в отличие от резекции и вапоризации позволяет выполнить данную операцию с меньшим термическим повреждением шейки мочевого пузыря.
Дополнительным фактором риска развития РДШМП является травма шейки мочевого пузыря во время оперативного вмешательства. Это связывают в первую очередь с возможностью затекания мочи в образовавшуюся под эпителиальным пластом полость с последующим воспалением и формированием рубца. По данным Huang Tao et al. (2016), для 14,58% пациентов с повреждением области шейки во время ТУРП в послеоперационном периоде были характерны рубцовые осложнения, в то время как при интактной шейке частота РДШМП была существенно ниже и составляла 6,7% [2]. Было отмечено, что фактором, способствующим повреждению слизистой оболочки при трансуретральных вмешательствах на простате, является использование инструментов бóльшего диаметра, что было подтверждено в исследовании A. Grechenkov et al. (2018) [3]. Для 72% пациентов с используемым во время операции диаметром резектоскопа 27 F в послеоперационном периоде было характерно развитие рубцовых осложнений, в то время как при использовании резектоскопов 24 F и 26 F частота пациентов с РДШМП не превышала 25%.
Функциональная роль сердечно-сосудистых заболеваний и метаболических нарушений в развитии РДШМП после трансуретральных вмешательств остается не до конца понятной. Известно, что наличие данных факторов коморбидности сопряжено с недостаточным кровоснабжением органов, имеющим системный характер. Логично предположить, что возникающая при этом хроническая ишемия мочевого пузыря вызывает активацию профибротических агентов уже на дооперационном этапе, тем самым способствуя формированию рубца после операции [8].
Несмотря на хорошую доказательную базу, описывающую этиопатогенез склеротичеких осложнений в области шейки мочевого пузыря после радикальной простатэктомии, аналогичные данные для РДШМП после трансуретральных вмешательств существенно ограничены. Согласно исследованию A. Grechenkov et al. (2018), наличие сахарного диабета 2 типа (СД2) было характерно для 24,6% пациентов с РДШМП после ТУРП, в то время как пациенты без РДШМП страдали от нарушений углеводного обмена лишь в 9,4% случаев. Распространенность артериальной гипертензии в контрольной и исследуемой группах существенно не различалась [3]. Рецидиву РДШМП после трансуретральной инцизии, по результатам работы Daniel Ramirez et al. (2013), способствовали курение с индексом пачка/лет более 10, а также 2 и более трансуретральных вмешательств по поводу РДШМП [9]. Таким образом, многие исследователи полагают, что возраст, ожирение, курение, СД, сердечно-сосудистые заболевания служат фактором риска РДШМП после эндоурологических вмешательств, однако дальнейшие работы в данном направлении все еще актуальны.
Заключение
Таким образом, на сегодняшний день РДШМП считается многофакторным и полиэтиологичным патологическим состоянием. В качестве основополагающих факторов риска РДШМП после эндоурологических вмешательств признаны наличие простатита и мочевой инфекции на дооперационном этапе и в раннем послеоперационном периоде, малый объем ДГПЖ, травматизация шейки мочевого пузыря, в том числе при использовании инструментов большего диаметра. В качестве дополнительных факторов риска рассматриваются возраст пациентов, сердечно-сосудистые заболевания, СД2, ожирение, длительный анамнез курения. Детальное изучение факторов риска РДШМП позволит в дальнейшем минимизировать частоту развития склеротических осложнений после трансуретральных вмешательств, тем самым улучшив функциональные результаты.
Литература
- Gilfrich C., May M., Fahlenbrach C., Günster C., Jeschke E., Popken G., Stolzenburg J-U., Weissbach L., von Zastrow C., Leicht H. Surgical Reintervention Rates after Invasive Treatment for Lower Urinary Tract Symptoms due to Benign Prostatic Syndrome: A Comparative Study of More than 43,000 Patients with Long-Term Followup. J Urol. 2020;101097JU0000000000001463.
- Tao H., Jiang Y.Y., Jun Q., Ding X., Jian D.L., Jie D., Ping Z.Y. Analysis of risk factors leading to postoperative urethral stricture and bladder neck contracture following transurethral resection of prostate. Int Braz J Urol. 2016;42(2):
302–311.
- Grechenkov A., Sukhanov R., Bezrukov E., Butnaru D., Barbagli G., Vasyutin I., Tivtikyan A., Rapoport L., Alyaev Y., Glybochko P. Risk factors for urethral stricture and/or bladder neck contracture after monopolar transurethral resection of the prostate for benign prostatic hyperplasia. Urologia. 2018;85(4):150–157.
- Doluoglu O.G., Gokkaya C.S., Aktas B.K., Oztekin C.V., Bulut S., Memis A., Cetinkaya M. Impact of asymptomatic prostatitis on re-operations due to urethral stricture or bladder neck contracture developed after TUR-P. Int Urol Nephrol. 2012;44(4):1085–1090.
- Dangi A.D., Nagarajan R., Panda A., Kumar R.M., Devasia A., Kekre N. Does asymptomatic prostatic inflammation alter the outcome of transurethral resection of prostate? Cent Eur J Urol. 2017;70(3):252–258.
- Tao H., Jiang Y.Y., Jun Q., Ding X., Jian D.L., Jie D., Ping Z.Y. Analysis of risk factors leading to postoperative urethral stricture and bladder neck contracture following transurethral resection of prostate. Int Braz J Urol. 2016;42(2):302–311.
- Kim K.S., Choi J.B., Bae W.J., Kim S.J., Cho H.J., Hong S-H., Lee J.Y., Kim S.W., Han D-S. Risk Factors for Reoperation After Photoselective Vaporization of the Prostate Using a 120 W GreenLight High Performance System Laser for the Treatment of Benign Prostatic Hyperplasia. Photomed Laser Surg. 2016;34(3):102–107.
- Abbosov S.A., Sorokin N.I., Shomarufov A.B., Kadrev A.V., Mikheev K.V., Fozilov A.A., Najimitdinov Y.S., Ohobotov D.A., Giyasov S.I., Mukhtarov S.T., Akilov F.A., Kamalov A.A. Assessment of the balloon dilation efficiency in bladder neck contracture after transurethral interventions on the prostate. Urological Science. 2022;33(3):130–135.
- Ramirez D., Zhao L.C., Bagrodia A., Scott J.F., Hudak S.J., Morey A.F. Deep lateral transurethral incisions for recurrent bladder neck contracture: promising 5-year experience using a standardized approach. Urology. 2013;82(6):1430–1435.
Источник: http://rusmh.org/images/content/gmu/mu-2023-1.pdf











Комментарии