Д.Г. Почерников1 , В.В. Гетьман1 , Н.Т. Постовойтенко1 , Д.М. Рысев1 , И.С. Галкина2
1 ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России; Россия, 153012 Иваново, Шереметевский просп., 8;
2 ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России; Россия, 127254 Москва, ул. Добролюбова, 11 Контакты: Денис Геннадьевич Почерников urologkmn@mail.ru
Введение
Воспалительный процесс в предстательной железе (ПЖ) не всегда проявляется клинической симптоматикой, а часто сопровождается только увеличением количества лейкоцитов в секрете ПЖ или эякуляте, что обнаруживается случайным образом при профилактических осмотрах или при обследовании по поводу бесплодия или нарушения копулятивной функции [1–5]. Достаточно часто такая бактериоспермия остается нераспознанной, ухудшая параметры спермы и снижая вероятность наступления беременности, даже при проведении экстракорпорального оплодотворения [6–11]. Длительно существующая асимптомная бактериоспермия поддерживает воспалительный процесс [12, 13], что соответствует хроническому простатиту IV категории по классификации Национальных институтов здравоохранения США (National Institutes of Health (NIH) Prostatitis Syndrome Classification). По результатам исследований и данным клинических рекомендаций последних лет, для идентификации микроорганизмов у бесплодных пар чаще используют эякулят [9, 14–16]. Стандартное обследование при хроническом простатите включает в себя проведение 4- или 2-стаканной пробы, для которой чаще всего используют секрет ПЖ [17–19], но имеется и альтернативный вариант – проба, для которой используют эякулят [10, 20]. Некоторые авторы убеждены, что для диагностики хронического простатита, особенно у мужчин с бесплодием, достаточно исследовать только эякулят [20], а секрет ПЖ не нужен, так как в большинстве случаев микробиота этих биотопов одинакова [6, 11]. Однако в клинических рекомендациях Европейской ассоциации урологов (European Association of Urology) 2019 г. указано, что для диагностики простатита рутинное бактериологическое исследование эякулята не рекомендуется в связи с большим количеством ложноположительных результатов [16]. В последние годы для выявления заболеваний придаточных половых желез широко используется не только бактериологический анализ, но и метод полимеразной цепной реакции (ПЦР) [21–24]. Благодаря более широкому внедрению метода ПЦР появилась возможность детально изучить микробиоту и эякулята, и секрета ПЖ и сравнить результаты рутинного бактериологического анализа и ПЦР в реальном времени (ПЦР-РВ), которые в большинстве случаев совпадают между собой [23, 24]. В научной литературе нам не встретились работы, посвященные исследованию микробиоты секрета ПЖ и эякулята методом ПЦР у пациентов с простатитом IV категории.
Цель исследования – сравнить частоту выявления различных микроорганизмов в секрете ПЖ и эякуляте методом ПЦР-РВ у пациентов с хроническим простатитом IV категории.
Материалы и методы
С декабря 2016 г. по июль 2019 г. проведено проспективное исследование с участием 81 мужчины. Пациенты обратились в урологическую клинику Ивановской государственной медицинской академии по поводу бесплодия, эректильной дисфункции или для прегравидарной подготовки. У всех пациентов по данным ПЦР-РВ выявлена бактериоспермия при отсутствии симптоматики, характерной для хронического простатита II или III категории по классификации NIH. У каждого пациента выполнено трансректальное ультразвуковое исследование ПЖ, микроскопия секрета ПЖ и/или эякулята. При выявлении >10 лейкоцитов в поле зрения по результатам микроскопического исследования секрета ПЖ и/или >1 млн/мл лейкоцитов по данным спермограммы ставили диагноз хронического простатита IV категории по NIH.
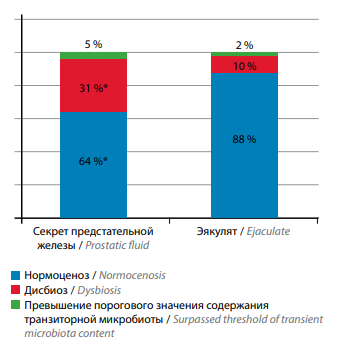
Рис. 1. Распределение исследованных образцов секрета простаты (n = 81) и эякулята (n = 81) в зависимости от результата полимеразной цепной реакции в реальном времени. Статистическая значимость различий с эякулятом: * – p <0,05
Fig. 1. Distribution of the examined prostatic fluid and ejaculate samples depending of the result of real-time polymerase chain reaction. Significance (in comparison with ejaculate): * – p <0,05
Критерии включения пациентов в исследование: отсутствие жалоб, характерных для хронического простатита в соответствии со специализированным опросником Национального института здравоохранения (NIH Chronic Prostatitis Symptom Index), использование барьерной контрацепции в период обследования.
Из исследования исключены пациенты, которые использовали антибактериальные препараты в течение 4 нед до обследования, и пациенты с наличием облигатных патогенов (Chlamydia trachomatis, Mycoplasma genitalium, Neisseria gonorrhoeae, Trichomonas vaginalis).
С целью количественной оценки видового состава микробиоты урогенитального тракта мужчин было выполнено исследование секрета ПЖ и эякулята методом ПЦР-РВ по ТУ 9398-090-46482062-2015 с помощью набора реагентов «Андрофлор» (регистрационное удостоверение на медицинское изделие № РЗН 2016/4490 от 25.07.2016) («ДНК-Технология», Россия).
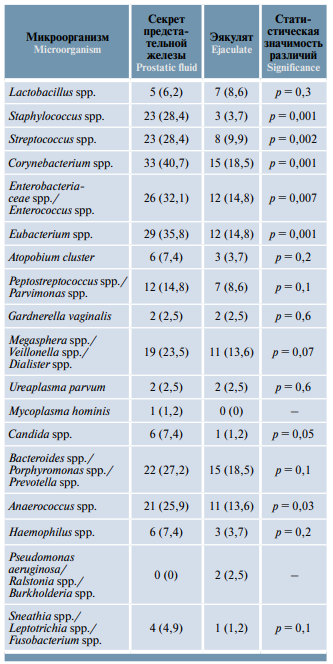
Таблица 1. Частота выявления микроорганизмов в секрете предстательной железы и эякуляте методом полимеразной цепной реакции в реальном времени у пациентов с хроническим простатитом IV категории, абс. (%)
Table 1. Rate of microorganism detection in the prostatic fluid and ejaculate using real-time polymerase chain reaction in patients with category IV chronic prostatitis, abs. (%)
При проведении ПЦР-РВ использовали детектирующий амплификатор ДТ-96 («ДНК-Технология», Россия). Количественные результаты исследования представлены в ГЭ/мл, эти значения пропорциональны степени микробной обсемененности урогенитального биотопа. Статистический анализ данных выполнен с применением пакета прикладных программ Microsoft Excel 2013 и Statistica 10.0 (StatSoft, Inc., США). Статистическую значимость различий определяли с помощью критериев Фишера, Вилкоксона и метода знаков, различия считали статистически значимыми при p <0,05.
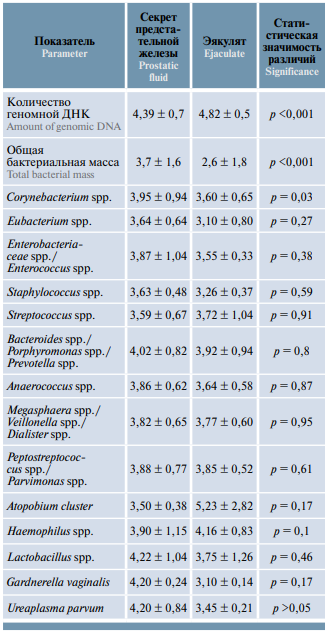
Таблица 2. Количество микроорганизмов в секрете предстательной железы и эякуляте, определенный методом полимеразной цепной реакции в реальном времени у пациентов с хроническим простатитом IV категории, log10, ГЭ/мл
Table 2. Microorganism amount in prostatic fluid and ejaculate measured using real-time polymerase chain reaction in patients with category IV chronic prostatitis, log10, GE/ml
Результаты
Результаты ПЦР-РВ трактовали в соответствии с алгоритмом [25].
Адекватность представленного на исследование биоматериала оценивали по значениям 3 контрольных показателей: количеству геномной ДНК, общей бактериальной массе и содержанию транзиторной микробиоты. Структуру микробиоты и доминирующие группы микроорганизмов (непатогенных и условно-патогенных) определяли по значению относительных количеств. Наличие возбудителей основных инфекций, передаваемых половым путем, определяли по результатам обнаружения ДНК патогенных микроорганизмов (при выявлении Chlamydia trachomatis, Mycoplasma genitalium, Neisseria gonorrhoeae, Trichomonas vaginalis пациентов исключали из исследования), содержание дрожжевых грибов – по количеству грибов рода Candida.
При статистическом анализе установлено, что в секрете ПЖ достоверно чаще, чем в эякуляте, встречались Corynebacterium spp., Staphylococcus spp., Streptococcus spp., Enterobacteriaceae spp./Enterococcus spp., Eubacterium spp., Anaerococcus spp. и Candida spp. (p <0,05), остальные микроорганизмы (Atopobium cluster, Peptostreptococcus spp./Parvimonas spp., Megasphera spp./Veillonella spp./Dialister spp., Bacteroides spp./Porphyromonas spp./Prevotella spp., Haemophilus spp., Sneathia spp./Leptotrichia spp./Fusobacterium spp., Gardnerella vaginalis и Ureaplasma parvum) встречались одинаково часто в секрете ПЖ и эякуляте (p >0,05). В эякуляте чаще, чем в секрете ПЖ, встречались Lactobacillus spp., но эти различия были статистически незначимыми (p >0,05). Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp. были обнаружены только в эякуляте, а Mycoplasma hominis только в секрете ПЖ (табл. 1).
Обсуждение
Большинство урологов для выявления инфекционного агента методом ПЦР-РВ используют эякулят, а секрет ПЖ исследуют реже, считая встречаемость микроорганизмов в различных биологических материалах одинаковой. Проведенное нами исследование демонстрирует статистически значимые различия в составе микробиоты секрета ПЖ и эякулята, что необходимо учитывать при выборе биоматериала для дифференциальной диагностики инфекционных заболеваний придаточных половых желез. Особенность обследования больных с хроническим простатитом состоит в том, что для получения клинически значимых результатов требуется точное определение источника инфекционного процесса, для чего необходим анализ микробиоты и эякулята, и секрета ПЖ. Неоднородность микробиоты секрета ПЖ и эякулята, на наш взгляд, обусловлена, с одной стороны, разведением эякулята другими компонентами, входящими в его состав. С другой стороны, более низкий титр и меньшая частота выявления бактерий в эякуляте объясняется тем, что семенная жидкость, по сравнению с секретом ПЖ, имеет более выраженные антибактериальные свойства. По-видимому, это связано с эволюционными процессами, так как это свойство эякулята снижает вероятность передачи партнерше, а следовательно, и плоду инфекционных агентов.

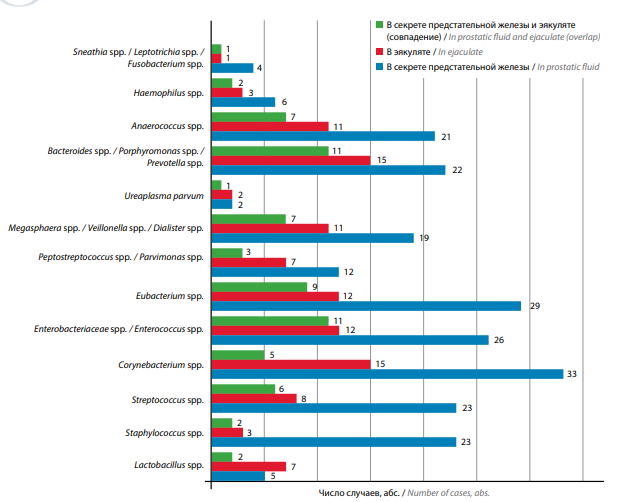
Рис. 2. Частота выявления микроорганизмов в секрете предстательной железы и эякуляте (по результатам полимеразной цепной реакции в реальном времени)
Fig. 2. Rate of microorganism detection in the prostatic fluid and ejaculate (the result of real-time polymerase chain reaction)
Заключение
Для полноценной диагностики этиологического фактора простатита и назначения этиотропной терапии в сложных клинических случаях целесообразно исследовать как эякулят, так и секрет ПЖ, поскольку микробиота данных биотопов отличается.
Литература
- Merino G., Carranza-Lira S., Murrieta S. et al. Bacterial infection and semen characteristics in infertile men. Arch Androl 1995;35(1):43–7. DOI: 10.3109/01485019508987852.
- Korrovits P., Punab M., Türk S, Mändar R. Seminal microflora in asymptomatic inflammatory (NIH IV category) prostatitis. Eur Urol 2006;50(6):1338–44. DOI: 10.1016/j.eururo.2006.05.013.
- Chen Y., Li J., Hu Y. et al. Multi-factors including inflammatory/immune, hormones, tumor-related proteins and nutrition associated with chronic prostatitis NIH IIIa+b and IV based on FAMHES project. Sci Rep 2017;7(1):9143. DOI: 10.1038/s41598-017-09751-8.
- Krieger J.N., Jacobs R.R., Ross S.O. Does the chronic prostatitis/pelvic pain syndrome differ from nonbacterial prostatitis and prostatodynia? J Urol 2000;164(5):1554–8.
- Фаниев М.В., Шевченко Н.П., Кадыров З.А. Современные стратегии ведения инфертильных мужчин с хроническим бактериальным простатитом на этапе прегравидарной подготовки в протоколе вспомогательных репродуктивных технологий. Андрология и генитальная хирургия 2017;18(3):44–53. [Faniev M.V., Shevchenko N.P., Kadyrov Z.A. Modern strategies of infertile male’s treatment with chronical bacterial prostatitis on the stage of preconception predation in protocols of auxiliary reproductive technologies. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2017;18(3):44–53. (In Russ.)]. DOI: 10.17650/2070-9781-2017-18-3- 44-53.
- Schuppe H.C., Pilatz A., Hossain H. et al. Urogenital infection as a risk factor for male infertility. Dtsch Arztebl Int 2017;114(19):339–46. DOI: 10.3238/arztebl.2017.0339.
- Rehewy M.S., Hafez E.S., Thomas A., Brown W.J. Aerobic and anaerobic bacterial flora in semen from fertile and infertile groups of men. Arch Androl 1979;2(3):263–8. DOI: 10.3109/01485017908987323.
- Ricci S., De Giorgi S., Lazzeri E. et al. Impact of asymptomatic genital tract infections on in vitro fertilization (IVF) outcome. PLoS One 2018;13(11):e0207684. DOI: 10.1371/journal.pone.0207684.
- Studies on men’s health and fertility. Ed. by A. Agarwal, R.J. Aitken, J.G. Alvarez. New York: Human Press, 2012. Pp. 564–566.
- Weidner W., Jantos C., Schiefer H.G. et al. Semen parameters in men with and without proven chronic prostatitis. Arch Androl 1991;26(3):173–83. DOI: 10.3109/01485019108987640.
- Magri V., Wagenlehner F.M., Montanari E. et al. Semen analysis in chronic bacterial prostatitis: diagnostic and therapeutic implications. Asian J Androl 2009;11(4):461–77. DOI: 10.1038/aja.2009.5.
- Nickel J.C. Recommendations for the evaluation of patients with prostatitis. World J Urol 2003;21(2):75–81. DOI: 10.1007/s00345-003-0328-1.
- Magri V., Boltri M., Cai T. et al. Multidisciplinary approach to prostatitis. Arch Ital Urol Androl 2019;90(4):227–48. DOI: 10.4081/aiua.2018.4.227.
- Урология. Российские клинические рекомендации. Под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. М.: Медфорум, 2018. 544 с. [Urology. Russian clinical guidelines. Ed. by Yu.G. Alyaev, P.V. Glybochko, D.Yu. Pushkar. Moscow: Medforum, 2018. 544 p. (In Russ.)].
- Андрология для урологов. Под ред. П.А. Щеплева. М.: Mедфорум-Альфа, 2019. 424 с. [Andrology for urologists. Ed. by P.A. Shcheplev. Moscow: Medforum-Alpha, 2019. 424 p. (In Russ.)].
- Bonkat G., Bartoletti R.R., Bruyère F. et al. Urological infections. [European Association of Urology guideline]. 2019. Available at: https://uroweb.org/ guideline/urological-infections/#6.
- Nickel J.C., Shoskes D., Wang Y. et al. How does the pre-massage 2-glass test compare to the Meares-Stamey 4-glass test in men with chronic prostatitis/ chronic pelvic pain syndrome? J Urol 2006;176(1):119–24. DOI: 10.1016/S0022-5347(06)00498-8.
- McNaughton Collins M., Fowler F.J. Jr, Elliott D.B. et. al. Diagnosing and treating chronic prostatitis: do urologists use the four-glass test? Urology 2000;55(3):403–7. DOI: 10.1016/s0090-4295(99)00536-1.
- Lin H.P., Lu H.X. [Analysis of detection and antimicrobial resistance of pathogens in prostatic secretion from 1186 infertile men with chronic prostatitis]. Zhonghua Nan Ke Xue 2007;13(7):628–31. (In Russ.)].
- Budia A., Luis Palmero J., Broseta E. et al. Value of semen culture in the diagnosis of chronic bacterial prostatitis: a simplified metod. Scand J Urol Nephrol 2006;40(4):326–31. DOI: 10.1080/00365590600748247.
- Kiessling A.A., Desmarais B.M., Yin H.Z. et al. Detection and identification of bacterial DNA in semen. Fertil Steril 2008;90(5):1744–56. DOI: 10.1016/j.fertnstert.2007.08.083.
- Mändar R., Punab M., Korrovits P. et al. Seminal microbiome in men with and without prostatitis. Int J Urol 2017;24(3):211–6. DOI: 10.1111/iju.13286.
- Почерников Д.Г., Постовойтенко Н.Т., Стрельников А.И. Сравнительный анализ культурального и молекулярно-генетического методов в исследовании микробиоты эякулята при мужской инфертильности. Андрология и генитальная хирургия 2019;20(2):40–7. [Pochernikov D.G., Postovoytenko N.T., Strelnikov A.I. Comparative analysis of cell culture and molecular genetic testing of semen microbiota in male infertility. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2019;20(2):40–7. DOI: 10.17650/2070-9781-2019-20-2-40-47.
- Ворошилина Е.С., Зорников Д.Л., Паначева Е.А. Сравнительное исследование микробиоты эякулята методом количественной ПЦР и культуральным методом. Вестник РГМУ 2019;(1):44–9. [Voroshilina E.S., Zornikov D.L., Panacheva E.A. Evaluation of the ejaculate microbiota by real-time PCR and culture-based technique. Vestnik RGMU = Bulletin of RSMU 2019;(1):44–9. (In Russ.)]. DOI: 10.24075/vrgmu.2019.009.
- Липова Е.В., Чекмарев А.С., Болдырева М.Н. Новый метод диагностики инфекционно-воспалительных заболеваний нижних отделов мочеполового тракта у мужчин (тест «Андрофлор®», «Андрофлор®Скрин»). М., 2017. 48 с. [Lipova E.V., Chekmarev A.S., Boldyreva M.N. New method for diagnostics of infectiousinflammatory diseases of the lower urinary tract in men (test “Agroflor®”, “Agroflor®Screen”). Moscow, 2017. 48 p. (In Russ.)











Комментарии