В.М. Попков, Н.Б. Захарова, А.Б. Полозов, А.И. Хотько, Д.Н. Хотько, Д.А. Дурнов
ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, Саратов
Введение
У пациентов с мочекаменной болезнью (МКБ) при наличии различной степени выраженности обструкции мочевыводящих путей отмечается высокий риск развития осложнений, к которым относится и калькулезный пиелонефрит [1, 2]. Развитие обструктивной уропатии (ОУ) сопровождается структурно-функциональными изменениями почечной паренхимы. Данные нарушения затрагивают преимущественно тубулоинтерстиций и сопровождаются снижением почечной функции [3]. Известно, что конкремент даже небольших размеров, но вызывающий обструкцию, способен оказать существенное влияние на функцию почки и клинические проявления заболевания [4].
Несмотря на активное развитие эндоскопической и перкутанной хирургии при лечении урологических пациентов с нефролитиазом и обструктивным синдромом имеются клинические ситуации, при которых на первом этапе следует выполнить адекватное дренирование почки. Несвоевременное разрешение ОУ может привести к атрофии канальцев, возникновению интерстициального фиброза, воспалению, что сопровождается избыточной продукцией ряда цитокинов и медиаторов. Оценка динамики «мочевых» биомаркеров, количественное определение которых позволит мониторировать выраженность структурно-функциональных нарушений, представляет несомненный интерес. Вероятность развития хронической болезни почек повышается при наличии длительной ОУ, что по мере прогрессирования может приводить к инвалидизации пациентов. До наступления осложнений ОУ в подавляющем большинстве случаев не имеет выраженных клинических проявлений, однако их течение сопровождается повреждением канальцев и клубочков почек.
В основе принятой современной нефропротективной терапии лежит применение ингибиторов ангиотензинпревращающего фермента (и-АПФ) и блокаторов рецепторов ангиотензина II (БРА) [5]. На сегодняшний день появляется все больше публикаций о нефропротективном влиянии новой генерации антагонистов кальция. Исследования с применением препарата нового поколения лерканидипина демонстрируют наличие значимого нефропротективного эффекта. Выявлено заметное снижение внутриклубочкового давления с устойчивой вазодилатацией не только афферентных (как у «классических» антагонистов кальция), но и эфферентных (как у и-АПФ и БРА) артериол клубочков почек. Антагонисты кальция (лерканидипин и др.) существенно снижают внутриклубочковое давление, что приводит к замедлению прогрессирования почечного повреждения [6]. Механизм вазодилатации эфферентных артериол почек на фоне приема новых блокаторов кальциевых каналов до конца не ясен. Определенная роль отводится вазодилататорам, вырабатываемым эндотелием сосудов, — оксиду азота и простагландину II. Полученные данные свидетельствуют о том, что блокада кальциевых каналов Т-типа ингибирует выработку ангиотензина II, что вызывает вазодилатацию эфферентных артериол.
Травматизация почечной паренхимы при ОУ инициирует каскад молекулярных взаимодействий с последующими морфологическими изменениями. Данное обстоятельство побуждает многих исследователей к поиску протекторов, предотвращающих или хотя бы ограничивающих масштабы структурно-функциональных повреждений в почке и способных оказывать влияние на скорость их восстановления. В современной литературе достаточно большое внимание уделяется поиску мочевых маркеров у больных пиелонефритом и уролитиазом для оценки воспалительных изменений [7–11], а также при оценке выраженности острого почечного повреждения [12–14]. При этом велика потребность изучения легко выделяемых маркеров в моче, характеризующих степень восстановления почечной функции.
Целью настоящего исследования было изучение нефропротекторного эффекта применения лерканидипина у больных уролитиазом с явлениями обструктивной уропатии на основе его влияния на динамику маркеров IL-8, VEGF, МСР-1, G-CSF и GM–CSF и скорость клубочковой фильтрации (СКФ).
Материал и методы
Обследовано 96 пациентов с МКБ, проходивших лечение в клинической больнице им. С.Р. Миротворцева ФГБОУ ВО «Саратовского ГМУ им. В.И. Разумовского» Минздрава России в 2015–2017 гг. Помимо изучения жалоб и сбора анамнеза, физикального обследования пациентов, проведения общего и биохимических анализов крови; общего анализа мочи, обзорной и экскреторной рентгенографии почек и мочевых путей, ультразвукового исследования, мультиспиральной компьютерной томографии с реконструкцией изображения выполняли иммуноферментное определение вышеуказанных маркеров. В состав 1-й группы были включены 33 пациента с конкрементами размером от 1,0 до 2,0 см в лоханочно-мочеточниковом сегменте. Средний возраст обследуемых составил 45,8 года (от 25 до 60 лет). У всех обследованных больных по данным рентгенологического и ультразвукового обследования отмечены признаки обструкции верхних мочевыводящих путей: размеры чашечек почек варьировали от 6 до 10 мм, лоханки — 1,8–3,5 см, а также диагностировано замедление выделительной функции почек на стороне поражения по данным экскреторной урографии. Длительность обструкции (время с момента первичного приступа почечной колики) составила от 1,5 до 12 недель. При этом гипертермии в этот период, а также других признаков обострения пиелонефрита отмечено не было. Включенные в исследование пациенты имели снижение СКФ от 30 до 60 мл/с. Во 2-ю группу были включены 33 пациента с аналогичной клинической картиной, сопоставимые по возрасту, полу и результатам обследования. Перед литотрипсией пациентам обеих групп выполняли дренирование почки в условиях операционной с использованием набора для чрескожно-пункционной нефростомии по общепринятой методике. Всем больным в послеоперационном периоде назначали антибактериальную и противовоспалительную терапию. Пациенты 2-й группы после дренирования почки с целью нефропротекции получали лерканидипин в дозе 10 мг 1 раз в сутки в течение 1 месяца. Второй этап лечения (литотрипсию) осуществляли на 28–35-е сутки после дренирования почки. В группу сравнения были включены 30 пациентов с чашечными конкрементами почек размером от 1 до 1,5 см, не вызывающими явлений обструкции, которые были сопоставимы по возрасту и полу с больными обследуемых групп. Перед включением в исследование все пациенты подписали информированное согласие.
Количественный анализ VEGF (Vascular endothelial growth factor; фактор роста эндотелия сосудов), MCP-1 (Monocyte Chemoattractant Protein 1; моноцитарный хемотаксический протеин 1), IL-8 (Interleukin-8; интерлейкин-8), G-CSF (Granulocyte-colony stimulating factor; гранулоцитарный колониестимулирующий фактор) и GM-CSF (Granulocyte-macrophage colony-stimulating factor; гранулоцитарно-макрофагальный колониестимулирующий фактор) в моче больных изучаемых групп проводили пятикратно. Для первого исследования забор мочи осуществляли в момент пункции лоханки. Мочу собирали в специальные стаканы с крышками, в которые предварительно было внесено 20 мкл консерванта ProClin 300 (SUPELCO, США). Затем на 7, 14, 21, 28-е сутки после дренирования забор мочи выполняли из нефростомического дренажа. У больных группы сравнения забор материала осуществляли однократно. Концентрацию цитокинов в моче определяли методом твердофазного иммуноферментного анализа, используя соответствующие наборы реагентов АО «Вектор-Бест» (Новосибирск). Одновременно с забором мочи у больных с ОУ выполняли забор образцов периферической крови для исследования уровня креатинина (пробы крови у пациентов группы сравнения брали однократно). Концентрация креатинина, определенная в сыворотке крови обследуемых лиц, была использована для расчета СКФ по уравнению CKD-EPI для представителей европейской расы.
Статистическую обработку полученных результатов проводили с помощью программ Statistica 10.0, SPSS 13.0. Распределение значений в исследуемых выборках отличалось от нормального, в связи с чем были применены методы непараметрического анализа, включающего вычисление медианы, интерквартильного размаха, построение блочных диаграмм. В качестве критерия достоверности отличия между двумя независимыми группами использовали непараметрический критерий (U) Манна–Уитни. Во всех процедурах статистического анализа уровень значимости принимали р < 0,05. Для оценки диагностической значимости маркеров выполняли построение характеристической кривой (ROC-анализ).
Результаты
В моче больных 1-й и 2-й групп имелось достоверное повышение концентрации медиаторов VEGF, MCP-1, IL-8 примерно в 2 раза, GM-CSF в 1,4 раза, G-CSF в 7,9 раза по сравнению с группой сравнения (табл. 1). Достоверных различий между исследуемыми группами не было.
Таблица 1. Медианы концентраций маркеров мочи на дооперационном этапе у больных исследуемых групп и группы сравнения
| Исследуемый маркер (пг/мл) | Моча Me (25-75 %) | ||
| Группа сравнения, п = 30 | 1-я группа, п = 33 | 2-я группа, п = 33 | |
| VEGF | 231,9 (198,8-242,1) | 539,5 (454-546,5) | 524,34 (387-546,4) |
| IL-8 | 20,6 (19-23,55) | 43,5 (38,2-45) | 43,7 (32,8-45,8) |
| МСР-1 | 320,5 (295,9-338) | 641,22 (568,9-650) | 647 (425,6-709,6) |
| G-CSF | 0 (0-3,15) | 7,99 (6,78-9,8) | 7,98 (5,6-11,23) |
| GM-CSF | 5,3 (3,75-5,6) | 7,35 (6,6-8,3) | 7,35 (7,02-7,86) |
Для оценки диагностической значимости данных маркеров был проведен ROC-анализ (рис. 1). Диагностическая значимость выявлена для VEGF (чувствительность — 95,2 %, специфичность — 95 %), IL-8 (чувствительность — 83,9 %, специфичность — 85 %), MCP-1 (чувствительность — 87,1 %, специфичность — 95 %), GM-CSF (чувствительность — 87,1 %, специфичность — 85 %), G-CSF — 5,89 пг/мл (чувствительность — 77,3 %, специфичность — 90 %).
В процессе разрешения обструкции наблюдалось достоверное снижение уровней VEGF, MCP-1, IL-8, GM-CSF в моче. Динамика маркеров представлена на рис. 2–5 (ось абсцисс — сутки, ось ординат — концентрация изучаемого маркера, пг/мл; кривая красного цвета — 1-я группа, кривая зеленого цвета — 2-я группа, кривая синего цвета — группа сравнения).
Динамика уровня VEGF в моче пациентов обследуемых групп характеризуется снижением данного показателя после дренирования почки к 28-м суткам, достигая значений группы сравнения. При этом при назначении лерканидипина уровень VEGF в моче нормализуется быстрее и достигает значений группы сравнения уже к 21-м суткам (см. рис. 2).
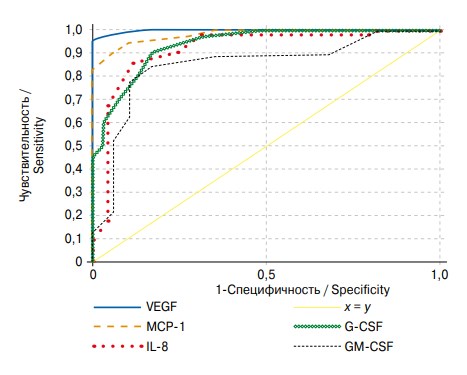
Рис. 1. ROC-кривые чувствительности и специфичности VEGF, MCP-1, IL-8, G-CSF, GM-CSF в моче в оценке обструктивной уропатии у больных нефролитиазом
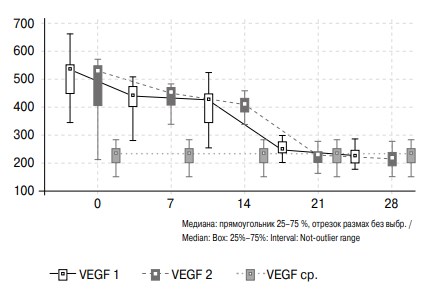
Рис. 2. Изменение активности VEGF в моче больных с обструктивной уропатией в течение месяца после дренирования почки и группы сравнения
Подобная тенденция прослеживается и для динамики активности MCP-1 в моче больных с ОУ (см. рис. 3). После установки нефростомического дренажа наблюдается постепенное снижение уровня MCP-1 в моче пациентов с ОУ, причем более быстрое снижение уровня данного маркера отмечается у больных 2-й группы. К 21-м суткам после дренирования почки показатели у пациентов 2-й группы сопоставимы со значениями в группе сравнения.
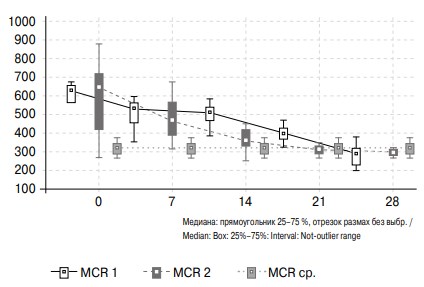
Рис. 3. Изменение активности MCP-1 в моче больных с обструктивной уропатией в течение месяца после дренирования почки и группы сравнения
В процессе разрешения обструкции наблюдается постепенное снижение содержания IL-8 в моче у пациентов обеих групп, при этом у пациентов 2-й группы достижение показателей группы сравнения также происходит к 21-м суткам, у пациентов 1-й группы — к 28-м суткам (см. рис. 4).
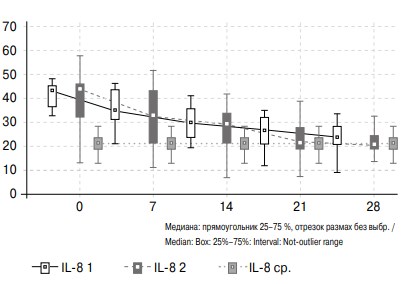
Рис. 4. Изменение активности IL-8 в моче больных с обструктивной уропатией в течение месяца после дренирования почки и группы сравнения
После дренирования почки у больных с ОУ наблюдаются рост концентрации GM–CSF в моче, достигающей своего пика к 14-м суткам после нефростомии, и дальнейшее снижением значения этого показателя. При этом значения группы сравнения у пациентов 1-й группы достигаются к 28-м суткам, а у больных 2-й группы, получавших лерканидипин, уже к 21-м суткам.
При изучении концентрации G-CSF в моче мы не отметили достоверных различий в зависимости от времени, прошедшего после дренирования почки, у пациентов как 1-й, так и 2-й группы.
Оценка функционального состояния почек у пациентов 1-й и 2-й групп до нефростомии показала повышение уровня креатинина сыворотки крови в среднем до 140 ± 10,6 мкмоль/л и снижение СКФ до 55 ± 13,3 мл/мин. После устранения нарушения оттока мочи из почки наблюдалась нормализация этих показателей, причем более быстрая у больных 2-й группы, получавших лерканидипин в качестве нефропротектора (рис. 6).
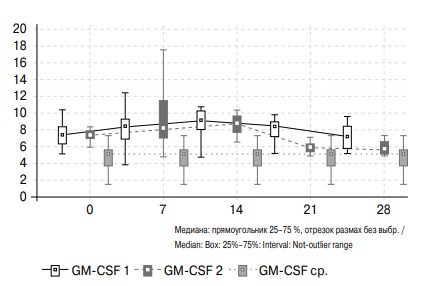
Рис. 5. Изменение активности GM-CSF в моче больных с обструктивной уропатией в течение месяца после дренирования почки и группы сравнения
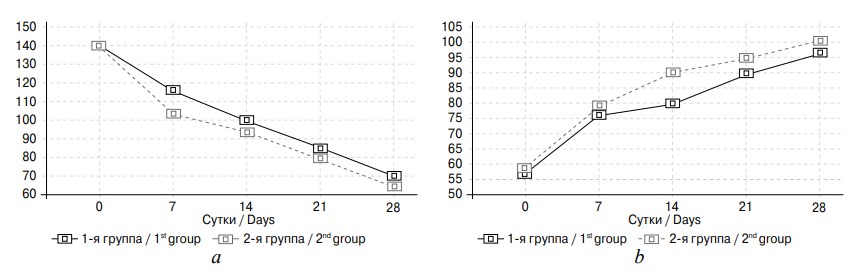
Рис. 6. Функциональное состояние почек у больных с обструктивной уропатией 1-й и 2-й групп до и после дренирования почки: а — уровень креатинина (мкмоль/л); b — СКФ CKD-EPI (мл/мин)
Корреляционные связи между уровнями изучаемых маркеров и содержанием сывороточного креатинина и СКФ представлены в табл. 2.
Таблица 2. Корреляционная связь между уровнями мочевых маркеров и показателями почечной функции
| Показатели почечной функции | Молекулярные маркеры | ||||
| VEGF | МСР-1 | IL-8 | G-CSF | GM-CSF | |
| Сывороточный креатинин | r = 0,51 | r =0,511 | r = 0,375 | r = -0,05 | r = 0,266 |
| СКФ (CKD-EPI) | r = -0,551 | r = -0,602 | r =-0,381 | r = 0,032 | r = -0,19 |
Выявлена корреляционная связь средней силы между значениями VEGF, IL-8, MCP-1 в моче, с одной стороны, и уровнем сывороточного креатинина и СКФ — с другой. Наличие данной корреляционной связи определяет значимость оценки этих мочевых маркеров в изучении функционального состояние почки.
Обсуждение
Односторонние ОУ, даже без выраженных клинических проявлений, сопровождаются повреждением канальцев и клубочков почек. Имеющий место застой мочи приводит к повышению внутриуретерального и внутрилоханочного давления, изменению почечного кровотока, механическому растяжению канальцев почки [15]. Данный процесс сопровождается активацией тубулоцитов и клеток эндотелия сосудов, которые продуцируют ряд провоспалительных цитокинов и хемокинов, инициирующих миграцию нейтрофилов, лейкоцитов и макрофагов в поврежденный интерстиций и образование воспалительных инфильтратов. Одним из главных факторов, способствующих их формированию, является MCP-1, синтезируемый активированными тубулоцитами и регулирующий перемещение моноцитов/макрофагов в зону воспаления. Не менее значимую роль в этом процессе играет IL-8, секретируемый макрофагами и эндотелиальными клетками и участвующий в поддержании хронического иммунного воспаления. Доказано, что продукция этого хемокина повышается при монолатеральной обструкции, сопровождающейся нарушением уродинамики и локальным воспалением. Развитие ОУ приводит к ремоделированию кровотока и развитию тканевой гипоксии, что вызывает усиление синтеза VEGF подоцитами клубочков и клетками канальцев почки [16]. GM-CSF вырабатывается тубулоцитами и фибробластами и играет важную роль в содействии выживанию моноцитов и активации макрофагов. Продукция данного цитокина увеличивается при развитии ОУ. Еще одним цитокином, значения которого повышаются у больных с ОУ, является гранулоцитарный колониестимулирующий фактор (G-CSF). Функции данного фактора заключаются в активации роста и дифференцировки гемопоэтических клеток, в частности гранулоцитов, макрофагов и эозинофилов, а также стимуляции хемотаксиса нейтрофилов [17]. Разрешение обструкции и восстановление адекватной уродинамики обусловливает снижение внутрилоханочного давления и травматического влияния на почечные канальцы, что приводит к снижению синтеза вышеперечисленных маркеров. Достижение значений группы сравнения свидетельствует о завершении патологических процессов и возможности проведения второго этапа оперативного лечения, минимизировав риски развития осложнений, в частности обострения пиелонефрита и развития нефрофиброза в отдаленном периоде. На основании динамики содержания VEGF, IL-8, MCP-1, GM-CSF в моче оптимальными сроками выполнения литотрипсии у больных ОУ без применения лерканидипина следует считать 28-е сутки с момента разрешения обструкции. Назначение лерканидипина способствует более быстрому восстановлению почечной функции и снижению уровня изучаемых цитокинов. Принимая во внимание положительную динамику в отношении снижения исследуемых маркеров, целесообразно назначать данный препарат после дренирования почки. При этом следует учитывать, что оценку эффективности лерканидипина у пациентов с неразрешенной обструкцией не проводили. Назначение лерканидипина позволяет сократить сроки проведения литотрипсии до 21-х суток после установки нефростомы.
Таким образом, восстановление функции почки у больных с обструктивной уропатией вследствие МКБ после установки нефростомического дренажа на фоне лечения лерканидипином происходит быстрее, о чем свидетельствует достоверно более быстрое снижение маркеров воспаления и ангиогенеза, нефрофиброза и колониестимулирующих факторов, коррелирующих со снижением уровня сывороточного креатинина и увеличением СКФ. По результатам исследования лерканидипин может быть рекомендован в качестве нефропротектора у данной категории больных. При использовании лерканидипина в дозе 10 мг в сутки в течение 3–4 недель возможно обоснованно уменьшить время выполнения второго этапа оперативного вмешательства, что позволит сократить сроки лечения пациентов и оптимизировать работу урологического стационара.
Выводы
- Блокатор кальциевых каналов лерканидипин может быть использован в качестве средства нефропротективной терапии в процессе разрешения обструкции при лечении больных нефролитиазом. Результаты исследования позволяют обоснованно рекомендовать применение лерканидипина у пациентов с МКБ в дозе 10 мг в сутки с целью сокращения сроков дренирования почки перед выполнением литотрипсии.
- Медиаторы мочи (VEGF, MCP-1, IL-8), содержание которых коррелирует с величиной СКФ, могут быть использованы в качестве неинвазивных индикаторов при оценке структурно-функциональных изменений почечной паренхимы у больных нефролитиазом с ОУ
Конфликт интересов отсутствует
Литература
- Hasna A, Meiyappan K, Periyasam SG, et al. Is urolithiasis associated with increased levels of high sensitivity C-reactive protein and interleukin-6 in diabetic patients? J Clin Diagn Res. 2015;9(3):1-3. doi: 10.7860/JCDR/2015/12489.5681.
- Wang CJ, Hsu CS, Chen HW, et al. Percutaneous nephrostomy versus ureteroscopic management of sepsis associated with ureteral stone impaction: a randomized controlled trial. Urolithiasis. 2016;44(5):415-419. doi: 10.1007/s00240-015-0852-7.
- Ucero AC, Gonçalves S, Benito-Martin A, et al. Obstructive renal injury: from fluid mechanics to molecular cell biology. Open Access J Urol. 2010;2:41-55.
- Arakawa T. Surgical management for urolithiasis. Clin Calcium. 2011;21(10):1535-1541. (In Japanese). doi: CliCa111015351541.
- Николаев А.Ю. Возможности и перспективы нефропротективной стратегии // Терапевтический архив. – 2012. – № 6. – С. 77–80. [Nikolaev AYu. Vozmozhnosti i perspektivy nefroprotektivnoj strategii. Terapevticheskij arhiv. 2012;(6):77-80. (In Russ.)]
- Кукес В.Г., Остроумова О.Д., Стародубцев А.К. Антагонисты кальция: современные аспекты применения в кардиологии // Consilium medicum. – 2006. – № 11. – С. 113–117. [Kukes VG, Ostroumova OD, Starodubtsev AK. Calcium antagonists: modern aspects of the use in cardiology. Consilium medicum. 2006;(11):113-117. (In Russ.)]
- Глыбочко П.В., Захарова Н.Б., Понукалин А.Н., и др. Диагностическое значение подъема уровня провоспалительных цитокинов в моче при обострении хронического калькулезного пиелонефрита // Саратовский научно-медицинский журнал. – 2011. – Т. 7 (прил.). – С. 143. [Glybochko PV, Zakharova NB, Ponukalin AN, et al. Diagnosticvalue of theincreased levels of proinflammatorycytokinesin the urine during exacerbation ofchroniccalculous pyelonephritis. Saratovskiy nauchno-meditsinskiy zhurnal. 2011;7(Suppl.):143. (In Russ.)]
- Захарова Н.Б., Пастушкова Л.Х., Ларина И.М., и др. Значение протеомного состава мочи при заболеваниях мочевыводящих путей (обзор литературы) // Экспериментальная и клиническая урология. – 2017. – № 1. – C. 22–26. [Zakharova NB, Pastushkova LH, LarinaIM,etal. Theimportance of the proteomiccomposition of urine in urinary tract diseases. Literature review of literature. Experimental and clinical urology. 2017;(1):22-26. (In Russ.)]
- Морозов Д.А., Морозова О.Л., Захарова Н.Б., Лакомова Д.Ю. Патогенетические основы и современные проблемы диагностики хронического обструктивного пиелонефрита у детей // Урология. – 2013. – № 2. – С. 129–134. [Morozov DA, Morozova OL, Zakharova NB, Lakomova DYu. Pathogenetical basesand current problems of diagnosis of chronic obstructive pyelonephritis in children. Urologiia. 2013;(2):129-134. (In Russ.)]
- Алексеев А.В., Гильманов А.Ж., Гатиятуллина Р.С., Ракипов И.Г. Современные биомаркеры острого повреждения почек // Практическая медицина. – 2014. – № 3. – С. 22–27. [Alekseev AV, Gilmanov AZh, Gatiyatullina RS, Rakipov IG. Recent biomarkers of acute renal injury. Prakticheskaja medicina. 2014;(3):22-27. (In Russ.)]
- Кореньков Д.Г., Марусанов В.Е., Мишина Т.П., Павлов А.Л. Провоспалительные цитокины в определении степени активности хронического пиелонефрита // Урологические ведомости. – 2015. – Т. 5. – № 4. – С. 13–19. [Korenkov DG, Marusanov VE, Mishina TP, Pavlov AL Proinflammatory cytokines in determining the degree of activity of chronic pyelonephritis. Urologicheskie vedomosti. 2015;5(4):13-19. (In Russ.)]
- Добронравов В.А. Обзор патофизиологии острого повреждения почек // Смирнов А.В., Добронравов В.А., Румянцев А.Ш. Острое повреждение почек. – М.: МИА, 2015. – C. 30–79. [Dobronravov VA. Overview of the pathophysiology of acute kidney injury. In: Smirnov AV, Dobronravov VA, Rumyantsev AS. Acute kidney injury. Moscow: MIA; 2015. P. 30-79. (In Russ.)]
- Damman K, Masson S, Hillege HL, et al. Tubular damage and worsening renal function in chronic heart failure. JACC Heart Fail. 2013;1(5):417-424. doi: 10.1016/j.jchf.2013.05.007.
- Крайдашенко О.В., Долинная М.А. Роль биомаркеров в оценке характера повреждений почек у больных гипертонической болезнью // Клиническая нефрология. – 2014. – № 3. – С. 23–25. [Kraydashenko OV, Dolinnaya MA. Biomarkers in assessment of renal involvement in patients with arterial hypertension. Klinicheskaja nefrologija. 2014;(3):23-25. (In Russ.)]
- Dendooven A, Ishola DA Jr, Nguyen TQ, et al. Oxidative stress in obstructive nephropathy. Int J Exp Path. 2010;92(3):202-210. doi: 10.1111/j.1365-2613.2010.00730.x.
- Семикина Е.Л., Русаков А.А., Филянская Е.Г., и др. Уровень факторов ангиогенеза в моче при одностороннем гидронефрозеу детей раннего возраста — различия концентрации in situ и в мочевом пузыре // Медицинская иммунология. – 2015. – Т. 17, специальный выпуск. – С. 210–211. [Semikina EL, Rusakov AA, Filyanskaya EG,etal. Uroven faktorovangiogenezav moche pri odnostoronnem gidronefroze u detej rannego vozrasta – razlichija koncentracii in situ i v mochevom puzyre. Medicinskaja immunologija. 2015;17(special issue):210-211. (In Russ.)]
- Shiomi A, Usui T. Pivotal Roles of GM-CSF in Autoimmunity and Inflammation. Mediators Inflamm. 2015;2015:1-13. doi: 10.1155/2015/568543
Статья опубликована в журнале "Урологические ведомости" № 3 2018, стр. 20-28













Комментарии