Сигаев А.В.1 , Митусов В.В.2 , Киреев А.Ю.2 , Коган М.И.2
1 МУЗ «Городская больница №1», отделение урологии, г.Старый Оскол
2 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону Адреса: 309500, Белгородская область, г. Старый Оскол, Комсомольский проспект 81. 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014448 Эл.почта: sigman@live.ru, mvv55@list.ru, alexanderkir1980@gmail.com, dept_kogan@mail.ru
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – наиболее распространенное из всех доброкачественных образований у мужчин старше 50 лет, а в возрасте старше 65 лет данное состояние гистологически верифицируется более чем у 70% мужчин [1]. Применение в последние два десятилетия селективных α-адреноблокаторов и ингибиторов 5-α редуктазы существенно уменьшило количество оперативных вмешательств при ДГПЖ. В эти же годы изменилась и сама хирургия данной патологии. Ее «золотым стандартом» стала эндохирургия – трансуретральная резекция предстательной железы (ТУРП), соотношение которой к открытым методикам лечения составляет как 10 : 1 и более [2].
Известно, что предстательная железа является гормональнозависимым органом. Влияние тестостерона на железу осуществляется через его активный метаболит 5α-дигидротестостерон. При этом тестостерон является источником не только образования 5α-дигидротестостерон, но и эстрогенов. Андрогены и эстрогены в свою очередь способствуют стимуляции пролиферативных процессов в предстательной железе. До сих пор не накоплено достаточного количества убедительных данных, свидетельствующих о наличии четкой корреляции между содержанием тестостерона в крови стареющих мужчин и состоянием простаты [1, 3]. В то же время, у 38% мужчин 51-60 лет с клиническими проявлениями ДГПЖ выявляется биохимический гипогонадизм, в возрасте 61-70 лет его частота возрастает до 52%, а у мужчин >70 лет – до 68% [3, 4, 5].
В наших ранних работах [6, 7] было показано, что развитие возрастного гипогонадизма сопровождается более ранним развитием симптомов нижних мочевых путей при доброкачественной гиперплазии предстательной железы. При этом течение ДГПЖ на фоне гипогонадизма сопровождается не только более тяжелыми клиническими проявлениями заболевания, но и более стремительной прогрессией симптомов.
Как оказалось, в литературе отсутствуют сведения, где была бы изучена тестостеронемия у пациентов с ДГПЖ, которым предстоит ТУРП. В связи с этим целью работы явилось изучение особенностей течения раннего послеоперационного периода у больных, подвергнутых ТУРП по поводу ДГПЖ с/без возрастного гипогонадизма.
Материалы и методы
Основу исследования составили 98 больных (возрастной диапазон 5390 лет) с доброкачественной гиперплазией предстательной железы, которым была выполнена ТУРП. Помимо стандартных общеклинических, лабораторных исследований и функциональных обследований необходимых при выполнении операции, всем больным произвели исследование крови на общий тестостерон (Т) иммуноферментным методом (норма = T>12 нмоль/л) до операции, а также через 1, 4, 10 и 30 сутки после ТУРП.
На основании полученных данных при исследовании крови на общий тестостерон пациенты были разделены на 2 клинические группы:
I группу (n=39 человек) составили пациенты, имеющие ДГПЖ без возрастного биохимического гипогонадизма – 39,8%;
II группу (n=59 человек) – пациенты с ДГПЖ и биохимическим гипогонадизмом – 60,2%.
Кроме того, II группа больных была разделена на две подгруппы:
II-А (n=27) – пациенты с гипогонадизмом, которым не проводили заместительную гормонотерапию и II-Б (n=32), где заместительная гормонотерапия была начата за 2 недели до планируемого оперативного вмешательства. Коррекцию гипогонадизма больным в группе 2-Б осуществляли препаратом Небидо 1000 мг внутримышечно.
В подгруппе II-А заместительную гормонотерапию на фоне биохимического гипогонадизма не проводили по следующим причинам:
- 8 человек имели срочные показания к выполнению хирургического лечения ДГПЖ в связи с тяжелой макрогематурией;
- 7 человек были оперированы по поводу острой задержки мочи, которую не удалось разрешить консервативными методами;
- 6 человек – пациенты с биохимически доказанным гипогонадизмом (показатели общего тестостерона крови в пределах «серой зоны»), но с отсутствием симптомов вторичного гипогонадизма по оценке шкалы AMS;
- 6 человек – пациенты с биохимически доказанным гипогонадизмом и слабо выраженными симптомами по данным шкалы AMS, которые отказались от проведения заместительной гормональной терапии по различным причинам.
Результаты
На рисунке 1 представлена динамика показателей тестостеронемии в группах и подгруппах на протяжении 30 суток после ТУРП. Анализ показал, что в раннем послеоперационном периоде у всех больных происходит существенное снижение уровня тестостерона крови, отмечаемое уже в первые сутки после ТУРП. Причем степень падения уровня Т в этот срок в I группе – 22,95%, а во II-А подгруппе – 18,25%; т.е. чем ниже уровень Т в крови, тем меньше степень его снижения. Тенденция к снижению тестостеронемии сохраняется до 10 суток, уровень Т падает в I группе и во II-А подгруппе на 34,30%. И только к 30 суткам после ТУРП определяется рост Т относительно 10 суток на 27,22% в I группе и на 30,50% во II-А подгруппе. Однако относительно исходных значений Т так и не достигает их: в I группе – на 16,40%; во II-А подгруппе – на 14,29% (р<0,05).
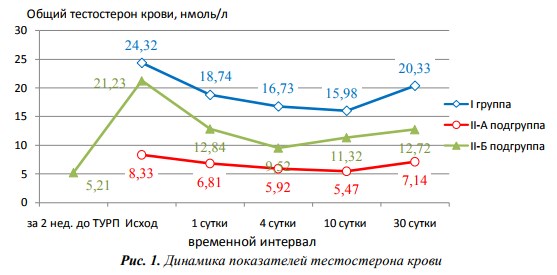
Рис. 1. Динамика показателей тестостерона крови
Аналогичная динамика тестостеронемии и во II-Б подгруппе, однако самый низкий уровень Т имеет место на 4 сутки, в последующем отмечается рост его уровня.
К 30 суткам в этой подгруппе уровень Т нормализуется и превышает исходное значение до введения «Небидо» в 2,44 раза. Таким образом, значительная часть послеоперационного периода во II-Б подгруппе протекает на фоне субнормативных и нормативных значений Т в крови больных после ТУРП.
Учитывая значимость и влияние тестостерона на функции различных органов и систем организма в целом, а следовательно, и на его регенераторные возможности, представилось важным оценить ранние и поздние послеоперационные осложнения, которые возникли у больных (таблицы1 и 2).
Таблица 1. Ранние послеоперационные осложнения после ТУР ДГПЖ
| Осложнения | I группа (п=39) | 11-Л подгруппа (п=27) | П-Б подгруппа (п=32) | |||
| абс. | % | абс. | % | абс. | % | |
| число | число | число | ||||
| Кровотечение из зоны резекции предстательной железы с тампонадой мочевого пузыря | 3 | 7,70% | 5 | 18,50% | 3 | 9,40% |
| ТУР-синдром | - | - | 1 | 3,70% | - | - |
| Острая задержка мочеиспускания после удаления уретрального катетера | 2 | 5,10% | 5 | 18,50% | 3 | 9,40% |
| Инфекционно-воспалительные осложнения: | ||||||
| - обострение хронического пиелонефрита | 3 | 7,70% | 7 | 25,90% | 4 | 12,50% |
| - острый эпидидимоорхит | 4 | 10,20% | 6 | 22,20% | 2 | 6,30% |
Таблица 2. Поздние послеоперационные осложнения (30-е сутки после ТУР ДГПЖ)
| Осложнения | I группа(п=39) | 11-Л подгруппа (п=27) | П-Б подгруппа (п=32) | |||
| абс. число | % | абс. число | % | абс. число | % | |
| Сохранение стойкой нрритативной симптоматики | 7 | 17,90% | 14 | 51,80% | 6 | 18,80% |
| Недержание мочи | 3 | 7,70% | 4 | 14,80% | 3 | 9,40% |
| Клинические проявления инфра-ветикальной обструкции | 2 | 5,10% | 2 | 7,40% | 1 | 3,10% |
По нашему мнению, благоприятное течение послеоперационного периода с минимизацией риска хирургических осложнений после ТУРП у пациентов с доказанным биохимическим гипогонадизмом (II-Б подгруппа) в первую очередь связано с проведением заместительной гормонотерапии, которая была начата за 2 недели до планируемого оперативного вмешательства.
Выводы
Выполнение ТУРП при ДГПЖ сопровождается снижением уровня тестостеронемии в первые 10 суток после операции у всех больных. Выполне-ние операции на фоне возрастного гипогонадизма негативно влияет не только на клиническое течение раннего послеоперационного периода, но и на развитие осложнений после ТУРП. Предоперационная диагностика гипогонадизма и его коррекция у больных с андрогенодефицитным состоянием, нуждающихся в выполнении ТУРП, позволяет в 2-3 раза снизить риски осложнений, что повышает качество данного вида хирургии в целом.
Литература
1. Barrett-Connor, E. Endogenous sex hormones and cognitive function in older men / E. Barrett-Connor, D. GoodmanGruen, B. Patay // J.Clin.Endocrinnol Metab. – 1999. – Vol.84(10). – P.3681-3685.
2. Переверзев, А.С. Смена акцентов в диагностике и лечении аденомы предстательной железы / А.С. Переверзев // Материалы Х Российского съезда урологов. – М., 2002. – С.156-157.
3. Пушкарь, Д.Ю. Андрогено-заместительная терапия и состояние предстательной железы / Д.Ю. Пушкарь, А.С. Сегал // Фарматека. – 2006. – №15. – С.62-65.
4. Пушкарь, Д.Ю. Современные возможности коррекции возрастного андрогенного дефицита у мужчин / Д.Ю. Пушкарь, А.С. Сегал // Эффективная фармакотерапия в Эндокринологии. – 2010. – №2. – С.12-19.
5. Vermeulen, A. Aging of the hypothalamopituitary-testicular axis in men / A. Vermeulen, J.M. Kaufman // Horm. Res. – 1995. – Vol.43. – P.25-32
6. Киреев А.Ю. О взаимосвязи мужской сексуальности с развитием и течением доброкачественной гиперплазии предстательной железы: дис.… канд. мед. наук. – Ростов-на-Дону, 2009. – С.93-97.
7. Коган, М.И. Сексуальность мужчины и развитие доброкачественной гиперплазии простаты / М.И. Коган, А.Ю. Киреев // Consilium Medicum. – М., 2009. – №11(7). – С.75–79.
Статья опубликована в журнале "Вестник урологии". Номер №2/2013 стр. 21-26











Комментарии