В.П. Глухов, А.В. Ильяш, В.В. Митусов, Д.В. Сизякин, М.И. Коган
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России (Ростов-на-Дону)
Протяженные стриктуры спонгиозного сегмента уретры требуют исполь- зования методик пластической хирургии. Значительная часть просвета уретры может быть успешно восстановлена в один этап, однако у пациен- тов с наиболее сложными стриктурами мочеиспускательного канала важное значение придается этапной уретропластике и постоянной уретростомии.
Стриктуры спонгиозного сегмента уретры в большей части случаев под- лежат не анастомотической, а аугментационной и заместительной уретропластике [1, 2]. Резекционные техники применимы только при коротких поражениях бульбарного сегмента уретры [3-6]. В то время как протяженные поражения бульбарного и пенильного отделов уретры требуют использования методик пластической хирургии [7-10]. Опыт показывает, что одноэтапная уретропластика на основе кожных лоскутов и буккальных трансплантатов оказывается эффективной в 80-90% случаев. Причем эта эффективность достигается исключительно в половине случаев протяженных стриктур спонгиозного сегмента уретры, а в других случаях применяются либо многоэтапные уретропластики, либо различные виды кожных уретростом [6-7]. Объяснение этим фактам видится в существовании в текущее время стриктур спонгиозной уретры, представляющих особые сложности для излечения. Играют роль и другие факторы, связанные с физическим и ментальным статусом пациентов, а также факторы социального, профессионального, семейного, сексуального порядка.
Цель исследования – определить клинические особенности стриктур спонгиозного сегмента уретры, которые не могут быть излечены одноэтапной уретропластикой, а подлежат многоэтапной хирургии либо постоянной уретростомии.
Материалы и методы
Изучены истории болезней 158 пациентов, оперированных по поводу стриктур уретры в 2010– 2019 годах. Критериями включения пациентов в исследование явилось наличие стриктур спонгиозного сегмента уретры, подвергнутых этапной уретропластике либо постоянной уретростомии. Критерии исключения: возраст моложе 18 лет, стриктуры проксимального сегмента уретры (мембранозные, простатические), стенозы уретровезикального анастомоза и шейки мочевого пузыря, ранее нелеченные врожденные аномалии (гипоспадия и эписпадия) и любые другие операции на уретре, не соответствующие критериям включения.
Клиническая оценка включала подробный анализ жалоб, анамнеза заболевания, физикального обследования, лабораторных тестов крови и мочи, данных ультразвукового исследования мочевыделительной системы, уретроцистографии и уретроцистоскопии. У пациентов с сохраненным мочеиспусканием были исследованы скорость мочеиспускания и количество остаточной мочи, для оценки тяжести симптоматики нижних мочевых путей использовали опросник IPSS, включая индекс оценки качества жизни (QoL), связанного с нарушением мочеиспускания.
Методы статистического анализа. Использованы методы расчета описательных статистик: частоты для качественных показателей, среднее, стандартное отклонение, минимальное и максимальное значения для количественных показателей. Для исследования взаимосвязей количественных показателей с качественными рассчитаны эмпирические корреляционные отношения (значимость проверена с помощью F-критерия), качественных с качественными коэффициенты взаимной сопряженности (значимость проверена с помощью критерия хиквадрат), количественных с количественными коэффициенты корреляции Пирсона (значимость проверена с помощью t-критерия). Значимость проверена на уровнях значимости 1% и 5%. Статистическая обработка результатов проведена с помощью программы «SPSS Statistics v. 17.0».
Результаты
Возраст пациентов варьировал от 18 до 88 лет и составлял в среднем 48,9±15,7 лет. В большинстве случаев это были люди молодого (18–44 года – 38,0%) и среднего (45 – 59 лет – 33,5%) возраста, примерно четверть выборки представлена пациентами пожилого возраста (60 – 74 года – 26,6%) и только 1,9% случаев заболевания приходится на лица 75 лет и старше.
Изучение этиологических факторов сужений мочеиспускательного канала выявило следующее распределение в общей совокупности: у 34,8% пациентов стриктуры имели ятрогенный генез, у 32,3% – воспалительный, у 13,9% травматический, в 19,0% случаев выяснить причину формирования стриктуры не удалось. Среди стриктур ятрогенного генеза преобладали так называемые «постгипоспадийные стриктуры» (14,6%), образовавшиеся в результате оперативной коррекции аномалии; 8,9% случаев приходилось на травму уретры, возникшую при открытых и/или эндоскопических хирургических вмешательствах по поводу гиперплазии предстательной железы. Инструментальные манипуляции и эндоскопические вмешательства на нижних и/или верхних мочевых путях явились причиной повреждения мочеиспускательного канала в 6,3% случаев. Введение в уретру агрессивных химических веществ (кислотных, щелочных, спиртосодержащих и др. растворов) привело к формированию еще
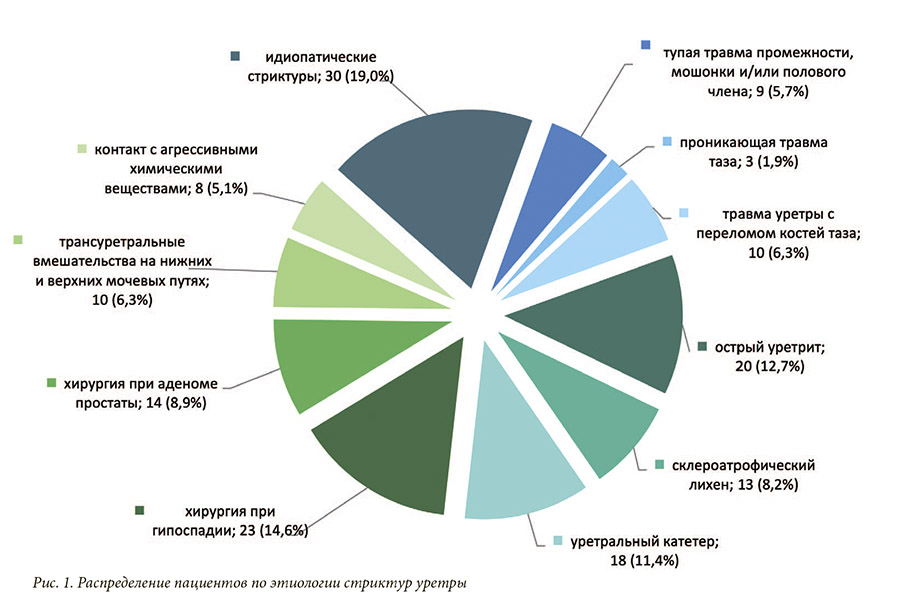
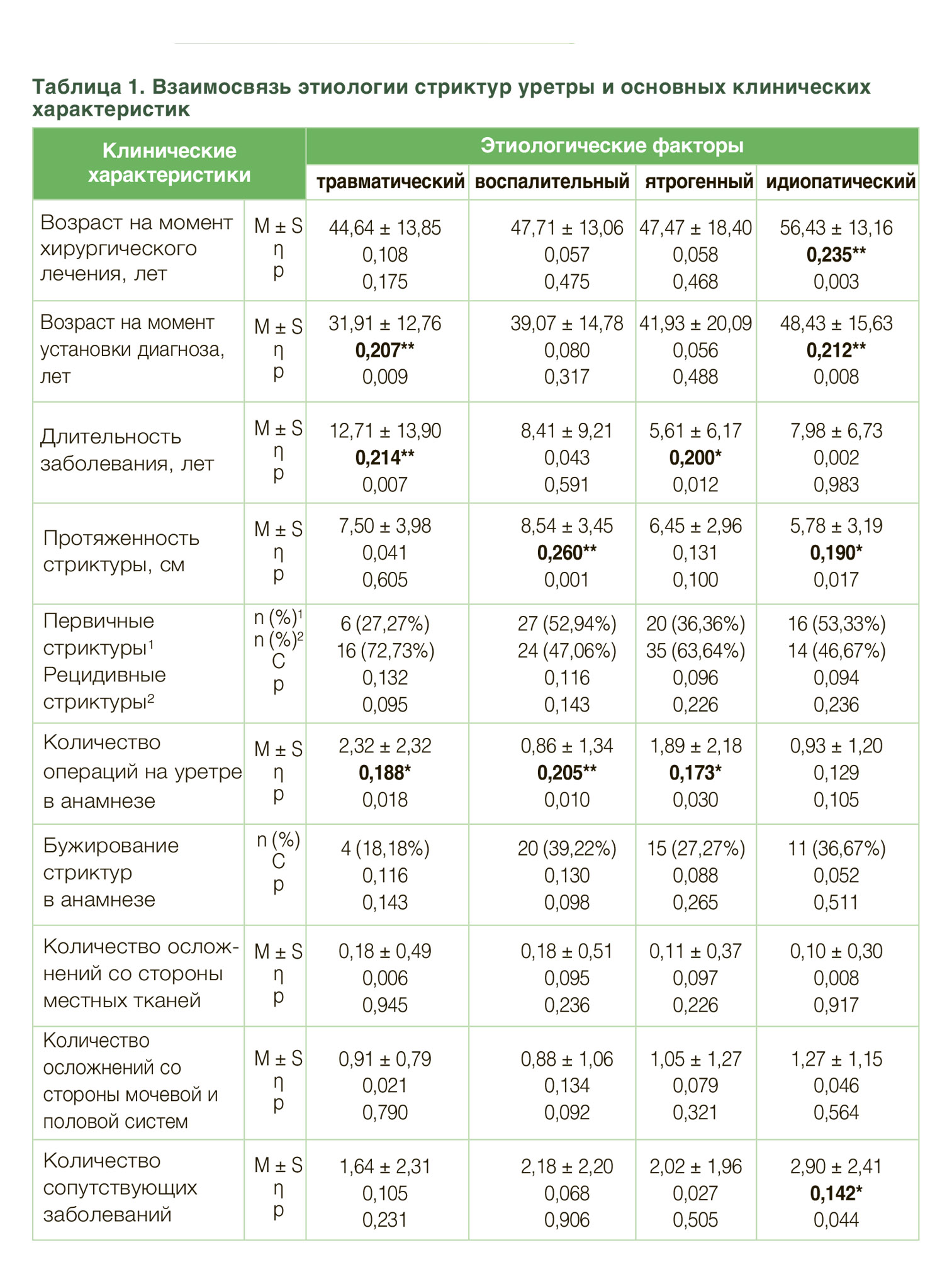
5,1% стриктур, связанных с медицинскими процедурами. Воспалительные стриктуры преимущественно являлись следствием перенесенного уретрита (12,3%) либо длительной катетеризации мочевого пузыря при неурологической соматической патологии (11,4%), в 8,2% случаев они оказались связаны с ксеротическим облитерирующим баланопоститом. Причины формирования травматических сужений мочеиспускательного канала практически в равной мере представлены дистракционным повреждением уретры при переломе костей таза и тупой травмой промежности, мошонки и/или полового члена, их доли составляют 6,3% и 5,7% соответственно. Стриктуры, связанные с открытой (проникающей) травмой таза, выявлены всего лишь у 1,9% пациентов (рис. 1). Анализ корреляционных связей позволил выявить, что травматические повреждения уретры диагностировались в более молодом возрасте в сравнении со стриктурами иного генеза (η = 0,207; p<0,01), при этом длительность заболевания данных пациентов характеризовалась наибольшим временным интервалом (η = 0,214; p<0,01) (табл. 1). Также пациенты с травматическими стриктурами имели в анамнезе большее количество неэффективных попыток хирургического лечения стриктурной болезни (η = 0,188; p<0,05) и чаще других подлежали выполнению цистостомии (С = 0,197; p<0,05), а у пациентов с сохраненным мочеиспусканием отмечалась прямая корреляционная связь с объемом остаточной мочи (η = 0,222; p<0,05). Наибольшая длина поражения мочеиспускательного канала наблюдалась при стриктурах воспалительного генеза (η = 0,260; p<0,01), тем не менее, количество неудачных попыток хирургического лечения при данной этиологии минимальное (η = 0,205; p = 0,01). У пациентов с ятрогенными стриктурами отмечалась наименьшая продолжительность заболевания (η = 0,200; p<0,05) при высоким числе неэффективных операций на уретре (η = 0,173; p<0,05), однако у большинства пациентов было со- хранено самостоятельное мочеиспускание (С=0,167; p<0,05). Идиопатические стриктуры чаще встречались у пациентов старших возрастных групп, причем эта зависимость наблюдалась как на момент выявления диагноза (η = 0,212; p<0,01), так и на момент выполнения операции (η = 0,235; p<0,01). Помимо этого, идиопатические сужения уретры отличались наименьшей протяженностью рубцового поражения в сравнении со стриктурами других этиологий (η = 0,190; p<0,05). Корреляционный анализ также позволил установить, что этиологический генез формирования стриктур уретры не оказывал значимого влияния на тяжесть симптомов нижних мочевых путей и скоростные параметры потока струи мочи.
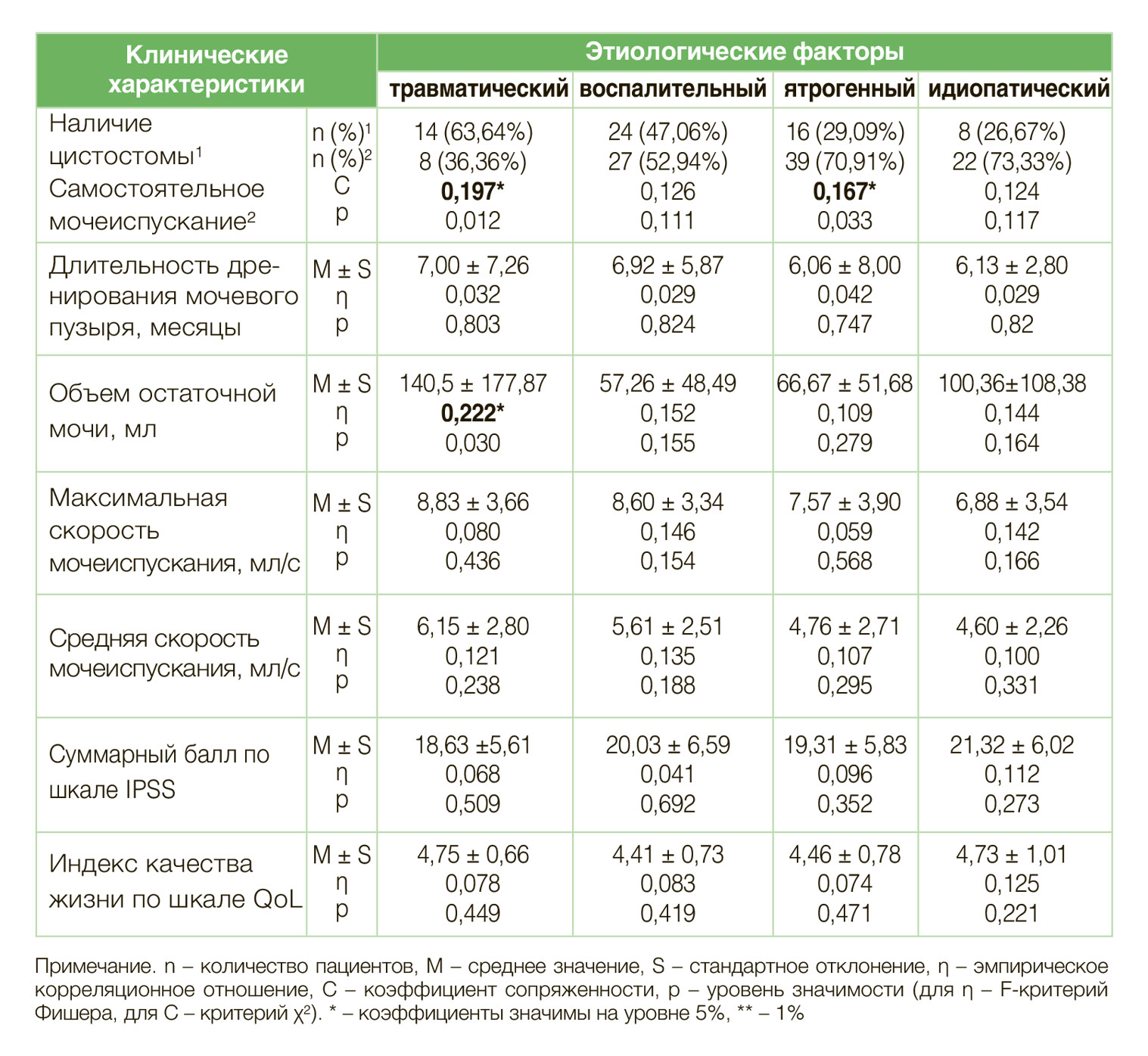
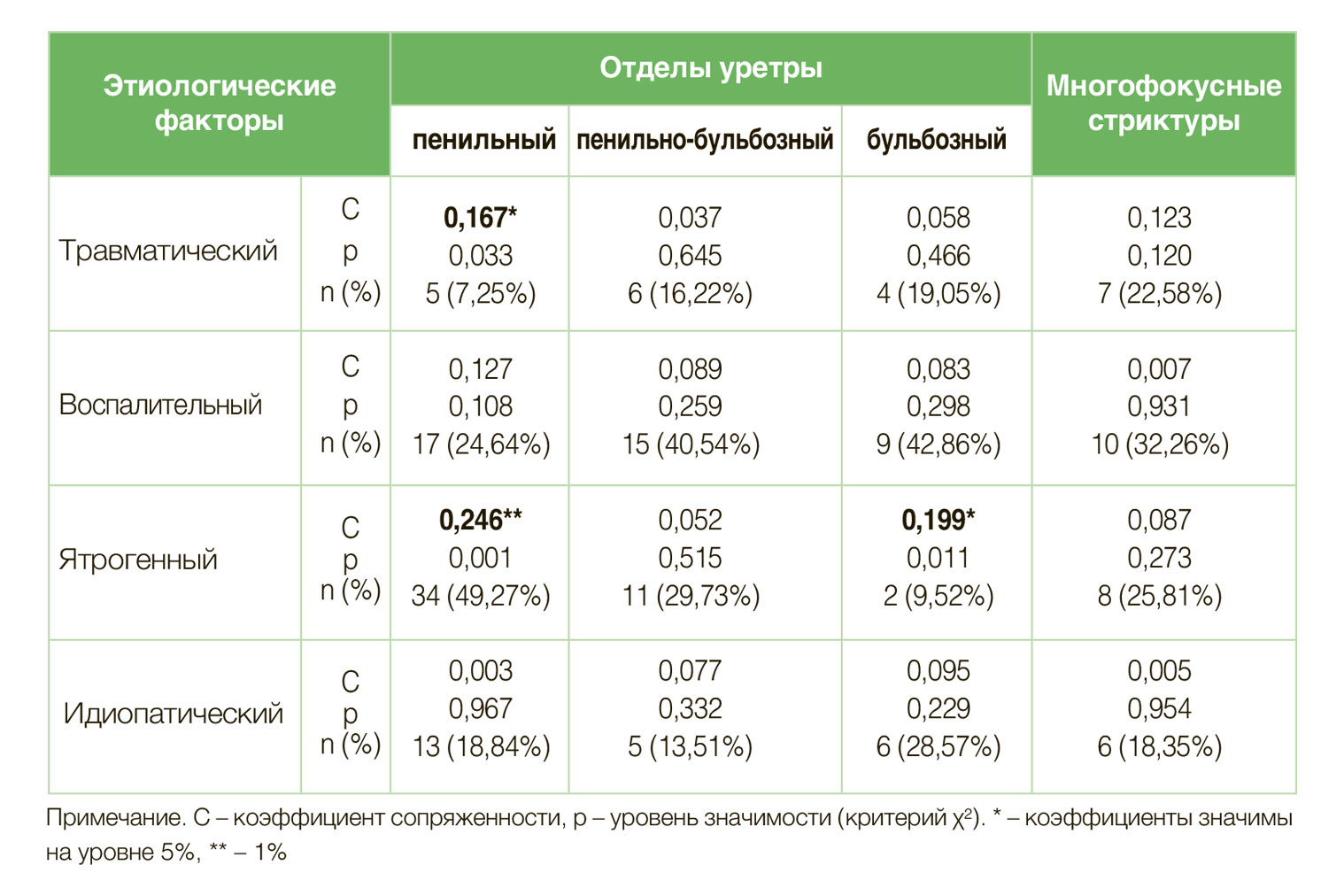
В выборке преобладали больные со стриктурами пенильной локализации (43,7%), у 23,4% пациентов наблюдалась пенильно-бульбозная локализация, у 13,3% – бульбозная. Мультилокусные поражения спонгиозного сегмента уретры диагностированы у 19,6% пациентов.
Анализ связей между локализацией и этиологией стриктур показал, что травматические стриктуры значимо реже локализовались в пенильном отделе уретры (C = 0,16; р<0,05), в сравнении со стриктурами иного этиологического генеза.
Ятрогенные стриктуры чаще поражали пенильный отдел уретры (C=0,246; р<0,01) и значимо реже локализовались в бульбозном отделе уретры (C=0,199; р<0,05). Стриктуры иной этиологии распределены по локализациям относительно равномерно (табл. 2).
Также установлено, что бульбозная локализация сужений характеризовалась наибольшим количеством осложнений стриктурной болезни со стороны мочевыделительной и половой систем (η = 0,196; p<0,05) в сравнении с поражениями уретры других локализаций. Наименьшее число осложнений имели пациенты с пенильными стриктурами (η=0,217; p<0,05). При этом длительность заболевания у пациентов со стриктурами пенильной локализации в среднем на 3 года меньше, а пенильно-бульбозной – на 3,99 года больше, чем при стриктурах иных локализаций, взятых вместе. В целом же продолжительность болезни с учетом локализации стриктуры имела следующее кумулятивное распределение: пенильные (6,3 ± 6,8 лет; η = 0,167; p<0,05), многофокусные (7,1 ± 8,3 лет; η = 0,046; p>0,05), бульбозные (9,4 ± 9,4 лет; η = 0,062; p>0,05), пенильнобульбозные (11,0 ± 11,8 лет; η=0,189; p<0,05) стриктуры. В среднем длительность заболевания составляла 8,0±6,8 (0,25–45) лет.
Большая часть пациентов ранее подвергалась реконструктивной хирургии уретры и/или инвазивным методикам паллиативного лечения. Так, различные виды оперативных вмешательств выполнены 57 (36,1%) пациентам, дилатация стриктуры посредством бужирования произведена 18 (11,4%) больным, а 32 (20,3%) пациента получили сочетанное лечение инструментальными и хирургическими методиками. Таким образом, доля рецидивных стриктур в выборке составляет 56,3% (89 пациентов).
Протяженность стриктур варьировала от 1 до 18 см и составляла в среднем 7,1 ± 3,5 см. При пенильной локализации стриктур протяженность сужений уретры составляла 5,8 ± 2,9 см, пенильно-бульбозной – 9,9 ± 3,8 см, бульбозной – 4,9 ± 1,4 см, суммарная длина мультифокусных поражений уретры в среднем равнялась 8,2 ± 2,7 см. Таким образом, бульбарные и пенильные стриктуры были значимо короче (в среднем на 2,55 см для бульбарных и 2,25 см для пе- нильных), а пенильно-бульбарные – значимо длиннее (в среднем на 3,6 см), чем стриктуры иной локализации вместе взятые. Длина поражения уретры не имела значимых корреляционных связей с возрастом пациентов (r = –0,005; p>0,05), длительностью заболевания (r = 0,132; p>0,05), числом неэффективных операций на уретре (r = –0,029; p>0,05), бужированием стриктуры (η = 0,073; p>0,05), количеством осложнений со стороны местных тканей (r= –0,010; p>0,05) и органов мочеполовой системы (r = –0,44; p>0,05). Также сопоставима протяженность первичных и рецидивных стриктур (7,3 ± 3,8 против 7,0 ± 3,1 см; η = 0,041; p>0,05). Суммарный балл по шкале IPSS у 96 (60,79%) пациентов с сохраненным мочеиспусканием изменялся от 8 до 34, составляя в среднем 19,9±6,2 баллов, индекс качества жизни по шкале QoL в среднем составил 4,5±0,8 (3 – 6) балла. По степени выраженности симптомов нарушения функции нижних мочевых путей (СНМП) пациенты имели примерно равное распределение между умеренной (46,9%) и тяжелой симптоматикой (53,1%), в то время как качество жизни, связанное с мочеиспусканием, пациенты наиболее часто расценивали как неудовлетворительное (40,6%) или плохое (37,5%). При этом степень тяжести симптомов (r = 0,238; p<0,05) и индекс качества жизни, связанный с имеющимися расстройствами мочеиспускания (r = 0,385; p<0,001), увеличивались с возрастом пациентов.
Скоростные параметры мочеиспускания характеризовались сниженными показателями: максимальная скорость потока мочи составляла 7,8 ± 3,7 (1,2 – 16,5) мл/с, средняя – 5,1 ± 2,6 (0,9 – 12,3) мл/с. Максимальная скорость мочеиспускания надежно коррелировала со степенью тяжести СНМП (r = – 0,771; p<0,001) и качеством жизни, связанным с мочеиспусканием (r = –0,677; p<0,001). Также установлено, что скорость потока струи мочи зависела от возраста пациентов. Так, для пациентов молодого возраста ее среднее значение составляло 8,5 мл/с, а в группе пациентов пожилого возраста – 6,6 мл/с. Не выявлено достоверной связи между скоростью мочеиспускания и протяженностью стриктуры, однако отчетливо прослеживалась тенденция уменьшения скорости при увеличении длины поражения уретры (r = –0,039; p>0,05). Скоростные параметры мочеиспускания сопоставимы у пациентов с первичными и рецидивными стриктурами (η = 0,084; p>0,05) и не зависели от длительности заболевания (r = –0,125; p>0,05), количества осложнений со стороны местных тканей (r = –0,162; p>0,05) и органов мочеполовой системы (r = 0,181; p>0,05), бужирования стриктуры (η = 0,104; p>0,05), числа неэффективных операций на уретре (r = 0,125; p>0,05).
Объем остаточной мочи имел высокую вариацию и изменялся от 5 до 490 мл. В среднем в общей группе пациентов он составлял 77,9 ± 85,5 мл и у 50 (52,1%) обследуемых превышал 50 мл. Он надежно коррелировал с возрастом пациентов (r = 0,222; p<0,05), длительностью заболевания (r = 0,390; p<0,001), максимальной и средней скоростью потока струи мочи (Q max: r = –0,376; p<0,001; Q ave: r = –0,359; p<0,001), тяжестью СНМП (r = 0,329; p<0,01) и качеством жизни, связанным с расстройствами мочеиспускания (r = 0,489; p<0,001).
Более чем у трети больных на момент госпитализации имелся цистостомический дренаж (62 пациента (39,2%)). Средняя продолжительность дренирования мочевого пузыря составляла 6,6 ± 4,5 месяцев с вариацией от месяца до 3 лет. У половины пациентов цистостома существовала более 5 месяцев. Чаще всего выполнению цистостомии подвергались пациенты с стриктурами бульбозного отдела уретры (57,1%), также в данной группе отмечена наибольшая длительность такой деривации (7,3 ± 4,0 месяцев). Наименьшее количество цистостом имели пациенты с локализацией стриктур в пенильном отделе (21,7%) при длительности дренирования 6,6 ± 8,1 месяцев. Значительно реже выполнению цистостомии подлежали больные, подвергавшиеся бужированию уретры (С=0,215; p<0,01). Пациенты с первичными и рецидивными стриктурами имели сопоставимое число цистостом (53,2 против 46,8%; p>0,05), а необходимость дренирования мочевого пузыря не зависела от наличия в анамнезе хирургического лечения (С = 0,139; p>0,05) и количества перенесенных операций (η = 0,110; p>0,05). Помимо этого, установлено, что дренирование мочевого пузыря не связано с возрастом пациентов (η = 0,054; p>0,05), длительностью заболевания (η = 0,088; p>0,05), протяженностью стриктур (η = 0,125; p>0,05), осложнениями стриктурной болезни со стороны местных тканей (η = 0,058; p>0,05) и органов мочеполовой систем (η = 0,087; p>0,05).
Осложнения стриктурной болезни со стороны органов мочевой и половой систем диагностированы у 97 (61,3%) пациентов. При этом в 18 (11,4%) случаях заболевание отягощено выраженными инфекционно-воспалительными инфильтратами местных тканей, грубыми рубцовыми изменениями кожи полового члена, приводящими к его деформации, наличием уретральных свищей и камнями надстриктурного отдела уретры, которые встречались как изолированно, так и в сочетании друг с другом. Сопутствующие хронические заболевания обнаружены более чем у половины обследуемых (120 (75,9%) пациентов). В выборке зарегистрировано 345 случая хронических заболеваний по 67 нозологиям.
Обсуждение
Несмотря на прогресс, достигнутый в реконструктивной хирургии уретры за последние 20 лет и, принимая во внимание тот факт, что значительная часть стриктур спонгиозного сегмента уретры может быть успешно восстановлена в один этап, важная роль этапной уретропластики и постоянной уретростомии сохраняется у пациентов с наиболее сложными стриктурами мочеиспускательного канала. В настоящее время реализуется стремление к одностадийному оперативному лечению, но данный подход может иметь крайне высокий риск развития рецидива у пациентов с протяженными стриктурами и тяжелым спонгиофиброзом после ранее перенесенного хирургического вмешательства [11]. Также низкая эффективность одностадийных методик может иметь место у пациентов со стриктурами, связанными с предшествующей коррекцией гипоспадии. В исследовании A. Mehrsai и соавт. показано, что каждый десятый пациент имеет хотя бы один осложняющий фактор, который исключает выполнение одноэтапного подхода. Прежде всего, это наличие выраженных изменений местных тканей, таких как: массивный спонгиофиброз как последствие lichen sclerosis; рубцовое изменение окружающих тканей как результат предшествующих неудачных операций, в том числе и по поводу гипоспадии в детстве; уретрокожные свищи; протяженные облитерации уретры; абсцесс и инфекция парауретральных тканей [12].
Современными показаниями к многоэтапной уретропластике являются: поражение уретры рубцовым процессом с тотальным спонгиофиброзом в этой зоне, исключающим возможность одноэтапного оперативного вмешательства; протяженная облитерация уретры в пенильном отделе; стриктура уретры вследствие ранее перенесенных оперативных вмешательств на мочеиспускательном канале (преимущественно по поводу гипоспадии), приведших к выраженному рубцовому поражению окружающих тканей; отсутствие части уретры как результат предшествующих операций; поражение уретры вследствие облитерирующего ксеротического баланита [13].
Постоянная уретростомия в литературе последнего десятилетия также все чаще обсуждается в контексте рационального выбора для лечения мужчин с протяженными (пануретральными), рецидивными стриктурами передней уретры, а также пациентов с распространенным склероатрофическим лихеном и стриктурами, сформировавшимися вследствие неудачных исходов хирургического вмешательства при гипоспадии, хотя еще недавно она считалась операцией, приемлемой только для людей пожилого возраста и/или пациентов с сопутствующими заболеваниями, исключающими длительную анестезию, а также традиционно рассматривалась как операция, применяемая в случаях, когда исчерпаны другие возможности реконструктивно-восстановительной хирургии уретры [14–18].
Анализ клинического статуса пациентов, включенных в настоящее исследование, наглядно подтверждает тяжесть стриктурной болезни у данной категории больных. В большинстве случаев, помимо симптомов нарушенного мочеиспускания, болезнь сопровождается различными осложнениями как со стороны местных тканей, так и органов мочевыделительной и половой систем, а в анамнезе имеет место сопутствующая хроническая патология сердечнососудистой, эндокринной, пищеварительной, нервной, опорнодвигательной, дыхательной и других систем и органов. При этом в 71,5% случаев это люди молодого и среднего возраста. Протяженность стриктур у половины пациентов превышает 6 см, четверть выборки имеет субтотальное и тотальное поражение спонгиозной уретры. В структуре этиологических факторов формирования стриктур спонгиозного сегмента уретры преобладают ятрогенные и воспалительные повреждения мочеиспускательного канала при наиболее часто встречающейся пенильной локализации сужений. У 19,6% пациентов диагностируются многофокусные поражения спонгиозной уретры. Доля рецидивных стриктур составляет 56,3%, а средняя продолжительность заболевания стриктурной болезнью достигает 8 лет.
Наше исследование также позволило установить, что отдельные характеристики заболевания находятся в определенной зависимости и могут оказывать как прямое, так и обратное влияние друг на друга. При этом известно, что многие из них являются ориентиром в выборе метода лечения стриктур и факторами риска, предсказывающими возможный неблагоприятный исход хирургии. Большинство пациентов выборки обладают набором клинических характеристик, сочетающим в себе как условно благоприятные, так и отягощающие факторы прогноза стриктурной болезни. Таким образом, возникает необходимость в разработке стандартизированной системы оценки сложности стриктуры, позволяющей на дооперационном этапе произвести ее всестороннюю обобщающую характеристику с учетом основных качественных и количественных параметров и служащей ориентиром при принятии клинических решений.
Выводы
Клиническая оценка пациентов со стриктурами спонгиозной уретры, подлежащих многоэтапной уретропластике или постоянной уретростомии, выявляет особую тяжесть стриктурной болезни. Пациенты данной категории имеют высокие риски неудачных исходов при одноэтапной хирургии. В этих случаях пациентам требуется поэтапный подход в лечении стриктур уретры или выполнение постоянной уретростомии.
Источники:
- Kulkarni SB, Joglekar OV, Alkandari M, Joshi PM. Algorithm for the management of anterior urethral strictures. Turk J Urol 2018;44(3):195-7. https://doi.org/10.5152/tud.2018.76429.
- Коган М.И., Красулин В.В., Митусов В.В., Шангичев А.В., Глухов В.П., Наранов С.В. Оперативное лечение стриктур и облитераций уретры. Урология 2015(2):17-23. [Kogan M.I., Krasulin V.V., Mitusov V.V., Shangichev A.V., Glukhov V.P., Naranov S.V. Surgical treatment of strictures or obliterations of urethra. Urologiya = Urologiia 2015(2):17-23. (In Russian)].
- Morey AF, Watkin N, Shenfeld O, Eltahawy E, Giudice C. SIU/ICUD Consultation on urethral strictures: anterior urethra-primary anastomosis. Urology 2014;83(3 Suppl):S23-6. https://doi.org/10.1016/ j.urology.2013.11.007.
- ГончаровН.А., Кузнецов А.А., Морозов Е.А., Киселева А.А. Результаты хирургического лечения непротяженных стриктур бульбозного отдела уретры. Вестник урологии 2021;9(1):32-8. [Goncharov N.А., Kuznetsov A.A., Morozov E.A., Kiseleva A.A. Results of surgical treatment on short-length bulbous urethral strictures. Vestnik Urologii = Urology Herald 2021;9(1):32-3. (In Russian)]. https://doi.org/10.21886/2308-6424-2021-9-1-32-38.
- ГлуховВ.П., Красулин В.В. Резекция уретры с концевым анастомозом при хирургическом лечении осложненных стриктур уретры у мужчин. Кубанский научный медицинский вестник 2009;4(109):78-82. [Glukhov V.P., Krasulin V.V. Urethral resection with end-to-end anastomosis as a treatment option for complicated urethral strictures. Kubanskiy nauchnyy meditsinskiy vestnik = Kuban Scientific Medical Bulletin 2009; 4(109):78-82. (In Russian)].
- Синельников Л.М., Протощак В.В., Шестаев А.Ю., Карпущенко Е.Г., Янцев А.А. Стриктура уретры: современное состояние проблемы (обзор литературы). Экспериментальная и клиническая урология 2016;9(2):80-7. [Sinel'nikovL.M., ProtoschakV.V.,ShestaevA.Yu.,KarpuschenkoE.G., YancevA.A. Urethralstricture: modernstateoftheproblem. Literature review. Experimentalnaya i klinicheskaya urologiya = Experi- mental and Сlinical Urology 2016;9(2):80-7. (In Russian)].
- Fuehner C, Dahlem R, Fisch M, Vetterlein MW. Update on managing anterior urethral strictures. Indian J Urol 2019;35(2):94-100. https://doi.org/10.4103/iju.IJU_52_19.
- RobineE, Rigaud J, Luyckx F, Le Clerc QC, Madec FX, Bouchot O, Branchereau J. Analyse des taux de succès des urétroplasties pour sténoses de l’urètre bulbaire chez l’homme adulte: revue systématique de la littérature [Analy- sis of success rates of uretroplasty for adult male bulbar urethral stricture: A systematic review]. Prog Urol 2017;27(2):49-57. (In French). https://doi.org/10.1016/j.purol.2016.12.003.
- Коган М.И., Глухов В.П., Митусов В.В., Красулин В.В., Ильяш А.В. Сравнительный анализ одно- и двухэтапной аугментационной дорсальной inlay-пластики буккальным графтом протяженных стриктур спонгиозной уретры. Урология 2018;(1):84-90. [Kogan M.I., Glukhov V.P., Mitusov V.V., Krasulin V.V., Il'yash A.V. Comparative analysis of one- and two-stage augmentation urethroplasty with dorsal inlay buccal graft for extended strictures of spongious urethra. Urologiya = Urologiia 2018;(1):84-90. (In Russian)]. https://doi.org/10.18565/urology.2018.1.84-90
- КотовС.В. Стриктуры уретры у мужчин − современное состояние проблемы. Медицинскийвестник Башкортостана 2015;10(3):266-70. [S.V. Kotov. Male urethral strictures − current state of the problem. Medicinskij vestnik Bashkortostana = Bashkortostan Medical Journal 2015;10(3):266-70. (In Russian)].
- Campos-JuanateyF,Bugeja S, Dragova M, Frost AV, Ivaz SL, Andrich DE, Mundy AR. Single-stage tubular urethral reconstruction using oral grafts is an alternative to classical staged approach for selected penile urethral strictures. Asian J Androl 2020;22(2):134-9. https://doi.org/10.4103/aja.aja_78_19.
- Mehrsai A, Djaladat H, Salem S, Jahangiri R, Pourmand G. Outcome of buccal mucosal graft urethroplasty for long and repeated stricture repair. Urology 2007;69(1):17-21; discussion 21. https://doi.org/10.1016/j.urology.2006.09.069.
- КотовС.В.Результаты многогоэтапной (заместительной) уретропластики. Экспериментальная и клиническая урология 2015;8(4):60-6. [KotovS.V.Outcomesofmultistage(substitutions) urethroplasty.Experimentalnaya i klinicheskaya urologiya = Experimental and Clinical Uurology 2015;8(4):60-6. (In Russian)].
- WessellsH,Angermeier KW, Elliott S, Gonzalez CM, Kodama R, Peterson AC, Reston J, Rourke K, Stoffel JT, Vanni AJ, Voelzke BB, Zhao L, Santucci RA. Male Urethral Stricture: American Urological Association Guideline. J Urol 2017;197(1):182-90. https://doi.org/10.1016/j.juro.2016.07.087.
- Murphy GP, Fergus KB, Gaither TW, Baradaran N, Voelzke BB, Myers JB, Erickson BA, Elliott SP, Alsikafi NF, Vanni AJ, Buckley JC, Breyer BN. Urinary and sexual function after perineal urethrostomy for urethral stricture disease: an analysis from the TURNS. J Urol 2019;201(5):956-61. https://doi.org/10.1097/JU.0000000000000027.
- Bullock TL, Brandes SB. Adult anterior urethral strictures: a national practice patterns survey of board certified urologists in the United States. J Urol 2007;177(2):685-90. https://doi.org/10.1016/j.juro.2006.09.052.
- BarbagliG, De Angelis M, Romano G, Lazzeri M. Clinical outcome and quality of life assessment in patients treated with perineal urethrostomy for anterior urethral stricture disease. J Urol 2009;182(2):548-57. https://doi.org/10.1016/j.juro.2009.04.012.
- Lumen N, Beysens M, Van Praet C, Decaestecker K, Spinoit AF, Hoebeke P, Oosterlinck W. Perineal urethrostomy: surgical and functional evaluation of two techniques. Biomed Res Int 2015;2015:365715. https://doi.org/10.1155/2015/365715.









Комментарии