- Шкодкин С.В. – д.м.н. доцент, профессор кафедры госпитальной хирургии Медицинского института ФГАОУ ВО «Белгородский государственный национальный исследовательский университет», врач уролог урологического отделения ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа»; Белгород, Россия; РИНЦ AuthorID 482598
- Полищук А.В. – ассистент кафедры госпитальной хирургии Медицинского института ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», уролог медицинского центра «Клиники Фомина»; Белгород, Россия; РИНЦ AuthorID 1069331
- Чирков С.В. – аспирант кафедры госпитальной хирургии Медицинского института ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», уролог поликлиника №3 ОГБУЗ «Старооскольская окружная больница Святителя Луки Крымского»; Белгород, Россия
- Чурикова О.В. – соискатель кафедры госпитальной хирургии Медицинского института ФГАОУ ВО «Белгородский государственный национальный исследовательский университет», врач-уролог медицинского центра ООО «Промедика»; Белгород, Россия
- Кравцова Н.А. – врач-уролог медицинского центра «Энергия жизни»; Белгород, Россия
ВВЕДЕНИЕ
Естественный рост населения Земли и увеличение продолжительности жизни ведут к росту в популяции мужчин старшей возрастной группы, что делает проблему симптомов нарушенного мочеиспускания (СНМ) социально значимой [1]. Затраты на медикаментозную терапию в долгосрочной перспективе крайне велики, а используемые в настоящее время медикаментозные препараты, а тем более хирургические опции не лишены побочных эффектов и осложнений [2]. Это является причиной продолжающихся исследований по поиску альтернативных вариантов медикаментозной терапии [2].
Цель исследования: оценить эффективность и безопасность препарата Диунорм® капсулы, в профилактике и лечении нарушенного мочеиспускания у мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
Данное клиническое исследование проведено как проспективное сравнительное наблюдательное когортное на 57 мужчинах с жалобами на СНМ. Пациенты рандомизированы по приему препарата для терапии СНМ. Основную группу наблюдения составили 42 первичных пациента в возрасте от 41 до 67 лет (51,4±7,9 года), для терапии у которых был использован препарат Диунорм® на регулярной основе по одной капсуле (400 мг) 1 раз в день. В контрольную группу вошли 15 пациентов в возрасте от 50 до 64 лет (58,4±3,9 года), в качестве инициальной терапии которым был назначен оригинальный Тамсулозин 0,4 мг 1 раз в сутки в соответствии с существующей рутинной клинической практикой. Длительность наблюдения в обеих группах составила 90 дней. В данное исследование пациенты включены по следующим критериям: объем предстательной железы до 50 см3; объем остаточной мочи менее 50 мл; максимальный поток по урофлоурограмме более 10 мл/сек; интравезикальная простатическая протрузия менее 10 мм; суммарный балл по IPSS 8-25 баллов; ПСА менее 4 нг/мл; отсутствие воспалительных изменений в анализе мочи и отрицательная урокультура.
Критериями исключения на момент 1 визита стали: трудовой распорядок с постоянной или периодической работой в ночное время; получаемая ранее терапия СНМ; необходимость оперативного лечения или применение любого другого вида неотложного лечения интеркуррентных заболеваний с целью предотвращения прогрессирования заболевания и нанесения вреда здоровью пациента; отсутствие ноктурии среди СНМ, предъявляемых пациентом; регулярный прием лекарственных средств, приводящих к изменению параметров мочеиспускания в течение периода исследования или изменению исследуемых показателей за исключением альфа-1-адреноблокаторов (АБ); перенесенные операции на предстательной железе или мочеиспускательном канале; наличие опухоли мочевого пузыря сейчас или в анамнезе; хронический алкоголизм или наркомания; психические заболевания; острая или хроническая почечная недостаточность любой степени выраженности; гиперчувствительность к любому из компонентов исследуемого препарата; нарушение пациентом протокола исследования. Все пациенты на момент включения в исследование подписали информированное согласие.
На первичном визите и до включения в исследование, помимо сбора анамнеза и физикального осмотра, больные заполняли шкалы опросники: Международная система суммарной оценки заболеваний предстательной железы (International Prostate Symptom Score, IPSS), Международный индекс эректильной функции (The international index of erectile function, IIEF-5), дневник мочеиспускания, который пациент вел в течение 3-х суток. Среди лабораторных методов использованы анализ мочи по Нечипоренко, бактериология мочи и определение уровня общего простатспецифического антигена (ПСА). Инструментальная диагностика включала выполнение урофлоуметрии и ультразвукового исследования (УЗИ) мочевого пузыря из трансабдоминального и предстательной железы из ректального доступа. При УЗИ регистрировали исходный объем (мл) и толщину передней стенки мочевого пузыря (мм), объем остаточной мочи (см3), объем предстательной железы (см3) и величину интравезикальной простатической протрузии (мм). Аналогичный лабораторноинструментальный контроль проведен на сроках 45 и 90 суток.
В настоящем исследовании изучена эффективность препарата Диунорм®, который представляет собой натуральный комплекс природного происхождения. Стандартная капсула 400 мг содержит: Каланхоэ перистого (Bryophyllum pinnatum) экстракт – 120 мг, Валерианы лекарственной экстракт (Valeriana officinalis L.) – 160 мг, Солодки голой экстракт (Glycyrrhizia glabra) – 120 мг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трое пациентов контрольной группы на сроках 14-е, 21-е и 45-е сутки отказались от приема тамсулозина в связи с эякуляторными расстройствами, что составило 20% от исходно включенных в исследование. Дальнейший анализ проведен для 12 пациентов контроля, закончивших исследование. Все 42 пациента основной группы наблюдения остались комплаентны на протяжении всего периода наблюдения (р<0,01). У пациентов обеих групп наблюдения не отмечено как манифестации симптоматической инфекции мочевыводящих путей, так и бессимптомной бактериурии, что потребовало бы коррекции терапии и исключения из протокола. Также не было отмечено существенной динамики по уровню ПСА, что, видимо, исключает влияние исследуемого препарата на метаболизм тестостерона. Однако для окончательного вывода стоит увеличить сроки наблюдения в основной группе до 12 месяцев.
Консервативная терапия СНМ в обеих группах сопровождалась субъективным снижением симптоматики согласно суммарному баллу по шкале IPSS. Так, в основной группе наблюдения данный показатель составил 16,3±1,4, 11,6±1,5 и 7,2±0,8 балла на 0, 45 и 90 сутки исследования, соответственно. Таким образом, отмечено его снижение на 28,4±11,6% и 55,2±6,2% относительно исходного значения (р<0,0001) (рис. 1). Суммарный балл по шкале IPSS в группе контроля на аналогичных сроках наблюдения: 19,4±4,1, 16,1±3,6 и 12,3±5,6 балла. Это обеспечило следующие проценты снижения: 16,8±8,8% и 40,3±15,7% соответственно (р<0,0001) (рис. 1). И хотя относительные скорости снижения суммарного балла по шкале IPSS в группах наблюдения достоверно не различались, абсолютный показатель по шкале IPSS к выходу из эксперимента был ниже в основной группе наблюдения, составив 7,2±0,8 балла против 12,3±5,6 балла в контроле (р<0,05) (рис. 1). Однако полученные нами данные могут быть связаны с исходно более низким значением IPSS в основной группе наблюдения и эффектом малой выборки, что требует дополнительного набора пациентов и повторного анализа по анализируемому показателю
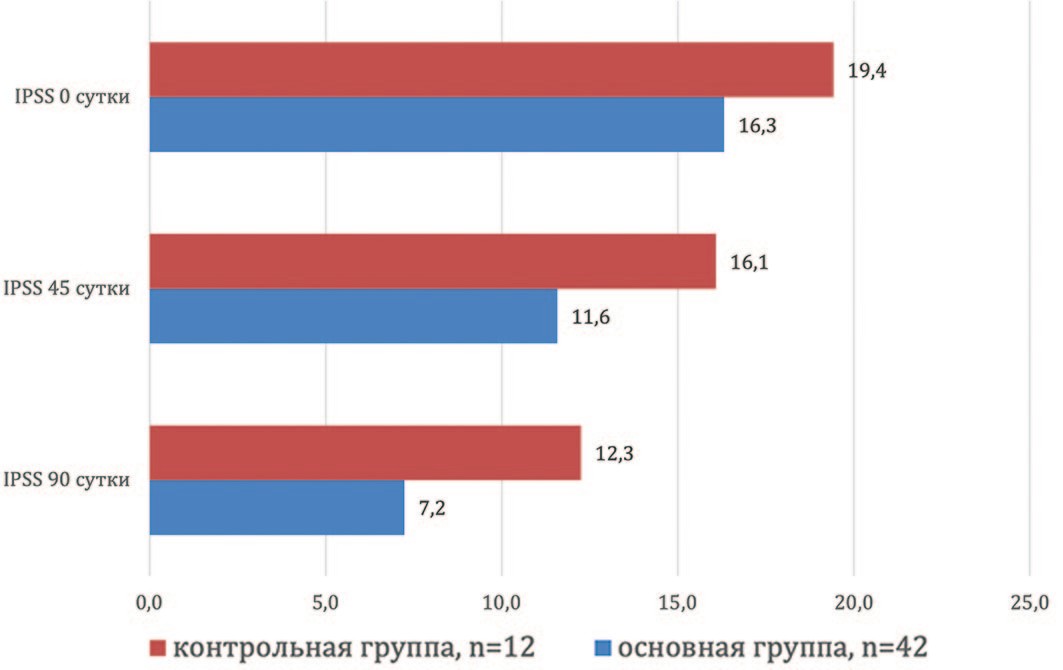
Рис. 1. Динамика снижения суммарного балла по шкале IPSS в группах наблюдения.
Fig. 1 The dynamics of the decrease in the total score on the IPSS scale in the observation groups.
Еще одним из положительных моментов, с нашей точки зрения, является прогрессивное снижение частоты ноктурии в основной группе наблюдения на протяжении всего исследования. Средняя частота ночных мочеиспусканий при включении в исследование в этой группе составила 2,5±0,8 за ночь, через 1,5 месяца данный показатель уменьшился на 46,6±33,1% до 1,3±0,8 (р=0,0039) (рис. 2). Через 3 месяца приема Диунорма частота ночных мочеиспусканий относительно исходных значений уменьшилась на 68,5±23,5% до 0,7±0,5 (р=0,0001) (рис. 2). Подобная динамика имела место и у пациентов, принимающих тамсулозин. Частота ночных мочеиспусканий при контрольных обследованиях на 45-е и 90-е сутки снизилась на 36,1±24,5% и 49,3±33,0%, соответственно (р<0,001) (рис. 2), хотя механизмы воздействия на ноктурию у используемых препаратов различны, что мы попытаемся обсудить ниже.
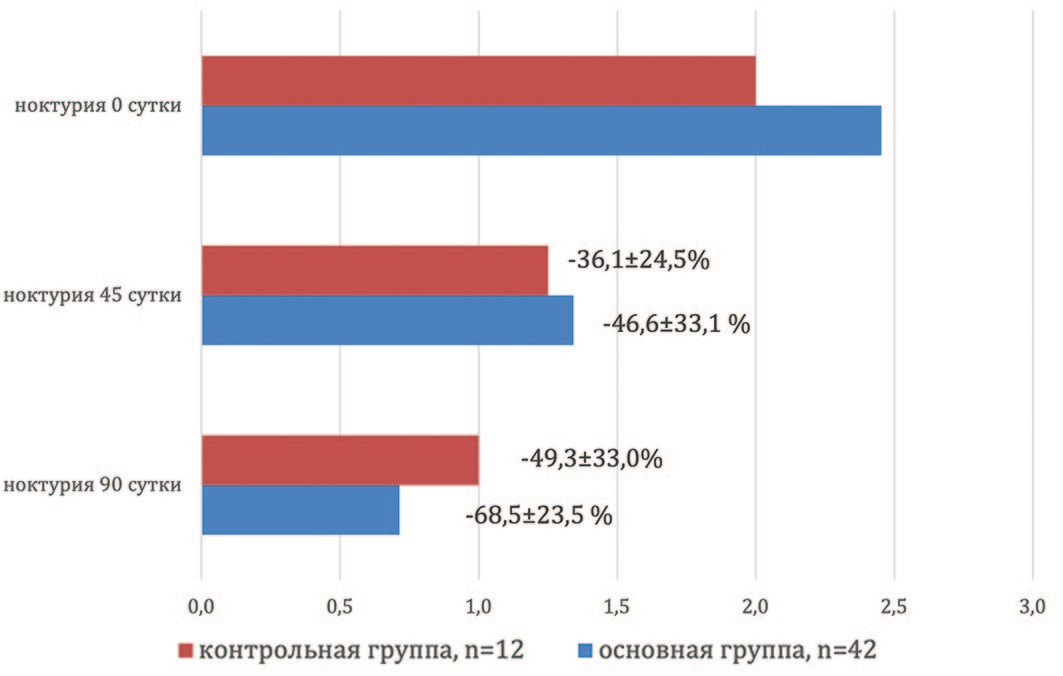
Рис. 2. Динамика ноктурии в группах наблюдения
Fig. 2. Dynamics of nocturia in observation groups
Стоит отметить, что сонографические показатели в обеих исследуемых группах не претерпели статистически достоверных колебаний за весь период наблюдения. Объем предстательной железы в основной группе на контрольных точках исследования составил 41,5±4,1 см3, 40,2±3,9 см3 и 38,7±4,2 см3 и не отличался от аналогичного показателя в контроле – 45,0±6,7 см3, 41,1±4,4 см3 и 40,0±4,0 см3 (р>0,05). Однако стоит остановиться на некоторых тенденциях. Так, в основной группе отмечен статистически недостоверный рост емкости мочевого пузыря с 299,3±64,5 мл при обращении пациента за помощью до 356,7±68,1 мл через 3 месяца терапии, что в среднем составило 31,1±19,4%. При этом в основной группе наблюдения не зарегистрировано роста объема остаточной мочи и снижения урофлоуметрических показателей, что говорит об отсутствии влияния «Диунорма» на контрактильную функцию детрузора. Более того, применительно к объему остаточной мочи для основной группы получено недостоверное снижение показателя, который составил на 0-ые, 45-е и 90-е сутки 29,5±9,8 мл, 21,0±9,2 мл и 12,7±7,7 мл, чего не наблюдалось в контроле 46,9±12,4 мл, 37,5±16,7 мл и 29,2±17,4 мл соответственно (р<0,05). А для максимального потока зарегистрирован достоверный рост у пациентов, принимавших Диунорм, что составило 13,4±0,7 мл/сек, 15,2±0,9 мл/сек и 16,9±0,7 мл/сек на контрольных точках. Таким образом, максимальная скорость мочеиспускания в основной группе увеличилась на 1,8 и 3,5 мл/сек через 1,5 и 3 месяца соответственно. Общий рост за весь период наблюдения в среднем составил 29,3±21,0% (р<0,001) (рис. 3).
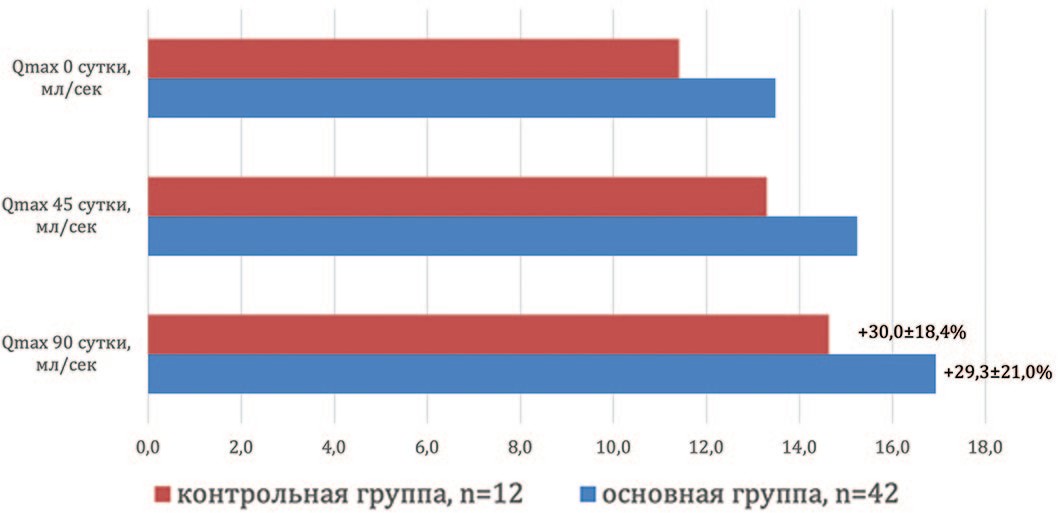
Рис.3. Динамика увеличения максимальной скорости потока мочи Qmax в группах наблюдения
Fig. 3. The dynamics of the increase in the maximum flow Qmax in the observation groups
Анализ опросника IIEF-5 не выявил какой-либо динамики в группах наблюдения на протяжении 3 месяцев (p>0,05). Однако при оценке эякуляторной функции в контрольной группе еще 4 пациента пожаловались на анэякуляцию. Таким образом, с тремя пациентами, покинувшими исследование по этим же причинам, частота расстройств эякуляции на фоне приема тамсулозина составила 46,7%, что достоверно больше, чем в основной группе наблюдения (р<0,0001), при этом в 42,9% из них это стало причиной отказа от приема препарата.
Рандомизация в протоколе проводилась по желанию пациента после ознакомления с возможными вариантами лечения. Обращает внимание тот факт, что, несмотря на ограничительные по возрасту критерии включения, в основную группу вошла более молодая часть пациентов 51,4±7,9 лет против 58,4±3,9 лет в контроле. И хотя различия не являются статистически достоверными (р>0,05), можно заключить, что «молодые» пациенты не спешат прибегнуть к всесторонне исследованному фармакологическому препарату взамен на средство растительного происхождения.
В нашем исследовании в основной группе наблюдения отмечена более выраженная, хотя статистически не достоверная, тенденция по купированию ноктурии по сравнению с контролем (рис. 2).
Естественно, окончательные выводы о возможных преимуществах терапии препаратом Диунорм будет возможно сделать при увеличении числа наблюдений. Однако на этом этапе мы склонны ассоциировать положительное влияние на ноктурию не только с воздействием на гладкую мускулатуру детрузора за счет блокады М3-холинорецепторов и прямым миорелаксирующим действием, что показано в исследованиях [3-5] по экстракту Каланхоэ перистого (Bryophyllum pinnatum). Частота ночных микций может быть снижена вследствие нормализации сна и снижении диуретического эффекта. В ряде исследований было показано, что экстракт Валерианы (Valeriana officinalis L.), включающий масла изовалериановой и валериановой кислот и тритерпеновые гликозиды, способен улучшать высвобождение и нарушать обратный нейрональный захват гамма-аминомасляной кислоты (ГАМК) [6], а также выступать агонистом серотониновых и аденозиновых рецепторов в центральной нервной системе [7, 8]. Это способствует нормализации сна, снижая вероятность спонтанных пробуждений [9, 10]. Экстракт Солодки голой (Glycyrrhiza glabra) в качестве действующих веществ содержит глицирризиновую кислоту, бета-ситостерин, ликвиритин, ликохалкон А, у которых описаны минералокортикоидные эффекты и повышение секреции Na-уретического пептида [11, 12]. Это достоверно снижает экскрецию воды и натрия из организма [13].
Вышеописанные механизмы реализуют также снижение симптоматики по шкале IPSS. Достаточно позитивным моментом можно считать увеличение максимальной скорости потока мочи на фоне увеличения емкости мочевого пузыря в основной группе наблюдения, что, как уже отмечали выше, говорит о сохранности сократительной функции детрузора.
ВЫВОДЫ
Комплекс Диунорм достоверно и сопоставимо с альфа-блокатором тамсулозином снижает выраженность СНМ и частоту ноктурии у первичных молодых пациентов, не вызывая при этом эякуляторных расстройств. Мы не призываем экстраполировать полученные результаты на всех мужчин с СНМ, однако, в группе «молодых» пациентов с наличием ноктурии и желанием избежать анэякуляции данный подход может быть эффективным инструментом коррекции расстройств мочеиспускания.
ЛИТЕРАТУРА
- Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;(380):2163-96. https://doi.org/10.1016/S0140-6736(12)61729-2.
- Dahm P, Brasure M, MacDonald R, Olson CM, Nelson VA, Fink HA, Rwabasonga B, Risk MC, Wilt TJ. Comparative Effectiveness of Newer Medications for Lower Urinary Tract Symptoms Attributed to Benign Prostatic Hyperplasia: A Systematic Review and Meta-analysis. Eur Urol 2017 Apr;71(4):570-581. https://doi.org/10.1016/j.eururo.2016.09.032.
- Schuler V, et al. Bryophyllum pinnatum inhibits detrusor contractility in porcine bladder strips – A pharmacological study towards a new treatment option of overactive bladder. Phytomedicine 2012;19(10):947–951.
- Fürer K, et al. Inhibition of porcine detrusor contractility by the flavonoid fraction of Bryophyllum pinnatum – A potential phytotherapeutic drug for the treatment of the overactive bladder syndrome. Phytomedicine 2015;22(1):158–164.
- Bachmann S., et al. Potential of Bryophyllum pinnatum as a Detrusor Relaxant: An in Vitro Exploratory Study. Planta Med 2017; 83(16):1274–1280.
- Santos M.S., et al. Synaptosomal GABA release as influenced by valerian root extract--involvement of the GABA carrier. Arch Int Pharmacodyn. Thérapie 1994.
- Dietz B.M., et al. Valerian extract and valerenic acid are partial agonists of the 5-HT5areceptor in vitro. Mol Brain Res 2005;138(2):191–197.
- Müller C.E., et al. Interactions of valerian extracts and a fixed valerian-hop extract combination with adenosine receptors. Life Sci 2002;71(16):1939–1949.
- Ziegler G. et al. Efficacy and tolerability of valerian extract LI 156 compared with oxazepam in the treatment of non-organic insomnia--a randomized, double-blind, comparative clinical study. Eur J Med Res 2002; 71(16):1939–1949.
- Herrera-Arellano A., et al. Polysomnographic Evaluation of the Hypnotic Effect of Valeriana edulis Standardized Extract in Patients Suffering from Insomnia. Planta Med 2001;67(08):695–699.
- Isbrucker R.A., Burdock G.A. Risk and safety assessment on the consumption of Licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin. Regul Toxicol Pharmacol 2006;46(3):167–192.
- FORSLUND T., et al. Effects of licorice on plasma atrial natriuretic peptide in healthy volunteers. J Intern Med 1989.
- Best R., Finney R. The anti-inflammatory and antidiuretic actions of fractions obtained from xanthoglabrol. J Pharm Pharmacol 1961; 13(Suppl):107–110.












Комментарии