И.С. Шорманов 1 , М.С. Лось 2 , Н.С. Шорманова 1
1ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль;
2ГБУЗ ЯО «Областная клиническая больница», Ярославль
Введение
Ишемическое повреждение почки — основная причина развития почечной недостаточности. Существует множество факторов, вызывающих ишемическое повреждение нефрона и нарушение его функции. К ним прежде всего относятся хронические заболевания почек, системные патологии (гипертоническая болезнь, сахарный диабет и др.), оказывающие негативное влияние на почечный кровоток, а также органосохраняющие операции на почках вследствие операционной травмы, тепловой ишемии, необходимости наложения швов для гемостаза [1]. Изучение механизмов повреждения почечной ткани во время органосохраняющих операций показало, что продолжительность ишемического периода до 20 минут не нарушает функцию почки [2]. Главной причиной повреждения является реперфузионная травма, включающая в себя несколько механизмов: выработку реактивных кислородных радикалов, клеточную дисфункцию, застой и сдавливание микрососудов, гиперкоагуляцию [3]. В целях адаптации к неблагоприятным условиям активность антиоксидантной системы повышается. Но запасы естественных антиоксидантов в клетке ограничены и истощаются на протяжении периода гипоксии. Их дополнительное введение в послеоперационном периоде может оказать благоприятный эффект на восстановительные процессы в почечной паренхиме. α-Токоферола ацетат (α-ТА) относится к естественным жирорастворимым антиоксидантам плазмы крови и эритроцитов человека. Он способен стимулировать внутриклеточное увеличение уровня циклического аденозинмонофосфата, поддерживать резервные пути образования АТФ (гликолиз), активизировать синтез белка и нуклеиновых кислот. Дополнительное введение α-ТА перед органосохраняющим лечением почек позволяет значительно улучшить функцию сохранившейся паренхимы [4–19].
Цель — изучить влияние α-ТА на репаративные процессы в почке после органосохраняющей операции в объеме ее резекции в эксперименте.
Материалы и методы
Экспериментальное исследование выполнено на 60 белых лабораторных крысах весом от 200 до 300 г. Колебания веса животных в группах были в пределах 10–20 г. Беспородные животные имеют более широкую норму реакции, чем линейные, что позволяет с большой точностью экстраполировать результаты эксперимента на человеческую популяцию. С животными работали в соответствии с действующими «Правилами проведения работ с использованием экспериментальных животных» и «Международными рекомендациями по проведению медико-биологических исследований с использованием животных». Все животные находились в одинаковых условиях обитания (древесная подстилка из опилок и стружки, температура помещения — 22–24 °C, 12-часовой режим смены освещения) и кормления (стандартный брикетированный корм).
Шестьдесят крыс стали моделью органосохраняющего хирургического лечения почки. Операции производили под интраперитонеальным дипривановым наркозом из расчета 2,5 мг/кг веса. В стерильных условиях срединным разрезом вскрывали брюшную полость, осуществляли доступ к почке. Выполняли резекцию нижнего полюса левой почки, паренхиматозное кровотечение останавливали путем наложения Z-образных швов на зону резекции. Рану ушивали послойно. В послеоперационном периоде все животные были разделены на две группы. Крысам 1-й (контрольной) группы (n = 30) выполняли только хирургическое лечение. Животным 2-й (основной) группы (n = 30) в послеоперационном периоде внутримышечно вводили 10 % масляный раствор α-ТА по 0,2 мл 2 раза в день в течение 5 дней.
Контроль производили на 7, 14 и 28-е сутки после операции путем гистологического исследования края резекции оперированной почки. Животных из опыта выводили путем декапитации под наркозом, то есть с соблюдением «Правил проведения работ с использованием экспериментальных животных» и правил, изложенных в Хельсинской декларации.
Результаты
У животных контрольной группы на 7-е сутки эксперимента в зоне оперативного вмешательства формировалась широкая зона тотального некроза ренальной ткани (рис. 1). В этот период эта зона некроза отделялась от соседних жизнеспособных отделов почки лишь скоплениями из поли- и мононуклеарных лейкоцитов, в пределах которых не просматривались признаки фибриллогенеза (рис. 2). Иногда в различных частях области резекции выявлялись свежие, то есть не отграниченные от окружающих тканей, микроабсцессы (рис. 3). Вне зоны операции ткань почки характеризовалась резким полнокровием и отеком коркового и мозгового слоев, появлением в межуточной ткани инфильтратов из сегментоядерных лейкоцитов, а также множественными кровоизлияниями различной локализации (рис. 4). Эпителий извитых канальцев находился в состоянии гидропической дистрофии и некроза. Содержание гликогена в нем резко снижалось (рис. 5). Просвет канальцев разного уровня оказывался обтурирован зернистыми цилиндрами.
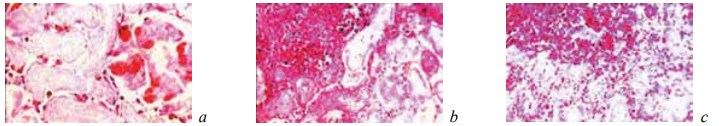
Рис. 1.Состояние ткани почки в зоне резекции у крыс контрольной группы на 7-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: а — некроз всех тканевых компонентов почки. Геморрагии в капиллярных петлях почечного клубочка; b — геморрагическая инфильтрация наружных отделов области некроза; c — геморрагическая инфильтрация наружных отделов области некроза. Кровоизлияния в строме погибшей почечной ткани
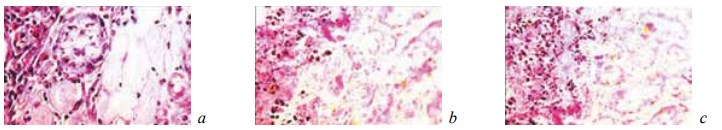
Рис. 2. Состояние ткани почки в зоне резекции у крыс контрольной группы на 7-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200. Граница между некротизированной и сохранной тканью почки маркирована скоплениями из преимущественно поли- и редких мононуклеарных лейкоцитов, среди которых нет признаков фибриллогенеза
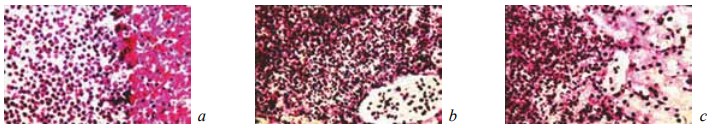
Рис. 3. Состояние ткани почки в зоне резекции у крыс контрольной группы на 7-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: a — микроабсцесс в некротизированной области почки, ткань вокруг него пропитана кровью; b, c — микроабсцесс граничит с дистрофически измененной, но жизнеспособной тканью почки. Геморрагическая инфильтрация вокруг него отсутствует

Рис. 4. Состояние ткани почки в зоне резекции у крыс контрольной группы на 7-е сутки после операции. Ув. ×200: a — резкое полнокровие и отек стромы мозгового слоя. Окраска гематоксилином и эозином; b — дистония артерии среднего калибра корковой зоны. Окраска по Харту; c — кровоизлияния в строму. Гидропическая дистрофия эпителия извитых канальцев. Окраска гематоксилином и эозином
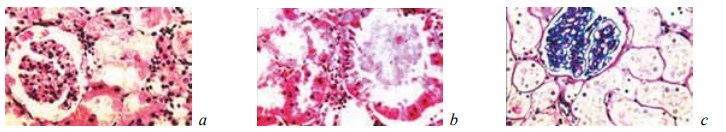
Рис. 5. Состояние ткани почки в зоне резекции у крыс контрольной группы на 7-е сутки после операции. Ув. ×200: а — гидропическая дистрофия и некроз эпителия извитых канальцев с наличием в их просвете зернистых цилиндров. Нейтрофилы в строме. Окраска гематоксилином и эозином; b — гидропическая дистрофия и некроз эпителия извитых канальцев и собирательной трубочки. Наличие в просвете тубулярных структур зернистых цилиндров. Лейкоцитарная инфильтрация стромы. Окраска гематоксилином и эозином; c — резкое снижение содержания гликогена в эпителии канальцев. ШИК-реакция
На 14-е сутки эксперимента в зоне резекции выявлены признаки начинающегося процесса отграничения некротизированных тканей и микроабсцессов от соседних участков почки посредством формирования демаркационного вала, образованного мононуклеарными клетками, фибробластами, ветвящимися сосудами и фибриллярными структурами (рис. 6). Вокруг кровоизлияний возникало реактивное воспаление с фагированием элементов крови и образованием гемосидерина (рис. 7). В других отделах почек ткань была полнокровна и отечна (рис. 8). Дистрофические и некробиотические изменения канальцевого эпителия становились менее выраженными (рис. 9).
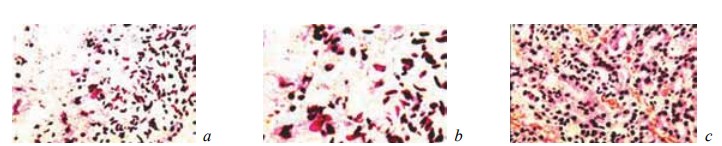
Рис. 6. Состояние ткани почки в зоне резекции у крыс контрольной группы на 14-е сутки после операции. Окраска гематоксилином и эозином. Наличие на границе между некротизированной и жизнеспособной тканью почки полиморфноклеточного воспалительного инфильтрата, молодых фибробластов и фибриллярных структур. Увеличение: a, b — ×200; c — ×400
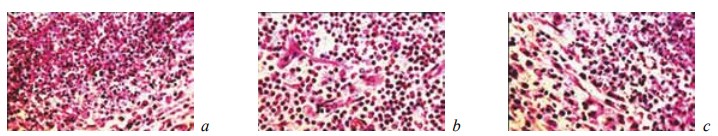
Рис. 7. Состояние ткани почки в зоне резекции у крыс контрольной группы на 14-е сутки после операции. Окраска гематоксилином и эозином. Наличие вокруг микроабсцесса формирующейся капсулы с фибробластами, волокнистыми структурами и капиллярами. Увеличение: a — ×200; b, c — ×400
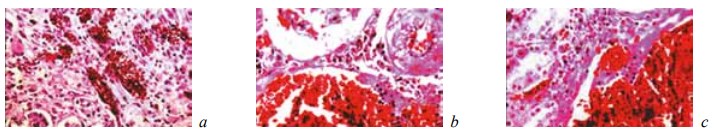
Рис. 8. Состояние ткани почки в зоне резекции у крыс контрольной группы на 14-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: a — резкое полнокровие и отек стромы; b, c — кровоизлияния в ткань коркового слоя. Наличие вокруг кровоизлияний и среди скоплений крови глыбок гемосидерина
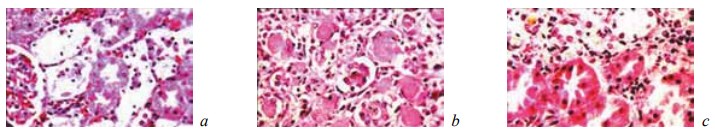
Рис. 9. Состояние ткани почки в зоне резекции у крыс контрольной группы на 14-е сутки после операции. Окраска гематоксилином и эозином: a — зернистая и гидропическая дистрофия эпителия извитых канальцев. Наличие в строме отдельных глыбок гемосидерина. Ув. ×200; b — гидропическая дистрофия и некроз отдельных клеток извитых канальцев. Наличие в просвете их зернистых цилиндров. Ув. ×200; c — зернистая и гидропическая дистрофия канальцевого эпителия. Гемосидероз стромы. Ув. ×400
К 28-м суткам после операции у животных контрольной группы выявляли признаки активной организации некротического детрита и микроабсцессов (рис. 10; рис. 12, б, в). Однако следы последних сохранялись в новообразованной соединительной ткани. Кроме того, она характеризовалась полнокровием, отеком, воспалительной инфильтрацией и рыхлым расположением волокнистых структур (рис. 11; рис. 12, а). За пределами новообразованной соединительной ткани в почке происходило рассасывание кровоизлияний и наблюдались регенераторные изменения эпителия в части канальцев, которые не всегда доходили до своего завершения (рис. 13).
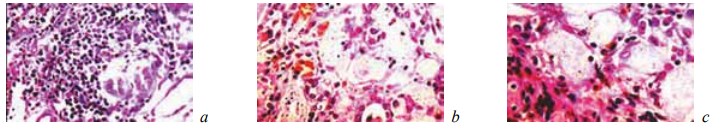
Рис. 10. Состояние ткани почки в зоне резекции у крыс контрольной группы на 28-е сутки после операции. Окраска гематоксилином и эозином. Врастание грануляций в зону некроза. Наличие среди грануляционной ткани скоплений гемосидерина. Увеличение: a — ×200; b, c — ×400
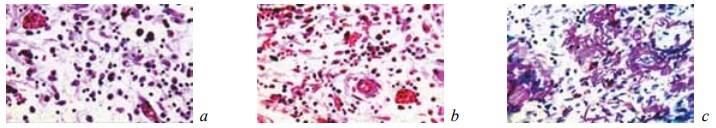
Рис. 11. Состояние ткани почки в зоне резекции у крыс контрольной группы на 28-е сутки после операции: a, b — замещение зоны некроза рыхлой отечной грануляционной тканью, богатой сосудами и тонкими фибриллами. Наличие среди грануляций скоплений гемосидерина. Окраска гематоксилином и эозином; c — переплетающиеся ретикулиновые волокна в области разрастающихся грануляций. ШИК-реакция. Увеличение: a — ×400; b, c — ×200
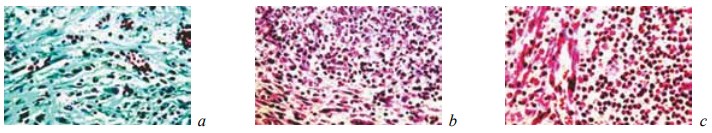
Рис. 12. Состояние ткани почки в зоне резекции у крыс контрольной группы на 28-е сутки после операции. Ув. ×200: a — рыхло расположенные тонкие коллагеновые волокна в области замещения зоны некроза грануляциями. Окраска по Массону; b, c — инкапсуляция и организация микроабсцесса. Окраска гематоксилином и эозином
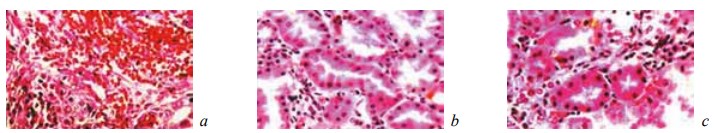
Рис. 13. Состояние ткани почки в зоне резекции у крыс контрольной группы на 28-е сутки после операции. Окраска гематоксилином и эозином: a — инкапсуляция и прорастание незрелой соединительной тканью микрогематомы с рассасыванием элементов крови. Ув. ×200; b — зернистая дистрофия эпителия извитых канальцев. Ув. ×200; c — наличие в некоторых канальцах эпителиальной выстилки из крупных клеток с яркой однородной цитоплазмой. Ув. ×400
При микроскопическом изучении зоны резекции у крыс исследуемой группы, которым вводили α-ТА, установлено, что на 7-е сутки после операции у них имелась узкая зона тотального некроза, переходящая в участки относительно сохранной ткани, в пределах которой погибали только канальцы (рис. 14). Зона некроза у животных этой группы была значительно меньше, чем в контрольной группе. На границе с вышерасположенными отделами почек присутствовали лейкоцитарные инфильтраты с большим содержанием мононуклеарных клеток. Редкие микроабсцессы начинали отграничиваться от окружающих тканей. В средних и верхних отделах почек имелись признаки расстройств кровообращения, они были менее выражены, чем в группе контроля (рис. 15).
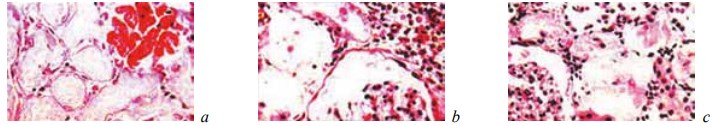
Рис. 14. Состояние ткани почки в зоне резекции у крыс основной группы, которым вводили α-токоферола ацетат, на 7-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: a — некроз канальцев при сохранной строме. Геморрагический некроз клубочка; b, c — некроз канальцев при сохранной строме и клубочках. Инфильтрат из нейтрофилов и мононуклеарных клеток на границе с некрозом
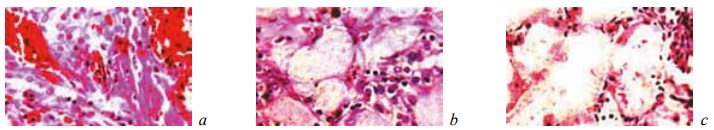
Рис. 15. Состояние ткани почки в зоне резекции у крыс основной группы, которым вводили α-токоферола ацетат, на 7-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: a — кровоизлияния с начальными признаками реактивного воспаления и образованием гемосидерина; b — цилиндры в просвете извитых канальцев; c — гидропическая дистрофия и некроз эпителия канальцев
К 14-м суткам после операции у животных основной группы, так же как и контрольной, происходила резорбция некротизированных тканей, отмечалось отграничение микроабсцессов и очагов кровоизлияний, а в извитых канальцах средних и верхних отделов почек начиналась регенерация поврежденного эпителия (рис. 16).
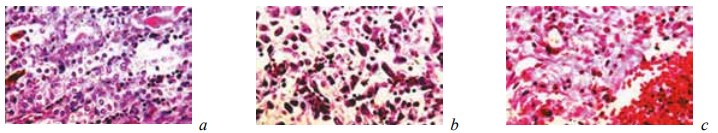
Рис. 16. Состояние ткани почки в зоне (a, b) и выше зоны (c) резекции у крыс основной группы, которым вводили α-токоферола ацетат, на 14-е сутки после операции. Окраска гематоксилином и эозином: a — резорбция некротических тканей. Образование гемосидерина. Ув. ×200; b — резорбция некротических масс с замещением их грануляциями. Ув. ×400; c — инкапсуляция и организация гематомы. Ув. ×200
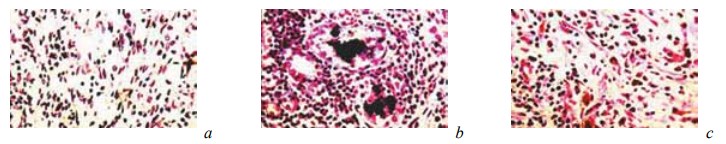
Рис. 17. Состояние ткани почки в зоне резекции у крыс основной группы, которым вводили α-токоферола ацетат, на 28-е сутки после операции. Окраска гематоксилином и эозином. Ув. ×200: a — замещение некротических масс относительно зрелой соединительной тканью, содержащей гемосидерин; b — отложение извести в новообразованной соединительной ткани; c — клеточный и волокнистый состав новообразованной соединительной ткани
На 28-е сутки эксперимента процесс резорбции некротических масс завершался и на их месте, как и в предыдущей группе опытов, разрасталась рыхлая соединительная ткань (рис. 17). Кровоизлияния и гнойнички полностью рассасывались. В извитых канальцах почек происходила регенерация эпителия с насыщением его цитоплазмы гликогеном (рис. 18).

Рис. 18. Состояние ткани почки в зоне (a) и выше зоны (b, c) резекции у крыс основной группы, которым вводили α-токоферола ацетат, на 28-е сутки после операции: a — коллагеновый каркас новообразованной соединительной ткани. Окраска по Массону. Ув. ×200; b — эпителиальная выстилка канальцев представлена крупными клетками с эозинофильной цитоплазмой. Окраска гематоксилином и эозином. Ув. ×400; c — повышение содержания гликогена в эпителии извитых канальцев. ШИК-реакция. Ув. ×200
Обсуждение
Острая почечная травма, вызванная ишемией и реперфузией, является независимым фактором риска хронического заболевания почек [20]. Актуальность данной проблемы приводит к активному поиску различных средств, защищающих почку от интраоперационного повреждения. Применение α-ТА после органосохраняющей операции на почке патогенетически обоснованно. Исследования, посвященные изучению влияния α-ТА на ишемическую травму почки, демонстрируют его выраженное адаптивно-приспособительное действие, подготавливающее почку к дефициту кислорода [4–19]. Эффект α-ТА в послеоперационном периоде может быть обусловлен его антиоксидантным воздействием на продукты перекисного окисления липидов, накопленные в период ишемии и реперфузии. В результате использования α-ТА уменьшается выраженность воспаления и сосудистого стаза, стимулируются процессы образования соединительной ткани. Следствием ускорения репаративных процессов и формирования тонкого соединительнотканного рубца в зоне резекции может быть сохранение большего числа функционирующих нефронов и улучшение почечной функции.
Вывод
Назначение α-ТА в послеоперационном периоде позволяет ускорить репаративные процессы в паренхиме почки, подвергшейся резекции, и сократить зону послеоперационного соединительнотканного рубца.
Литература
- Дряженков И.Г., Комлев Д.Л., Лось М.С. Факторы ишемического повреждения почки при ее резекции // Клиническая медицина. – 2013. – Т. 91. – № 6. – С. 21–25. [Dryazhenkov IG, Komlev DL, Los MS. Factors of ischemic injury of the kidney when it is resected. Klinicheskaya meditsina. 2013;91(6):21-25. (In Russ.)]
- Индароков Т.Р., Серегин А.В., Лоран О.Б., и др. Превентивный гемостатический шов при открытой резекции почки как один из способов сохранения почечной функции // Онкоурология. – 2017. – Т. 13. – № 3. – С. 39–45. [Indarokov TR, Seregin AV, Loran OB, et al. Preventive hemostatic suture during open kidneyresection asan option to preservetherenal function. Onkourologiya. 2013;9(1):17-23. (In Russ.)]. doi: 10.17650/1726- 9776-2017-13-3-39-45.
- Попов С.В., Гусейнов Р.Г., Горшков А.Н., и др. Изменения ультраструктурной организации почки в условиях экспериментально смоделированной тепловой ишемии при оперативном вмешательстве // Вестник Санкт-Петербургского университета. – 2016. – Серия 11. – № 1. – С. 104–119. [Popov SV, Guseinov RG, Gorshkov AN, et al. Changes in the ultrastructural organization of the kidney under the conditions of experimental model thermal ischemia in surgical intervention. Vestnik Sankt-Peterburgskogo universiteta. 2016;11(1):104-119. (In Russ.)]
- Aryamanesh S, Ebrahimi SM, Abotaleb N,etal. Role ofendogenous vitamin E in renal ischemic preconditioning process: differences between male and female rats. Iran Biomed J. 2012;16(1):44-51.
- Shokeir AA, Barakat N, Hussein AA, et al. Role of combination of L-arginine and α-tocopherol in renal transplantation ischaemia/ reperfusion injury: a randomized controlled experimental study in a rat model. BJU Int. 2011;108(4):612-618. doi: 10.1111/j.1464- 410X.2010.09943.x.
- Yurdakul T, Kulaksizoglu H, Pişkin MM, et al. Combination antioxidant effect of α-tocoferol and erdosteine in ischemia-reperfusion injury in rat model. Int Urol Nephrol. 2010;42(3):647-655. doi: 10.1007/s11255-009-9641-y.
- Кирпатовский В.И., Голод Е.А., Надточий О.Н., Обухова Т.В. Влияние α-токоферола на парциальные функции ишемизированной почки // Урология. – 2006. – № 5. – С. 80–84. [Kirpatovskiĭ VI, Golod EA, Nadtochii ON, Obukhova TV. Effects of alpha-tocopherol on partial functions of the ischemic kidney. Urologiia. 2006;(5):80-84 (In Russ.)]
- Gurel A, Armutcu F, Sahin S,etal. Protectiverole ofalpha-tocopherol and caffeic acid phenethyl ester on ischemia-reperfusion injuryvia nitric oxideand myeloperoxidasein ratkidneys. Clin Chim Acta. 2004;338(1-2):33-41. doi: 10.1016/j.cccn.2003.09.013.
- Avunduk MC, Yurdakul T, Erdemli E, Yavuz A. Prevention of renal damage by alpha tocopherol in ischemia and reperfusion models of rats. Urol Res. 2003;31(4):280-285. doi: 10.1007/s00240-003- 0329-y.
- Шорманов И.С., Лось М.С. Патофизиология кортико-симпато-адреналовой системы в послеоперационном периоде парциальной нефрэктомии // Урологические ведомости. – 2018. – Т. 8. – № 2. – С. 11–17. [Shormanov IS, Los MS. Pathophysiology of the cortico-sympathoadrenal system in the postoperative period of partial nephrectomy. Urologicheskie vedomosti. 2018;8(2):11-17. (In Russ.)]. doi: 10.17816/ uroved8211-17.
- Rhoden EL, Pereira-Lima L, Telöken C, et al. Beneficial effect of alpha-tocopherol in renal ischemia-reperfusion in rats. Jpn J Pharmacol. 2001;87(2):164-166. doi: 10.1254/jjp.87.164.
- Голод Е.А. Перекисное окисление мембранных фосфолипидов и Ca-зависимая активность АТФазы микросомальных фракций, выделенных из ткани почек крысы при термической ишемии с защитой альфа-токоферола и без нее // Урология и нефрология. – 1997. – № 5. – С. 5–9. [Golod EA. The membrane phospholipid peroxidation and Ca-dependent ATPase activity of the microsomal fractions isolated from rat renal tissue in thermal ischemia with and without alpha-tocopherolprotection. Urologiia i Nefrologiia. 1997;(5):5-9. (In Russ.)]
- Кирпатовский В.И., Никифорова Н.В., Кудрявцев Ю.В., Надточий О.Н. Использование эмульсии альфа-токоферола для антиоксидантной защиты ишемизированных и консервированных почек // Бюллетень экспериментальной биологии и медицины. – 1996. – Т. 121. – № 5. – С. 499–503. [Kirpatovskii VI, Nikiforova NV, Kudriavtsev IuV, Nadtochii ON. Use of an alpha-tocopherol emulsion for antioxidant protection of ischemic and conserved kidneys. Bjulleten eksperimentalnoj biologii i mediciny. 1996;121(5):499-502. (In Russ.)]
- Takenaka M, Tatsukawa Y, Dohi K, et al. Protective effects of alpha-tocopherol and coenzyme Q10 on warm ischemic damages of the rat kidney. Transplantation. 1981;32(2):137-141. doi: 10.1097/00007890-198108000-00010.
- Uysal F, Girgin FK, Tuzun S. Effect of vitamin E on antioxidant enzymes and nitric oxide in ischemia-reperfused kidney injury. Biochem Mol Biol Int. 1998;44(6):1255-1263. doi: 10.1080/15216549800202352.
- Aktoz Т, Aydogdu N, Alagol В, et al. The protective effects of melatonin and vitamin E against renal ischemiareperfusion injury in rats. Ren Fail. 2007;29(5):535-542. doi: 10.1080/08860220701391738.
- Федорук А.С., Гоженко А.И., Роговый Ю.Е. Защитное воздействие α-токоферола нафункциюпочек и перекисное окисление липидов при острой гемической гипоксии // Патологическая физиология и экспериментальная терапия. – 1998. – № 4. – С. 35–38. [Fedoruk AS, Gozhenko AI, Rogovy YuE. Protective effect of α-to-caffeine on kidney function and lipid peroxidation in acute hemic hypoxia. Pathological physiology and experimental therapy. 1998;(4):35-38. (In Russ.)]
- Надточий О.Н. Профилактика постишемических функциональных расстройств почки при операциях с временных прекращением почечного кровотока (экспериментальное исследование): дис. … канд. мед. наук. – М., 2000. [Nadtochii ON. Prophylaxis of postischemic functional disorders of the kidney during operations with temporary discontinuance of renal blood flow (experimental study). [dissertation] Moscow; 2000. (In Russ.)]. Доступно по: http://medical-diss.com/medicina/ patofiziologicheskoe-obosnovanie-ispolzovaniya-antioksidantovdlya-vosstanovleniya-funktsii-pochek-pri-eksperimentalnom-p. Ссылка активна на 07.09.2018.
- Кирпатовский В.И., Надточий О.Н., Сыромятникова Е.В. Возможности пролонгации допустимых сроков ишемии почки при использовании разных вариантов противоишемической защиты // Урология. – 2003. – № 3. – С. 7–10. [Kirpatovsky VI, Nadtochy ON, Syromyatnikova EV. Possibilities of prolonging the permissible periods of kidney ischemia when using different variants of anti-ischemic protection. Urologiia. 2003;(3):7-10. (In Russ.)]
- Barrera-Chimal J, Estrela GR, Lechner SM, et al. The myeloid mineralocorticoid receptor controls inflammatory and fibrotic responses after renal injury via macrophage interleukin-4 receptor signaling. Kidney Int. 2018;93(6):1344-1355. doi: 10.1016/j. kint.2017.12.016.
Статья опубликована в журнале "Урологические ведомости" № 3 2018, стр. 44-51










Комментарии