Мылтыгашев М.П., Бояндин А.Н., Капсаргин Ф.П., Шишацкая Е.И., Кириченко А.К., Шумилова А.А., Волова Т.Г.
Стриктура лоханочно-мочеточникового сегмента, приводящая к развитию гидронефроза, встречается в 2,9 % случаев урологических заболеваний у взрослых, а частота нефрэктомий, как следствие заболевания, по данным ряда авторов, составляет от 6,5 до 37 % [1,2]. Стеноз пиелоуретерального сегмента при гидронефрозе является одним из частых показаний к инструментальной или хирургической коррекции [3,4]. Еще в 1949 году, J.C. Anderson, W Hynes была предложена методика, которая заключалась в создании анастомоза между дистально рассеченным участком мочеточника и нижней частью лоханки с резекцией ее избыточной части [5].
Анализ отдаленных результатов хирургического лечения гидронефроза свидетельствует о том, что уменьшение числа осложнений в ближайшем послеоперационном периоде во многом зависит от способа и качества дренирования зоны анастомоза [6,7]. Многолетний опыт реконструктивных операций на верхних мочевых путях позволил усовершенствовать технику внутреннего дренирования чашечно-лоханочной системы. Однако остается целый ряд нерешенных проблем, связанных со стентированием, что приводит к разработке и усовершенствованию самих стентов, систем доставки и удаления, контроля за функционированием стента и т.д. [8,9]. Среди наиболее востребованных для этих целей материалов следует отметить линейные полиэфиры микробиологического происхождения - полигидроксиалканоаты (ПГА) [10,11]. Сферы применения ПГА в медицине потенциально широки и могут включать сердечно-сосудистую хирургию, абдоминальную хирургию, ортопедию, стоматологию и др. [12,13,14]. Особенно перспективным считается применение ПГА в клеточной и тканевой инженерии для реконструктивной хирургии тканей и создания имплантатов, и эндопротезов разной сложности [15].
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на кафедре урологии, андрологии и сексологии ИПО Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого и в научно-исследовательской лаборатории биотехнологии новых биоматериалов Сибирского федерального университета. Проведение исследований одобрено локальным этическим комитетом КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России.
Для изготовления полимерных стентов взяты экспериментальные образцы ПГА - сополимер 3-гидроксибутирата с 4-гидроксибути-ротом П(3ГБ/4ГБ) с включением 4-гидроксибутирата 30 мол.% (молекулярная масса в процентах), (молекулярная масса (Мв) 800 ^a, полидисперсность 1,76±0,04, кристалличность 50%). Гигиенический сертификат Главной санитарной службы РФ соответствия условий производству материалов для медицины (№ 24.49.05.000.М.007682.01.05 от 24.01.2005 г).
Полимерные стенты на основе П(3ГБ/4ГБ) получали с помощью применения технологии литья полимерного раствора концентрацией 10% с последующим испарением растворителя в заданной форме. Физико-механические характеристики образцов регистрировали на универсальной электромеханической испытательной машине Instron 5565,5 KN (Великобритания). Базовая (начальная) длина образцов - 5 см, ширина - 0,3 мм. Исследовали следующие параметры: напряжение при растяжении (Па), средний модуль Юнга (Па) и среднее удлинение (%).
Особенность тканевой реакции на мочеточниковые стенты на основе П(3ГБ/4ГБ) - (экспериментальная группа (n=15)) и полиуретановые стенты (контрольная группа (n=15)), (UrotechWhiteStar) исследована в эксперименте на кроликах породы «Советская шиншилла» 4-5-ти месяцев, массой 4800-5500 г., на модели операции пластики пиелоуретерального сегмента.
Кролики содержались в стандартных условиях вивария при естественном освещении со свободным доступом к пище и воде. Хирургическое вмешательство выполняли под общим наркозом в асептических условиях (расчет дозы препарата производился с учетом массы тела животного согласно рекомендациям производителя): ксилозин 17 мг и золетил 40 мг внутримышечно, в ходе операции 0,7 мг золетила по внутривенному катетеру, время действия 5-7 мин.
Для установки стента в пиелоуретеральный сегмент (ПУС) выполняли продольный паралюмбаль-ный разрез. Послойно рассекалась кожа, подкожная клетчатка, наружная и внутренняя косая мышца, поперечная мышца живота, брюшина отодвигалась латерально, вскрывалось забрюшинное пространство, выделялись верхняя треть мочеточника, пиелоуретеральный сегмент, почка. Мочеточник фиксировался и рассекался в пиелоуретеральном сегменте, по струне в область анастомоза устанавливался стент длинной 4 см, затем отдельными кетгутовыми швами ушивался. Рана дренировалась. Операцию заканчивали послойным ушиванием раны. В раннем послеоперационном периоде с целью антибиотикопрофилактики был применен препарат Офрамакс (цефтриаксон) в дозе 0,2 г 2 раза в сутки в течение 3-х дней, а также анальгетики и спазмолитики.
Фрагменты пиелоуретерального сегмента в зоне стояния стента трансплантата подвергались морфологическому исследованию. Гистологический материал фиксировался в забуференном 10% нейтральном формалине и обрабатывался по общепринятой методике. Парафиновые срезы стандартной толщины (5,0 мкм) окрашивались гематоксилином и эозином, пикро-фуксином по Ван-Гизону. Микроскопическое исследование и фотографирование проводилось с применением светового микроскопа CarlZeissImager A1 («CarlZeiss», Германия) (объективы 10, 20, 40) с адаптированной цифровой фотокамерой AxioCamMRc50.
Морфометрию проводили с помощью программы AxioVision и JMicroVision для среды Windows XP. Измерялась толщина уротелия, мышечной оболочки, оценивалась воспалительная инфильтрация пиелоуретерального сегмента.
Оценка характера распределения производилась по критерию Шапиро-Уилкса. Если исследуемые показатели имели нормальное распределение, выборки приведены в их среднем значении со средней квадратичной ошибкой: М±а. Для непараметрических распределений выборки приведены значения медианы и области 75% квартиля (Me(P25,P75). Сравнительные статистические данные рассчитаны по критерию Манна Уитни. Различия считались значимыми при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сконструирована серия полимерных стентов на основе сополимера 3-гидроксибутирата с 4-гидроксибутиротом П (3ГБ/4ГБ) с включением 4-гидроксибутирата 30 мол.%, длиной до 30 см, диаметром 3 мм. По данным электронной микроскопии внутренней поверхности исследуемых стентов отмечено, что стенки полых полимерных трубок изнутри имеют рельефную поверхность и поры до 10 мкм, в отличие от гладких полиуретановых стентов (рис. 1).
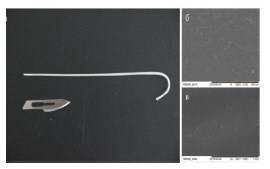
Рис. 1. а - Макрофото биодеградируемого стента на основе П(3ГБ/4ГБ) с включением 4-гидроксибутирата 30 мол.%; РЭМ (растровая электронная микроскопия) снимки полимерных стентов: б - П(3ГБ/4ГБ); в - полиуретан (Urotech White Star). Маркер 100 мкм и 1 мм]
Результаты исследования физико-механических свойств стентов, включающие в качестве показателей напряжение при разрыве, относительное разрывное удлинение, модуль упругости и коэффициент трения, представлены в таблице 1. Известно, что большинство полимерных материалов отличается относительно быстрым разрушением поверхностного слоя при трении. Кроме того, стент в процессе установки и движения человека испытывает, помимо радиальной, дополнительную, в том числе и осевую, нагрузку. Поэтому при изготовлении биодеградируемого стента на основе П(3ГБ/4ГБ) учитывали фрикционные свойства полигидроксиалканоатов.
Таблица 1. Физико-механические характеристики полиуретановых трубок и полимерных стентов (М*±м)
| Состав образцов | Напряжение при растяжении, ед. изм. | Модуль Юнга, Па | Среднее отн. удлинение, % | Коэфф. трения |
|---|---|---|---|---|
| П(3ГБ/4ГБ) | 16,16 | 51,28 | 392,8 | 0,28 |
| Полиуретан | 20,05 | 14,69 | 413 | 0,35 |
*среднее из 10 измерений
При сравнении с уже существующим коммерческим аналогом для стентирования мочеточников - стентами на основе полиуретана, установлено, что сополимерные образцы отличаются несколько сниженным значением удлинения (392,8 %), однако способны в большей степени сопротивляться напряжению при растяжении (разрыве).
Сравнительный анализ эффективности использования полиуретанового и биодеградируемого стента на основе ПГА изучен при стентировании мочеточника на 30 кроликах -самцах породы «Советская шиншилла». Все оперированные животные удовлетворительно перенесли операцию, интраперационных осложнений не зафиксировано. Ранний послеоперационный период протекал гладко, дренажи у всех животных удалены на 3-5-е сутки, кожные швы -на 10- 12-е сутки, заживление послеоперационных ран первичным натяжением.
При морфологическом исследовании поперечных срезов мочеточника у животных с установленным стентом из полиуретана на 7-е сутки эксперимента выявлена дилатация мочеточника, средний диаметр просвета составил 3,5±0,4 мм. Отмечалось утолщение стенок мочеточника вследствие гипертрофии мышечного слоя и воспалительного отека под-слизистого слоя (рис. 2). В поверхностных слоях собственной пластинки определялись небольшие очаговые воспалительные инфильтраты, представленные преимущественно клетками гранулоцитарного ряда, местами распространяющиеся на мышечную оболочку, толщина эпителиального слоя составила, в среднем, 73,3 (от 65,8 до 83,8) мкм.
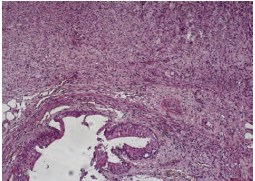
Рис. 2. Общая картина изменений структуры мочеточника на 7-е сутки в контрольной группе. Окраска гематоксилин-эозин; х 200
При гистологическом исследовании материала экспериментальной группы во всех случаях на 7-е сутки визуализировался полимерный стент, имеющий вид слабоэозинофильной полупрозрачной каймы (рис. 3). У экспериментальных животных после имплантации стента из П(3ГБ/4ГБ) на поперечных срезах просвет мочеточника был умеренно расширен до 2,6±0,3 мм. Уротелий сохранен на всем протяжении установленного стента, мышечный слой имел равномерную толщину, отек подслизистого слоя не выражен. В тоже время, эпителиальный пласт имел неравномерную толщину, отмечено его истончение в местах более плотного прилегания полимерного стента, В среднем, толщина эпителиального слоя составила 110,4 (96,2; 128,5) мкм, различия между экспериментальной и контрольной группами статистически значимы (р<0,001).
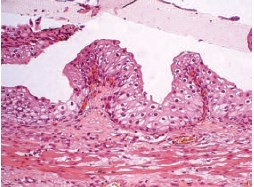
Рис. 3. Общая картина изменений структуры мочеточника на 7-е сутки после имплантации стента П(3ГБ/4ГБ). Окраска гематоксилин-эозин; х 200
Клетки воспалительного происхождения располагались, главным образом, в подслизистом слое и были представлены лимфоцитами (2±1 клеток в поле зрения) и эозинофилами (5±2 клеток в поле зрения).
На 14-е сутки после стентирования мочеточника в гистологических препаратах, полученных от контрольной группы животных, отмечается незначительная гипертрофия и воспалительный отек стенки мочеточника, а так же гиперпластические изменения уротелия. Средний диаметр просвета мочеточника составил 3,9±0,3 мм. Отмечена умеренно выраженная клеточная инфильтрация. Количество полиморфноядерных лейкоцитов в стенке мочеточника составило 15±7 клеток в поле зрения, лимфоцитов - 10±5 клеток в поле зрения, гистиоцитов - 12±4 клеток в поле зрения. Также, выявлена гипотрофия мышечной оболочки стенки мочеточника - 116,7 (97,8; 131,9) мкм, с умеренно выраженным фиброзом.
На 14-е сутки в экспериментальной группе животных после имплантации стента П(3ГБ\4ГБ) просвет мочеточника на уровне расположения стента отличался складчатостью, был несколько расширен в дистальном отделе. Толщина уротелия составила в среднем 127,2 (от
116,2 до 145,7) мкм. Отмечено, что на большем протяжении стент располагался свободно, без адгезии с поверхностью переходного эпителия мочеточника. Клетки воспалительного характера отсутствовали или были единичными.
На 28-е сутки эксперимента в контрольной группе животных толщина слизистого слоя мочеточника составила, в среднем, 81,3 (от 72,3 до 92,7) мкм, на протяженном участке отмечено истончение уротелия. Мышечная оболочка имела среднюю толщину 92,5 (от 79,7 до 102,5) мкм, с явлениями пролиферации соединительнотканных элементов. В подслизистом слое выявлена компактная структура за счет накопления волокон соединительной ткани и пролиферации фибробластов (40±19 клеток в поле зрения)и фиброцитов -56±12 клеток в поле зрения (рис. 4).
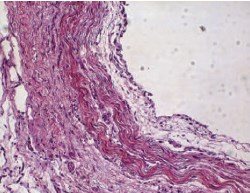
Рис. 4. Общая картина изменений структуры мочеточника на 28-е сутки в контрольной группе животных. Определяется гипертрофия мышечного слоя. Окраска гематоксилин-эозин; х 200
На 28-е сутки в группе животных после имплантации стента П(3ГБ\4ГБ), стенка мочеточника проксимальнее расположения стента сохранила продольную складчатость. Мочеточники не расширены, их средняя толщина составила 1,4±0,7 мм. Слизистая мочеточника была сохранена, отсутствовали псевдополипозные разрастания уротелия и деэпителизированные участки.
Уротелий мочеточников основной группы не утратил барьерных функций, поэтому стенка мочеточника не содержала воспалительных инфильтратов. Клетки лейкоцитарного происхождения диффузно располагались в подслизистом слое и были представлены лимфоцитами 2±1 клеток в поле зрения, гистиоцитами 7±4 кл. в поле зрения (рис. 5). Слизистая оболочка в основном с гладким контуром, с равномерной толщиной переходного эпителия 116,3 (от 99,4 до 141,2), различия между экспериментальной и контрольной группами животных являются статистически значимыми (р<0,001).
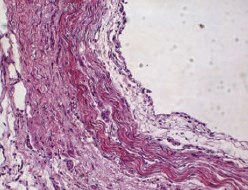
Рис. 5. Общая картина изменений структуры мочеточника на 28-е сутки после имплантации стента П(3ГБ/4ГБ). Окраска гематоксилин-эозин; х 400
ЗАКЛЮЧЕНИЕ
Проведено сравнительное исследование морфофункциональных изменений мочеточника кроликов, после его пластики стентом из полиуретана (контрольная группа) и полимерными стентами изсополимера 3-гидроксибутирата/4-гидроксибутирата -П(3ГБ/4ГБ)(экспериментальная группа). В эксперименте in vivo по данным гистологических исследований показано, что стенка мочеточника в экспериментальной группе сохраняла продольную складчатость, гипертрофия мышечной оболочки отсутствовала, слизистая оболочка имела гладкие контуры, с равномерной толщиной переходного эпителия, в отличие от контрольной группы, в которой зафиксировано продуктивное воспаление с исходом в склероз. Полученные результаты подтверждают эффективность разрабатываемых на основе ПГА стентов и определяют потенциальные возможности применения данного материала при хирургическом лечении стриктуры пиелоуретерального сегмента.
ЛИТЕРАТУРА
1. Аляев Ю.Г., Руденко В.И., Газимиев М.А. Виды стентирования мочеточника после контактной уретеролитотрипсии. Материалы Первого Российского конгресса по эндоурологии. М.; 2008: с.126-127.
2. Глыбочко П.В., Аляев Ю.Г., Газимиев М.А. Стенты мемокат (MEMOKATH) в лечении обструктивных заболеваний мочевых путей. Медицинский вестник Башкортостана 2011;6(2):227-231.
3. Гулиев Б.Г. Реконструктивные операции при органической обструкции верхних мочевыводящих путей: Дис. ... д-ра мед. наук. СПб; 2008. URL: medical-diss.com/ docreader/243561/d?#?page=1
4. Комяков Б.К., Гулиев Б.Г., Давранов А.Ж. Паллиативное дренирование верхних мочевых путей при опухолевой обструкции мочеточников. Амбулаторная хирургия. Стационарозамещающие технологии 2006;.(2):17-19.
5. Anderson JC, Hynes W. Retrocaval ureter: A case diagnosed preoperatively and treated successfully by a plastic operation. BJU 1949;21(9):209-214. DOI:10.1111/j.1464-410X.1949.tb10773.x
6. Мартов А.Г., Ергаков Д.В., Корниенко С.И. Улучшение качества жизни пациентов с внутренними стентами путем изменения их формы. Урология. 2011;(2): 7-13.
7. Brauers A, Thissen H, Pfannschmidt O. Development of a biodegradable ureteric stent: surface modification and in vitro assessment. J Endow 1997;11:399-403.DOI: 10.1089/end.1997.11.399
8. Dineen MK, Tierney DS, Kuzma P. An evaluation of the pharmacokinetics and pharmacodynamics of the histrelin implant for the palliative treatment of prostate cancer. J Ciin Pharmacol 2005; (45):1245-1249. DOI: 10.1177/0091270005281043
9. Волова Т.Г., Севастьянов В.И., Шишацкая Е.И. Полигидроксиалканоаты (ПГА) - биоразрушаемые полимеры для медицины. Новосибирск.: СО РАН, 2003. 330 c.
10. Волова Т.Г., Шишацкая Е.И. Разрушаемые биополимеры: получение, свойства, применение. Красноярск.: Красноярский писатель, 2011. 392 с.
11. Шишацкая Е.И., Волова Т.Г. Полигидроксиалканоаты как матриксы в клеточных технологиях. Клеточная трансплантология и тканевая инженерия 2010;(3):55-56.
12. Шишацкая Е.И., Камендов И.В., Старосветский С.И., Волова Т.Г. Исследование остеопластических свойств матриксов из резорбируемого полиэфира гидроксимасляной кислоты. Клеточная трансплантология и тканевая инженерия. 2008;3(4):41-47.
13. Volova TG, Shishatskaya EI, Sinskey AJ. Degradable Polymers: Production, Properties and Applications. NY: Nova Science Pub. Inc. 2013;. 380 р.
14. Shishatskaya EI, Volova TG. Biomedical Studies of Polyhydroxyalkanoates Journal of Siberian Federal University. Series Biology.2016;1(9):6-20.
15. Шумилова А.А., Николаева Е.Д. Дифференцировка ммск в остеобласты на пористых 3D-носителях из поли-3-гидроксибутирата. Журнал Сибирского федерального университета. Серия Биология. 2016; (9); 53-62.











Комментарии