Н.И. Сорокин1,2, В.К. Карпов1-4, Б.М. Шапаров1,4
1Факультет фундаментальной медицины МГУ имени М.В. Ломоносова, кафедра урологии и андрологии, Москва, Россия
2МНОЦ МГУ имени. М.В. Ломоносова, Москва, Россия
3ГБУЗ «ГКБ №31 ДЗМ», Москва, Россия
4ГБУЗ «ГКБ №17 ДЗМ», Москва, Россия
Сорокин Николай Иванович
врач-уролог
МНОЦ МГУ имени М.В. Ломоносова,
профессор кафедры урологии и андро-
логии ФФМ МГУ имени М.В. Ломоносова,
ведущий научный сотрудник отдела
урологии и андрологии МНОЦ МГУ
имени М.В. Ломоносова

Карпов Валерий Кузьмич
к.м.н., врач-уролог ГКБ №31 ДЗМ,
доцент кафедры урологии и андрологии
ФФМ МГУ имени М.В. Ломоносова,
ведущий научный сотрудник отдела
урологии и андрологии МНОЦ МГУ имени
М.В. Ломоносова, заслуженный врач РФ

Шапаров Борис Мурадинович
врач-уролог ГБУЗ ГКБ №17 ДЗМ,
аспирант кафедры урологии
и андрологии ФФМ МГУ
имени М.В. Ломоносова
Введение
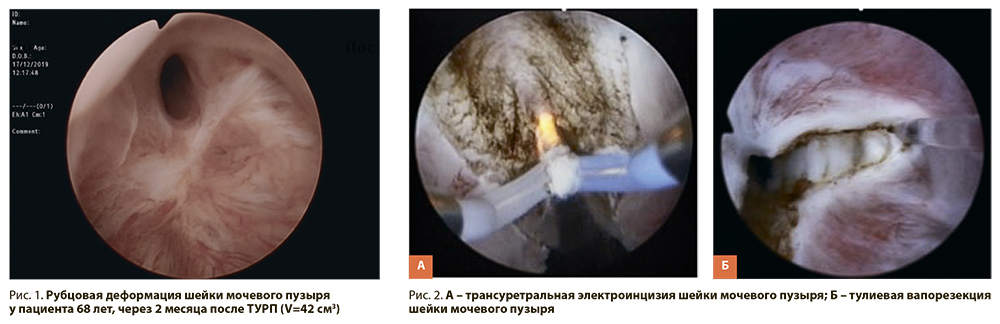
Рубцовая деформация шейки мочевого пузыря (РДШМП) (рис. 1) является осложнением трансуретральной резекции простаты по поводу доброкачественной гиперплазии предстательной железы (ДГПЖ), встречается с частотой от 0,3 до 9,6% и в 50–80% случаев носит рецидивирующий характер, может приводить к многократным повторным оперативным вмешательствам (рис. 2). На сегодняшний день не существует единого мнения об оптимальном лечении больных этим заболеванием, российские и зарубежные клинические рекомендации не дают четкого ответа на данный вопрос. В этих условиях особую актуальность приобретает изучение различных методик оперативного лечения больных ДГПЖ [1].
Современные методы оперативного лечения больных гиперплазией простаты и их влияние на развитие РДШМП
К факторам риска развития РДШМП после эндоскопического оперативного лечения больных гиперплазией простаты относятся: хроническая инфекция нижних мочевыводящих путей, объем простаты менее 55 см3, сахарный диабет 2 типа, курение, сердечно-сосудистые заболевания, продолжительность операции, наличие натяжения уретрального катетера с гемостатической целью в раннем послеоперационном периоде, повторное дренирование мочевого пузыря. Однако, известно, что вероятность развития данного состояния также зависит от методики первичной операции по поводу гиперплазии простаты [2].
Трансуретральная резекция простаты
Трансуретральная резекция предстательной железы (ТУРП) на сегодняшний день остается основным методом лечения больных ДГПЖ. Частота встречаемости РДШМП после ТУРП – в среднем 4,9%, при этом по данным некоторых исследований данный показатель может достигать 12,3%. В большинстве исследований на эту тему отмечается корреляция вероятности развития этого осложнения с объемом простаты, длительностью операции, диаметром резектоскопа и объемом кровопотери.
Разница в частоте развития осложнения может также варьировать в зависимости от вида применяемой энергии – монополярной трансуретральной резекции простаты (M-TURP) и биполярной трансуретральной резекции простаты (B-TURP), однако наиболее крупное исследование по данной теме демонстрирует сопоставимость встречаемости послеоперационной РДШМП вне зависимости от вида энергии [3].
С целью снизить вероятность рубцовых осложнений ТУРП может комбинироваться с профилактической трансуретральной инцизией простаты (ТУИП) и шейки мочевого пузыря, что особенно актуально при объеме простаты до 30 см3. По результатам отдельных исследований [4] такая техника позволяет полностью предотвратить риск развития РДШМП
(см. таблицу).
Большой интерес представляют данные о том, что у пациентов с камнями мочевого пузыря на фоне ДГПЖ, после ТУРП с электрогидравлической литотрипсией частота РДШМП была значительно реже, чем у пациентов без камней в мочевом пузыре (3,2% против 13,1%). Причина, объясняющая такую корреляцию, неясна [5].

Трансуретральная электроэнуклеация простаты
Трансуретральная эндоскопическая энуклеация простаты впервые была предложена Y. Hiraoka в 1983 г. К преимуществам этого метода относится более анатомичное и радикальное удаление аденоматозной (гиперплазированной) ткани простаты, а также отсутствие ограничений по ее объему.
В зависимости от вида применяемой энергии – монополярной и биполярной – может различаться частота развития РДШМП после трансуретральной энуклеации гиперплазии простаты, однако по данным наиболее крупного исследования с включением 1100 пациентов частота формирования РДШМП в течение 1–2 лет после вмешательства составляет 0,9% и не зависит от вида применяемой энергии [6]. По результатам немногочисленных исследований биполярной вапоризации гиперплазии простаты частота формирования РДШМП после этого вида оперативного лечения составляет 4,8% [7].
Тулиевый лазер
Начиная с 2005 года, когда тулиевый лазер был впервые представлен для лечения больных гиперплазией простаты, было разработано множество методик, основывающихся на этой технологии: тулиевая энуклеация (ThuLEP), тулиевая волоконная энуклеация (ThuFLEP), тулиевая вапоэнуклеация (ThuVEP), тулиевая вапоризация (ThuVP) и тулиевая резекция (ThuLRP).
Исследования с использованием лазера мощностью 70–150 Вт показали частоту развития РДШМП после ThuVEP, ThuLRP, ThuVP и ThuLEP около 1,6%. Наименьший показатель частоты встречаемости РДШМП в послеоперационном периоде отмечен при выполнении ThuFLEP – 0,5% (1 случай в группе из 211 пациентов). При выполнении ThuVEP с использованием лазера мощностью 120–200 Вт частота осложнений возрастает до 3,6%. Таким образом, частота РДШМП после вышеуказанных методик оперативного лечения больных гиперплазией простаты составила от 0,5 до 3,6%. В проспективном многоцентровом исследовании после применения тулиевой вапорезекции (ThuVARP), включавшем 2216 пациентов, частота встречаемости РДШМП составила 1,6%. При сравнении ThuLEP и ThuLRP при малых объемах простаты (30 и менее см3) были получены сопоставимые показатели эффективности и безопасности, однако в группе больных после ThuLRP выявлена значительно более высокая частота (13,6%) развития РДШМП по сравнению с группой больных, перенесших ThuLEP (1,8%; р = 0,045). Таким образом, выбор методики ThuLEP может значительно снизить риск РДШМП у пациентов с небольшим объемом простаты, так как процедура заключается в энуклеации гиперплазированной ткани простаты без термического повреждения шейки мочевого пузыря [3-5].
Гольмиевый лазер
Гольмиевая лазерная энуклеация гиперплазии простаты (HoLEP) характеризуется высоким уровнем безопасности и эффективности, и считается превосходящей ТУРП, а частота развития РДШМП при ее использовании считается сравнительно низкой (от 0,4 до 1,7%), однако при выполнении гольмиевой лазерной аблации простаты (HoLAP) данный показатель может возрастать до 7%. В наиболее крупном исследовании на эту тему, включающем 1216 пациентов, сообщается о частоте встречаемости РДШМП после HoLEP – 1,1% (14 случаев) при наблюдении в течение 7,6 лет, при этом у 10 пациентов с РДШМП (71,4%) объем простаты был менее 50 см3.
При этом по данным сравнительных исследований значительная корреляция между объемом простаты и развитием РДШМП отмечается независимо от типа используемого лазера: 7%, при HoLEP и 9,6% при фотоселективной вапоризации гиперплазированной ткани простаты (ФВП) лазером GreenLight. Сравнение указанных разновидностей лазеров без привязки к объему простаты демонстрирует более высокую частоту развития РДШМП у пациентов после ФВП (6%), чем после HoLEP (1%). При сравнении ThuLEP и HoLEP статистически значимой разницы в частоте встречаемости РДШМП не отмечается [7, 8].
Фотоселективная вапоризация гиперплазированной ткани простаты лазером GreenLight
Частота развития РДШМП после ФВП сопоставима с таковой после ТУРП, однако, по результатам некоторых исследовании может ее превосходить, при этом подчеркивается, что этот показатель может варьировать в зависимости от модели лазера и мощности примененной энергии. Это связано с особенностями воздействия GreenLight – он глубже проникает в окружающие ткани, что приводит к термическому повреждению. В целях предотвращения развития РДШМП при выполнении ФВП с использованием GreenLight, во время операции производится холодный надрез в области шейки мочевого пузыря, а сама вапоризация производится по полуокружности с 3 до 9 часов условного циферблата [9, 10] (рис. 3).
Диодная лазерная вапоризация гиперплазии простаты
Диодная лазерная вапоризация у больных ДГПЖ является более безопасной методикой по сравнению с ТУРП. Встречаемость РДШМП среди осложнений после диодной лазерной вапоризации в сравнении с другими видами лазерного воздействия достаточно низкая. Это связано с меньшим термическим повреждением шейки мочевого пузыря, которое, несмотря на наибольшую глубину воздействия (0,5–5 мм), характерно для диодного лазера [3, 7].
Заключение
Помимо известных факторов риска на вероятность формирования РДШМП после различных трансуретральных эндоскопических хирургических вмешательств может влиять вид применяемой энергии и оперативной техники. Персонализированный подход к оперативному лечению больных гиперплазией простаты в группе высокого риска может позволить снизить вероятность развития РДШМП.
Список литературы:
- Аббосов Ш.А., Охоботов Д.А., Сорокин Н.И., Шомаруфов А.Б., Шапаров Б.М., Наджимитдинов Я.С., Мухтаров Ш.Т., Акилов Ф.А., Камалов А.А. Оценка эффективности баллонной дилатации рубцового сужения шейки мочевого пузыря после трансуретральных вмешательств на предстательной железе (предварительные результаты). Вестник урологии. 2021;9(1): 5–13.
- Tao H., Jiang Y.Y., Jun Q., Ding X., Jian D.L., Jie D., Ping Z.Y. Analysis of risk factors leading to postoperative urethral stricture and bladder neck contracture following transurethral resection of prostate. Int Braz J Urol. 2016;42(2):302–311.
- Tang Y., Li J., Pu C., Bai Y., Yuan H., Wei Q., Han P. Bipolar transurethral resection versus monopolar transurethral resection for benign prostatic hypertrophy: a systematic review and meta-analysis. J. Endourol. 2014;28(9):1107–1114.
- Аббосов Ш. А., Сорокин Н. И., Кадрев А. В., Шомаруфов А. Б., Нестерова О. Ю., Акилов Ф. А., Камалов А. А. Предикторы развития склероза шейки мочевого пузыря после трансуретральных вмешательств на предстательной железе. Урология. 2021;5:73–77.
- Lee Y.H., Chiu A.W., Huang J.K. Comprehensive study of bladder neck contracture after transurethral resection of prostate. J. Urology. 2005;65(3):498–503.
- Liu C., Zheng S., Li H., Xu K. Transurethral enucleation and resection of prostate in patients with benign prostatic hyperplasia by plasma kinetics. J Urol. 2010;184(6):2440–45. doi: 10.1016/j.juro.2010.08.037.
- Abbosov S.A., Sorokin N. I., Shomarufov A. B., Kadrev A. V., Nuriddinov K. Z., Mukhtarov S. T., Akilov F. A., Kamalov A. A. Bladder neck contracture as a complication of prostate surgery: Alternative treatment methods and prospects (literature review). Urological Science. 2022;33(2):49–55.
- Abbosov S. A., Sorokin N. I., Shomarufov A. B., Kadrev A. V., Mikheev K. V., Fozilov A. A., Najimitdinov Y. S., Ohobotov D. A., Giyasov S. I., Mukhtarov S. T., Akilov F. A., Kamalov A. A. Assessment of the balloon dilation efficiency in bladder neck contracture after transurethral interventions on the prostate. Urological Science. 2022;33(3 (2022), 130–135.
- Камалов А. А., Осмоловский Б. Е., Охоботов Д. А. Отдаленные результаты фотоселективной вапоризации предстательной железы в лечении аденомы простаты. Урология. 2012;3:31–33.
- Spaliviero M., Araki M., Culkin D.J., Wong C. Incidence, management, and prevention of perioperative complications of GreenLight HPS laser photoselective vaporization prostatectomy: experience in the first 70 patients. J. Endourol. 2009;23(3):495–502.
Источник: http://rusmh.org/images/content/gmu/mu-2023-2.pdf










Комментарии