Korean J Urol. 2010 May;51(5):313-7. Epub 2010 May 19.
The Role of TURP in the Detection of Prostate Cancer in BPH Patients with Previously Negative Prostate Biopsy.
Kim DK, Kim SJ, Moon HS, Park SY, Kim YT, Choi HY, Lee TY, Park HY.
Department of Urology, College of Medicine, Hanyang University, Seoul, Korea.
Абстракт.
Цель: определить значение раннего выявления рака переходной зоны при трансуретральной резекции (ТУР) по поводу доброкачественной гиперплазии простаты (ДГПЖ) у пациентов с симптомами нижних мочевых путей (СНМП), когда были подозрения на рак, несмотря на отрицательные результаты биопсии под контролем УЗИ.
Материалы и методы: с января 2006 по январь 2009 года, нами изучено 165 пациентов, перенесших ТУРП. Частота выявления рака простаты сравнивалась у пациентов подвергнутых (группа А) и не подвергнутых (группа В) трансректальной биопсии перед ТУРП. Все данные оценивались ретроспективно. Они включали в себя уровень простатического специфического антигена (ПСА), пальцевое ректальное исследование (ПРИ), данные, полученные при ТУРП (включая объем резецированной ткани и гистологическое заключение), результаты биопсии простаты. Группа А разделялась на две подгруппы: А1 - после ТУРП диагностирован рак простаты, А2 - после ТУРП выявлена ДГПЖ.
Результаты: частота выявления рака не имела значимых различий между группами А и В (8,9% против 7,5%, р>0,05). Средний уровень ПСА в подгруппах А1 и А2 была 15,5±14,0нг/мл и 9,1±5,1нг/мл, соответственно (р>0,05). В подгруппе А1, 40% пациентов имели анормальную картину ПРИ, по сравнении с 6,7% подгруппы А2 (р<0,05). После ТУРП средний процент резецированных фрагментов простаты в группе рака и ДГПЖ был 33,9% и 18,6%, соответственно (р=0,001). Достоверная корреляция была найдена между частотой выявления рака простаты и уровнем ПСА (р=0,01).
Выводы: пациенты с ДГПЖ и подозрением на рак простаты, имеющие симптомы нижних мочевых путей, а также предшествующие отрицательные результаты биопсии, могут быть подвергнуты ТУРП. Данная операция влечет быстрое уменьшение симптомов инфравезикальной обструкции и раннюю диагностику клинически значимого рака переходной зоны предстательной железы.
ВВЕДЕНИЕ
Заболеваемость раком предстательной железы в Корее растет, что может быть связано с вестернизацией культуры питания. Частота выявления рака простаты по данным биопсии под контролем трансректального ультразвука (ТРУЗИ) увеличивается одновременно с использованием простатспецифического антигена (ПСА) и пальцевого ректального исследования (ПРИ) в качестве скрининговых тестов. В эру ПСА выявляемость стадии Т1с также растет. Частота Т1а и Т1b стадий рака простаты до применения ПСА составляла 12,9%. Однако, при введении данного метода, частота этих стадий в конце 1990-х годов снизилась до 8,0%. Следует отметить, что статистически значимых изменений при стадии Т1а не было, а значимо снижалась выявляемость стадии Т1b [1].
Когда при повышенном уровне ПСА проводится ТРУЗИ-биопсия, частота выявления рака простаты может значительно варьировать в зависимости от таких факторов, как локализация опухоли, количество точек и методика проведения. Выявляемость рака по данным ТРУЗИ-биопсии с помощью рандомизированной секстантной методики 25-30%; частота рака простаты по данным секстантной биопсии расширенной на медиальные отделы до 10 и 12 точек освещена многими институтами [2,3]. С увеличением количества вколов, частота возникновения ректального кровотечения, гематурии, лихорадки и боли значимо не увеличивается, а число неоправданных повторных вмешательств снижается [3]. Даже при отрицательных результатах первой ТРУЗИ-биопсии, повторный забор тканей рекомендуется только при наличии клинических подозрений на рак простаты, таких как повышение уровня ПСА или данные ПРИ [4]. Однако, если опухоль располагается в переходной зоне, выявить ее с помощью биопсии трудно. Таким образом, трансуретральная биопсия или трансуретральная резекция простаты (ТУРП) в некоторых случаях является предпочтительным методом [4]. Рак переходной зоны обнаруживается преимущественно в передней части простаты, труднодоступной для ТРУЗИ-биопсии [5]. Целью данного исследования была оценка значимости раннего выявления рака переходной зоны простаты по данным ТУРП. ТУРП проводилась по поводу доброкачественной гиперплазии простаты (ДГПЖ) у пациентов с симптомами нижних мочевых путей (СНМП), причем подозрение на рак оставалось несмотря на отрицательные результаты ТРУЗИ-биопсии.
МАТЕРИАЛЫ И МЕТОДЫ:
В исследование вошло 165 пациентов с ДГПЖ и СНМП, подвергнутых ТУРП с января 2006 по январь 2009гг. ТРУЗИ-биопсия проводилась при уровне ПСА более 4нг/мл или анормальных результатах ПРИ. Пациенты с гистологически подтвержденным раком простаты по данным ТРУЗИ-биопсии из исследования исключались. Больным с инфравезикальной обструкцией и СНМП через 1 месяц после биопсии проводилась ТУРП с целью облегчения симптомов. ТРУЗИ-биопсия из 12 точек (2 из переходной зоны) выполнялась в соответствии с протоколом. Дополнительные вколы проводились в гипоэхогенные зоны. Проведен ретроспективный анализ историй болезни. Учитывался балл по шкале простатических симптомов (IPSS), уровень ПСА, данные ПРИ, результаты ТУРП (включая объем резецированной ткани и патологические данные), ТРУЗИ и ТРУЗИ-биопсии.
Пациенты, которым проводилась ТРУЗИ-биопсия простаты вошли в группу А. Больные, которым данное вмешательство не выполнялось, составили группу В. Группы сравнивались по частоте рака простаты. Группа А была разделена на две подгруппы: А1 – по данным ТУРП диагностирован РПЖ и А2 – по данным ТУРП диагностирована ДГПЖ.
Две группы сравнивались по таким параметрам, как балл по шкале IPSS/(QoL), уровень ПСА, данные ПРИ и ТРУЗИ, объем простаты и плотность ПСА. Пациенты группы А также были разделены и сопоставлены в зависимости от возраста (<=65 лет, 66-75 лет, >=75 лет), данных ПРИ и уровня ПСА (<=4нг/мл, 4-10нг/мл, >=10нг/мл). У пациентов с диагностированным после ТУРП раком простаты учитывалась клиническая стадия и суммарный балл по шкале Глисона. Статистический анализ проведен с помощью критерия точности кси-квадрат, критерия Фишера и критерия линейно-линейной зависимости. Применялась программа статистической обработки SPSS 13.0. Значимыми считался р меньше 0,05.
РЕЗУЛЬТАТЫ:
Рак простаты выявлен у 13 пациентов (7,9%), 8 из которых имели стадию Т1а (4,8%), 5 - стадию Т1b (3%). В группу А вошло 65 больных подвергнутых ТРУЗИ-биопсии до ТУРП, пяти из которых (7,7%) был диагностирован рак простаты. В группе В рак диагностирован у 8 пациентов (8,0%) (табл. 1).
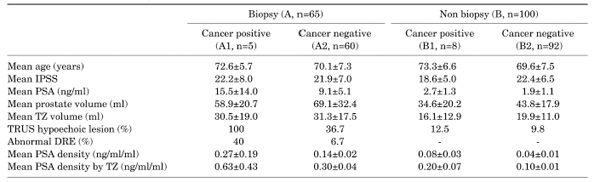
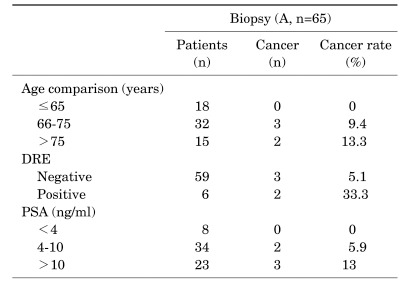
В группе А, средний возраст пациентов составил 72,6±5,7 (медиана: 70 лет; вариация 66-80 лет) и 70,1±7,3 лет в подгруппах А1 и А2, соответственно. Статистически значимых различий по возрасту в двух группах не было (р=0,458) (табл. 1). Балл по шкале IPSS в группе А1 и группе А2 был 22,2±8,0 (медиана:24; вариация 11-32) и 21,9±7,0, соответственно (р=0,092) (табл. 1). Средний уровень ПСА в подгруппе А1 (15,5±14,0 нг/мл; медиана :7,3; вариация 3,1-32,4) оказался выше, чем в А2 (9,1±5,1 нг/мл), но без статистически значимых различий (р=0,368) (табл. 1). Средний объем простаты был 58,8±20,7 мл (медиана 62,6; вариация 34,7-88,8 мл) в группе А1 и 69,1±32,4 мл в группе А2 (р=0,493) (табл. 1). Средний объем переходной зоны составил 30,5±19,0 мл (медиана: 23,3; вариация 8,0-55,5 мл) в группе А1 и 31,3±17,5 мл в группе А2 (р=0,750) (табл. 1). Обнаружены значимые различия в частоте гипоэхогенных очагов по данным ТРУЗИ между подгруппой А1, где она была 100,0% (р=0,01) (табл. 1) и подгруппой А2 с частотой 36,7%. 40% пациентов группы А1 и 6,7% группы А2 имели патологические узлы по данным ПРИ (р=0,063) (табл. 1). Средняя плотность ПСА составила 0,27±0,19 нг/мл/см³ у пациентов А1 (медиана: 0,16; вариация 0,03-0,52 нг/мл/см³) и 0,14±0,02 нг/мл/см³ у пациентов А2 (р=0,273) (табл.1). Средняя плотность ПСА переходной зоны оказалась 0,63±0,43 нг/мл/см³ в группе А1 (медиана: 067; вариация 0,06-1,32 нг/мл/см³) и 0,30±0,04 нг/мл/мл в группе А2 (р=0,211) (табл. 1). После ТУРП, средний процент резецированных фрагментов с наличием рака был 33,9% и 18,6% в группе рака простаты и в группе ДГПЖ, соответственно (р=0,001). Отсутствовали значимые различия в выявляемости ЗНО простаты в зависимости от возраста (р=0,351, критерий линейно-линейной зависимости=0,198) (табл. 2) или данных ПРИ (р=0,063) (табл. 2). Частота рака простаты коррелировала с уровнем ПСА (р=0,01) (табл. 2).
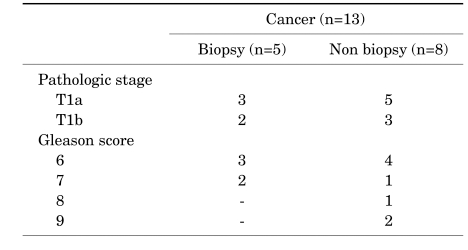
Из 13 пациентов с раком простаты 5 до ТУР проводилась биопсия, у остальных ТУРП была первичной операцией (табл. 3).
Из 5 субъектов, которым до ТУРП проводилась биопсия, 3 (4,6%) имели стадию Т1а, а 2 (3,1%) стадию Т1b. Из 8 пациентов, которым ТРУЗИ-биопсия не проводилась, 5 (5,0%) имели стадию Т1а, а 3 (3,0%) Т1b (р=1,000) (табл. 3).
При оценке по шкале Глиссона, среди пациентов перенесших ТРУЗИ-биопсию до ТУРП, у троих (60%) суммарный балл составил 6, а у двоих (40%) – 7 баллов. В случаях когда биопсия до ТУР не проводилась, 4 пациента (50%) имели суммарный балл 6, 1 (12,5%) – 7 баллов, 1 – 8 баллов и 2 (25%) – 9 баллов (р=0,641) (табл. 3).
Пациенты, которым ТРУЗИ-биопсия до ТУР не проводилась, демонстрировали более высокие показатели по шкале Глиссона, включая суммарный балл выше 7 в некоторых случаях. Однако, статистически значимых различий между группами не выявлено. Пациенты, которым диагноз рака простаты выставлялся после ТУРП, находились под активным наблюдением.
ОБСУЖДЕНИЕ
Несмотря на появление различных малоинвазивных методов хирургического лечения ДГПЖ, ТУРП остается «золотым» стандартом». ТУРП – безопасна и осуществима даже при большом объеме простаты и может заменять открытую аденомэктомию [6]. Биполярная ТУР является безопасной и эффективной альтернативой лечения [7,8], приводя к более частому применению ТУРП, даже при большом объеме органа. Однако, по нашим данным, частота выявления рака простаты после ТУРП в публикациях рассматривается редко [9].
Диагноз рака простаты стадии Т1а и Т1b выставляется на основании гистологического исследования препаратов полученных при ТУРП. Стадию Т0, Т2 и выше можно поставить только после простатэктомии. Частота выявления Т1а и Т1b рака простаты снижается по разным причинам. Во-первых, ТУРП все более вытесняется медикаментозным лечением. Во-вторых, у большинства пациентов с СНМП в качестве скринингового теста используется ПСА. В результате, пациентам которым ранее диагностировался рак простаты Т1а-Т1b, сейчас выставляется стадия Т1с. Tombal и коллеги сообщили, что за период с 1985 по 1997 гг., среди пациентов перенесших хирургическое вмешательство частота Т1а рака простаты снизилась с 23% до 7%, а Т1b с 15% до 2% [10,11]. Mai и коллеги обнаружили, что соотношение стадий Т1а и Т1b было 12,9% периоде с 1989 по 1990гг., а в периоде 1997 по 1999 оно снизилось до 8,0% [1]. По данным нашего исследования, у 13 пациентов (7,9%) из 165 рак простаты был диагностирован после ТУРП. Пациентов с Т1а и Т1b стадиями было 8 (4,8%) и 5 (3,0%), соответственно. Эти результаты схожи с другими исследованиями [1].
При подозрении на рак предстательной железы, обычно рекомендуется ТРУЗИ-биопсия. При сравнении секстантной биопсии, расширенной биопсии из 8-12 точек и других латерально-ориентированных методик, сообщаются данные о повышении частоты выявляемости рака.
В случаях стойко повышенного ПСА, выявляемость рака простаты увеличивается с 77% по данным первой ТРУЗИ-биопсии, до 99% при повторном заборе ткани [13]. Однако, ТРУЗИ-биопсия является инвазивной процедурой и может вызвать осложнения в виде инфекции, кровотечения и сепсиса. Roehl и коллеги выявили значимое снижение частоты выявления рака простаты до 10%, если результаты первых двух ТРУЗИ-биопсий были отрицательны [14]. Имеется множество сообщений о необходимости ТУРП для диагностики рака переходной зоны у пациентов со стойко повышенным ПСА и отрицательными результатами повторных биопсий. Puppo et al сообщили, что проведение ТУРП и латерализированной ТРУЗИ-биопсии у пациентов с 3 и более отрицательными биопсиями может увеличить выявляемость до 57% [6]. В последнее время результаты повторно-отрицательного рака простаты оцениваются с помощью расширенной биопсии и ТУРП. При наличии в анамнезе 2 и более отрицательных биопсий, оправданным подходом к диагностике и облегчению обструктивных симптомов будет расширенная сатурационная биопсия и одновременная ТУРП [15]. Использование ТУР с диагностической целью основано на утверждении, что рак переходной зоны простаты в основном локализуется в передней части органа, труднодоступной для ТРУЗИ-биопсии [5]. Steuber et al выявили различные биологические характеристики рака переходной зоны, указывающие на низкую степень злокачественности; в препаратах радикальной простатэктомии, сателлитные опухоли свидетельствуют о высокой злокачественности в периферической зоне [16]. В нашем исследовании в протокол ТРУЗИ-биопсии включено 2 точки переходной зоны. В случае ДГПЖ, особенно при простате весом 50г, периферическая ткань сдавливается и истончается за счет гиперплазии переходной зоны. Поэтому, столбики ткани из медиальной части периферической зоны, могут содержать ткань переходной зоны [17]. Таким образом, при наличии аденомы простаты осложненной СНМП и подозрении на рак после отрицательной ТРУЗИ-биопсии из 12 точек (простатическая интраэпителиальная неоплазии (ПИН) низкой степени, атипическая мелкоацинарная пролиферация (АМАП)), либо при стойко повышенном уровне ПСА, приемлемым методом является немедленная ТУРП, которая быстро облегчает симптомы обструкции и может выявить рак переходной зоны.
Касаемо лечения рака простаты после ТУР, Puppo и коллеги сообщают об отсутствии негативного влияния этой операции на результаты РПЭ. В опубликованных исследованиях радикальная позадилонная простатэктомия после ТУР более сложна, так как создаются условия, ухудшающие ее выполнение, такие, как перипростатический фиброз, повреждение шейки мочевого пузыря и целостности капсулы [18]. Однако, в последних сообщениях говорится о сравнимой периоперативной морбидности и функциональных результатах (удержание мочи и эректильная функция) РПЭ и РПЭ после ТУРП [19]. В последнее время после ТУР проводят лапароскопическую радикальную простатэктомию. Эта процедура осложняется искаженным хирургическим краем, но онкологически безопасна и сохраняет потенцию [20].
В нашем исследовании не выявлено статистических различий частоты рака простаты в группе с подозрениями на злокачественность (8,9%) и без таковых (7,5%). По результатам гистологического исследования у 1 пациента (12,5%) балл по шкале Глисона оказался равным 8, у двух (25%) – 9. Эти результаты свидетельствуют об относительно высокой частоте клинически значимых опухолей выявленных при ТУРП. Рак, выявленный при ТУР, подвергался оперативному лечению, например РПЭ или лапароскопической радикальной простатэктомии.
Kitamura et al утверждают, что ТУРП следует проводить только у пациентов с СНМП, так как большинство случаев клинически незначимого рака простаты диагностируются с помощью сопутствующей или секстантной биопсии переходной зоны [21]. В тоже время Renterghem и коллеги сообщили об уменьшении степени обструкции, нормализации уровня ПСА и диагностике клинически значимого рака простаты в результате ТУР [22].
В нашем исследовании, соотношение стадий Т1а и Т1b не имело значимых различий в группе А и В. Эти данные свидетельствуют о том, что ТУРП существенно не влияет на стадии Т1а и Т1b рака переходной зоны простаты. Таким образом, проведение ТУР у пациентов с предшествующими отрицательными результатами биопсии и клиническими подозрениями на рак не влияет на лечение ЗНО простаты. Кроме того, большинство случаев рака переходной зоны локализуются в передней части простаты, которая является труднодоступной для биопсии. Переходная зона захватывается при ТУРП, при этом уменьшаются симптомы инфравезикальной обструкции и диагностируется рак простаты.
ВЫВОДЫ
Стадии Т1а и Т1b рака простаты одинаково часто встречаются в группе с подозрением на ЗНО и без такового. Кроме того, ТРУЗИ-биопсия из 12 точек, включая 2 из переходной зоны, не обеспечивает надежности при заборе ткани. Поэтому, пациенты с ДГПЖ и клиническими подозрениями на рак простаты, имеющие СНМП и предшествующие отрицательные результаты ТРУЗИ-биопсии, должны быть подвергнуты ТУРП, что приводит к снижению обструктивной симптоматики и ранней диагностике клинически значимого рака переходной зоны простаты.
ТАБЛИЦА 1
Характеристики пациентов
ТАБЛИЦА 2
Частота рака простаты в зависимости от возраста, данных ПРИ и уровня ПСА
ТАБЛИЦА 3
Сравнение пациентов с раком простаты, которым проводилась или не проводилась биопсия
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Mai KT, Isotalo PA, Green J, Perkins DG, Morash C, Collins JP. Incidental prostatic adenocarcinomas and putative premalignant lesions in TURP specimens collected before and after the introduction of prostate-specific antigen screening. Arch Pathol Lab Med. 2000;124:1454–1456. [PubMed]
2. Cho KJ, Ha US, Lee CB. Role of transurethral resection of the prostate in the diagnosis of prostate cancer for patients with lower urinary tract symptoms and serum PSA 4-10 ng/ml with a negative repeat transrectal needle biopsy of prostate. Korean J Urol. 2007;48:1010–1015.
3. Mariappan P, Chong WL, Sundram M, Mohamed SR. Increasing prostate biopsy cores based on volume vs the sextant biopsy: a prospective randomized controlled clinical study on cancer detection rates and morbidity. BJU Int. 2004;94:307–310. [PubMed]
4. O'dowd GJ, Miller MC, Orozco R, Veltri RW. Analysis of repeated biopsy results within 1 year after a non cancer diagnosis. Urology. 2000;55:553–559. [PubMed]
5. Eggener SE, Roehl KA, Catalona WJ. Predictors of subsequent prostate cancer in men with a prostate specific antigen of 2.6 to 4.0 ng/ml and an initially negative biopsy. J Urol. 2005;174:500–504. [PubMed]
6. Kwak DY, Chang HS, Park CH, Kim CI. Long-term results of transurethral resection of the prostate for large benign prostatic hyperplasia: a comparative study with open prostatectomy. Korean J Urol. 2008;49:31–36.
7. Kim JY, Moon KH, Yoon CJ, Park TC. Bipolar transurethral resection of the prostate: a comparative study with monopolar transurethral resection. Korean J Urol. 2006;47:493–497.
8. Kim HG, Lee BK, Paick SH, Lho YS. Efficacy of bipolar transurethral resection of the prostate: comparison with standard monopolar transurethral resection of the prostate. Korean J Urol. 2006;47:377–380.
9. Puppo P, Introini C, Calvi P, Naselli A. Role of transurethral resection of the prostate and biopsy of the peripheral zone in the same session after repeated negative biopsies in the diagnosis of prostate cancer. Eur Urol. 2006;49:873–878. [PubMed]
10. Fowler JE, Jr, Pandey P, Bigler SA, Yee DT, Kolski JM. Trends in diagnosis of stage T1a-b prostate cancer. J Urol. 1997;158:1849–1852. [PubMed]
11. Tombal B, De Visccher L, Cosyns JP, Lorge F, Opsomer R, Wese FX, et al. Assessing the risk of unsuspected prostate cancer in patients with benign prostatic hypertrophy: a 13-year retrospective study of the incidence and natural history of T1a-T1b prostate cancers. BJU Int. 1999;84:1015–1020. [PubMed]
12. Monda JM, Barry MJ, Oesterling JE. Prostate specific antigen cannot distinguish stage T1a (A1) prostate cancer from benign prostatic hyperplasia. J Urol. 1994;151:1291–1295. [PubMed]
13. Ahn HS, Kwon CH, Joo KJ. Comparative analysis of the prostate cancer detection rate according to region and number of biopsy in patient with elevated serum PSA. Korean J Urol. 2006;47:591–595.
14. Roehl KA, Antenor JA, Catalona WJ. Serial biopsy results in prostate cancer screening study. J Urol. 2002;167:2435–2439. [PubMed]
15. Ploussard G, Dubosq F, Boublil V, Allory Y, de la Taille AD, Vordos D, et al. Extensive biopsies and transurethral prostate resection in men with previous negative biopsies and high or increasing prostate specific antigen. J Urol. 2009;182:1342–1349. [PubMed]
16. Steuber T, Karakiewicz PI, Augustin H, Erbersdobler A, Haese A, Chun KH, et al. Transition zone cancers undermine the predictive accuracy of Partin table stage predictions. J Urol. 2005;173:737–741. [PubMed]
17. Hwang SI, Lee HJ, Cho JY, Kim SH, Lee SE, Byun SS, et al. Should transition zone biopsies be added to 12-core systematic biopsies of the prostate? J Clin Ultrasound. 2009;37:281–284. [PubMed]
18. Djavan B, Mazal P, Zlotta A, Wammack R, Ravery V, Remzi M, et al. Pathological features of prostate cancer detected on initial and repeat prostate biopsy: results of the prospective European Prostate Cancer Detection study. Prostate. 2001;47:111–117. [PubMed]
19. Palisaar JR, Wenske S, Sommerer F, Hinkel A, Noldus J. Open radical retropubic prostatectomy gives favourable surgical and functional outcomes after transurethral resection of the prostate. BJU Int. 2009;104:611–615. [PubMed]
20. Teber D, Cresswell J, Ates M, Erdogru T, Hruza M, Gözen AS, et al. Laparoscopic radical prostatectomy in clinical T1a and T1b prostate cancer: oncologic and functional outcomes--a matched-pair analysis. Urology. 2009;73:577–581. [PubMed]
21. Kitamura H, Masumori N, Tanuma Y, Yanase M, Itoh N, Takahashi A, et al. Does transurethral resection of the prostate facilitate detection of clinically significant prostate cancer that is missed with systematic sextant and transition zone biopsies? Int J Urol. 2002;9:95–99. [PubMed]
22. van Renterghem K, Van Koeveringe G, Achten R, Van Kerrebroeck P. Clinical relevance of transurethral resection of the prostate in "asymptomatic" patients with an elevated prostate-specific antigen level. Eur Urol. 2007;52:819–826. [PubMed]












Комментарии