А.В. Сивков, В.И. Кирпатовский
Сведения об авторах:
- Сивков А.В. – к.м.н., заместитель директора по науке НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ Аuthor ID 622663
- Кирпатовский В.И. – д.м.н., профессор, гл. научный сотрудник НИИ урологии и интервенционной радиологии им. Н.А.Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ Аuthor ID 604441
ВВЕДЕНИЕ
Медикаментозное лечение – важная стратегия коррекции расстройств мочеиспускания у больных доброкачественной гиперплазией предстательной железы (ДГПЖ). Современная медикаментозная терапия позволяет достоверно уменьшить выраженность симптомов и длительно сохранять качество жизни пациентов на достаточно высоком уровне [1, 2].
В ряде стран Западной Европы, в частности Италии, Германии, Австрии, при лечении пациентов с ДГПЖ, страдающих расстройством мочеиспускания, очень популярна терапия препаратами растительного происхождения. Наиболее часто используют препараты Serenoa Repens (SRE) – синонимы – Sabal serrulata, Saw palmetto [3].
МАТЕРИАЛЫ И МЕТОДЫ
При написании обзора были использованы база данных PubMed (https://www.ncbi.nlm.nih.gov/pubmed/) и научная электронная библиотека Elibrary.ru (https:// elibrary.ru/). Ключевыми словами поиска статей по теме обзора были «BPH», «therapy of urinary dysfunction», «Serenoa repens», «Permixon», «mechanism of action», «bladder receptors». В результате были отобраны 48 публикаций в рецензируемых зарубежных и отечественных журналах.
РЕЗУЛЬТАТЫ
Состав и действие различных компонентов SRE
Экстракты Serenoa repens изготавливают из зрелых плодов американской карликовой пальмы. Такие препараты являются одним из наиболее популярных видов фитотерапии ДГПЖ. В США почти 2,5 млн. человек принимают препараты SRE [4].
Все препараты на основе Serenoa repens представляют собой смесь экстрагированных из плодов пальмы тем или иным способом липидов: путем сверхкритической флюидной экстракции диоксидом углерода под повышенным давлением; экстрации гексаном; этанолом или диэтиловым эфиром. Пермиксон (Pierre Fabre) является гексановым липидно-стерольным экстрактом [5]. Имеются данные, что при использовании препаратов с гексановой экстракцией липидных компонентов более часто выявляли положительный эффект терапии, чем при других видах экстракции [6-8].
Установлено, что наибольшую долю в экстрактах Serenoa Repens, включая Пермиксон, занимают жирные кислоты (93%): насыщенные (60%) и ненасыщенные (около 33%). Среди насыщенных жирных кислот преобладают лауриновая (30%), миристиновая (12%) и пальмитиновая кислоты (9,5%). Другие кислоты (капроиковая, каприловая, каприковая, стеариновая) содержатся в значительно меньшей доле (1,5-2,5%). Среди ненасыщенных жирных кислот преобладает олеиновая кислота (28%), в значительно меньшем количестве содержится линолевая кислота (4,6%) и в минимальном – линоленовая кислота (0,6%). В минимальных количествах SRE также содержат: жирные спирты (гексакозаноловый, октакозаноловый, тетракозаноловый и триконтаноловый – 0,146 – 0,003%) и стеролы (кампрестерол, стигмастерол и β-стигмастерол – 0,22 – 0,03%) [9, 10].
При этом F.K. Habib и M.G. Wyllie отмечают, что в различных торговых марках содержание этих компонентов может сильно варьировать. По данным этих авторов, содержание свободных жирных кислот варьировало от 40,7% до 80,7%, метиловых и этиловых эфиров этих кислот – от 1,5% до 16,7%, а их глицеридных форм – от 6,8% до 52,2% [10]. Такие различия могут быть связаны с источниками сырья, видом их обработки, методом экстракции и могут влиять на биологическую эффективность препаратов [9].
Это мнение позже было подтверждено A. Booker и соавт., которые с помощью газовой хроматографии и 1H ядерно-магнитной спектроскопии определили метаболический профиль большой группы препаратов SRE [11]. Были выявлены существенные различия как в содержании в препаратах различных жирных кислот, так и в их суточных дозах, получаемых пациентами (рис. 1-2).
![Процентное содержание отдельных жирных кислот, измеренное в 19 различных препаратах SRE [11] Процентное содержание отдельных жирных кислот, измеренное в 19 различных препаратах SRE [11]](http://ecuro.ru/sites/default/files/issue/2020-4/13-1.jpg)
Рис. 1. Процентное содержание отдельных жирных кислот, измеренное в 19 различных препаратах SRE [11].
Fig. 1. Percentage of separate acids measured in 19 different SRE preparations
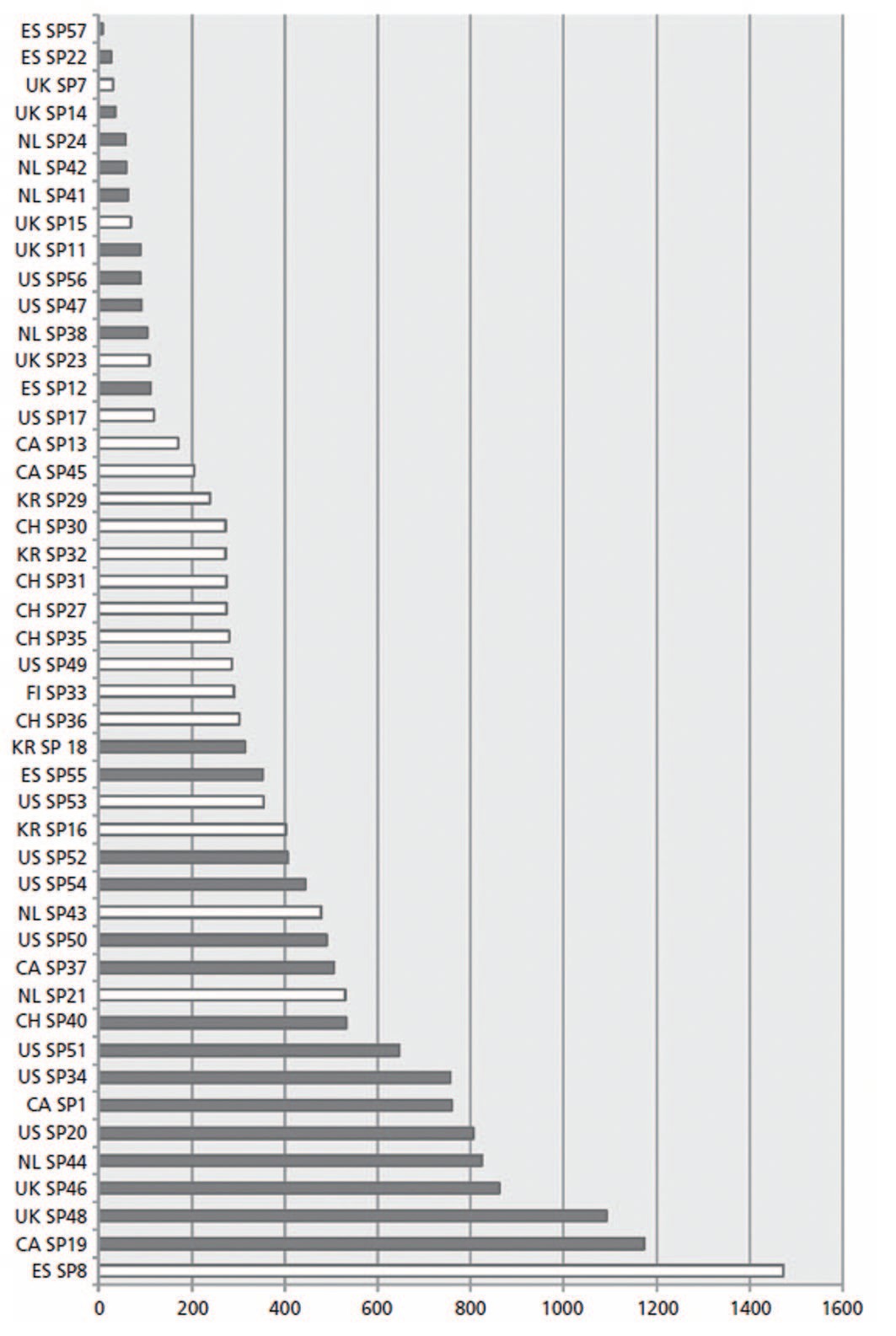
Риc. 2. Суточная доза жирных кислот в разных препаратах SRE основана на самой низкой суточной дозировке, указанной на упаковке для каждого анализируемого продукта: белым цветом отмечены монопрепараты SRE, темным – комбинированные средства [11]
Fig. 2. The daily dose of fatty acids in different SRE preparations is based on the lowest daily dose indi-cated on the packaging for each analyzed product: the SRE monopreparations are marked in white, the combined preparations are marked in dark [11]
Как многие фитопрепараты, Пермиксон обладает многокомпонентным механизмом действия. Большинство авторов указывают, что он способен ингибировать 5α-редуктазу, оказывать антиандрогенный, антипролиферативный, противовоспалительный и противоотечный эффекты [12]. При этом установлено, что разные составляющие экстракта оказывают различное фармакологическое действие.
Ингибирующее действие Пермиксона на 5α-редуктазу (5α-Р), приводящее к снижению тканевой концентрации дигидротестостерона (ДГТ) и повышению концентрации тестостерона, реализуется преимущественно за счет действия лауриновой и линоленовой кислот, которые подавляют активность как 1-й, так и 2-й изоформ фермента. Олеиновая кислота активна только в отношении 1-й изоформы, а миристиновая – только в отношении 2-го изофермента. Пальмитиновая, стеариновая кислоты, эфиры жирных кислот, стеролы и спирты не влияют на активность 5α-Р [13].
Фитостеролы, входящие в состав SRE оказывают противовоспалительное и противоотечное действие за счет ингибирования циклооксигеназы и 5-липооксигеназы, являющихся медиаторами воспалительного процесса [12].
Если антиандрогенный, антипролиферативный, противовоспалительный и противоотечный эффекты SRE широко обсуждают в литературе, то о возможном альфаблокирующем и холинолитическом действии экстрактов пишут существенно реже. Тем не менее было показано, что олеиновая и лауриновая кислоты также активно связываются с α-адренорецепторами (α-АР), оказывая адреноблокирующее действие [14].
Связывание компонентами SRE альфа-1-адренергических (α1-АР) и мускариновых рецепторов предстательной железы и мочевого пузыря крыс было подтверждено M. Suzuki и соавт. с использованием радиолигандного метода. Крысы получили SRE (от 0,6 до 60 мг/кг/сут) или плацебо перорально в течение 4 недель. Авторы показали, что SRE ингибирует специфическое связывание [3H]празозина и [N-метил-3H]скополамин-метил-хлорида (NMS), но не αβ-метилен-аденозинтрифосфата [2,8-3H]тетранатрия. Связывающая активность SRE в отношении мускариновых рецепторов оказалась в 4 раза выше, чем в отношении α1-АР. Анализ показал, что SRE достоверно уменьшает число точек связывания для каждого радиолиганда в ткани предстательной железы и мочевого пузыря. Повторное назначение SRE приводило к достоверному нарушению связывания [3H]празозина в ткани предстательной железы и [3H]NMS – в мочевом пузыре крыс. Такие изменения, вызываемые SRE, оказались селективными в отношении рецепторов мочевого тракта [15].
Некоторые данные об эффективности SRE при расстройствах мочеиспускания у больных СНМП / ДГПЖ
Пермиксон используют в клинической практике уже более 30 лет. Многочисленные и масштабные исследования демонстрируют выраженный симптомами нарушения функции нижних мочевых путей (СНМП) / ДГПЖ. Так, в метаанализе R. Vela-Navarrete и соавт. продемонстрировано на фоне терапии Пермиксоном уменьшение симптомов по шкале IPSS (международная система суммарной оценки симптомов болезней предстательной железы в баллах), в большинстве исследований в среднем на 5,73 балла. Там же показано увеличение максимальной скорости потока мочи (Qmax) в среднем на 2,89 мл/сек и уменьшение ноктурии в среднем на 1,56 эпизода [16].
В двойном слепом рандомизированном исследовании PERMAL сравнивали эффективность и безопасность 12-месячной терапии Пермиксоном (320 мг/сут) и тамсулозином (0,4 мг/сут). Основными критериями включения были: IPSS > 10; Qmax от 5 до 15 мл/сек при объеме мочеиспускания более 150 мл; объем предстательной железы более 25 см3 и уровень ПСА менее 4 нг/мл или в интервале от 4 до 10 нг/мл при соотношении свободного к общему ПСА > 15%. В целом, 685 мужчин после 4 недель приема плацебо были рандомизированы на группы: 340 больных, получавших Пермиксон и 345 больных – тамсулозин [17]. При анализе результатов лечения было продемонстрировано улучшение симптомов и показателей мочеиспускания, однако достоверных различий между группами достигнуто не было (табл. 1).
Таблица 1. Динамика показателей IPSS и Qmax в общих группах исследования PERMAL [адаптировано из 17]
Table 1. Dynamics of IPSS and Qmax in the general groups of the PERMAL study [adapted from 17]
| Показатель Index |
Препарат A drug |
До лечения Before treatment |
Через 12 мес. After 12 months |
Δ | p |
|---|---|---|---|---|---|
| IPSS | Пермиксон Permixon |
15,3 (4,3) | 10,8 (5,5) | - 4,4 (5,5) | 0,99 |
| Тамсулозин Tamsulosin |
15,4 (5,2) | 11,0 (6,0) | - 4,4 (5,1) | ||
| IPSS (симптомы фазы накопления) IPSS (accumulation phase symptoms) |
Пермиксон Permixon |
6,6 (2,5) | 5,0 (2,7) | - 1,7 (2,8) | 0,92 |
| Тамсулозин Tamsulosin |
6,4 (2,8) | 4,9 (2,9) | - 1,5 (2,4) | ||
| IPSS (симптомы фазы опорожнения) IPSS (emptying phase Symptoms) |
Пермиксон Permixon |
8,6 (3,2) | 5,9 (3,5) | - 2,8 (3,7) | 0,95 |
| Тамсулозин Tamsulosin |
9,0 (3,5) | 6,1 (3,9) | - 2,9 (3,7) | ||
| Максимальноая скорость потока мочи Maximum urine flow rate |
Пермиксон Permixon |
10,9 (3,9) | 12,7 (5,2) | + 1,9 (4,8) | 0,79 |
| Тамсулозин Tamsulosin |
11,2 (4,0) | 13,0 (4,9) | + 1,8 (4,8) |
При более глубоком анализе симметричных групп пациентов с выраженными симптомами (IPSS > 19), в которые были рандомизированы 65 мужчин, получавших Пермиксон и 59 – тамсулозин, было показано достоверное преимущество Пермиксона по влиянию на СНМП. Так, снижение общего балла IPSS через 12 месяцев лечения составило 7,8 в группе Пермиксона и 5,8 – у получавших тамсулозин (ANCOVA p=0,0508). Уменьшение симптомов фазы накопления (ирритативных) в группах Пермиксона и тамсулозина было равно 2,9 и 1,9 соответственно (ANCOVA p=0,0489). Симптомы фазы опорожнения (обструктивные) также снизились на 4,9 (4,28) и 3,9 (4,49) соответственно (ANCOVA p=0,0792). Изменение других показателей оказалось статистически недостоверным [18].
Частота клинически значимых ответов (снижение IPSS > 3) составила 80,0% и 71,2% в группах Пермиксона и тамсулозина, соответственно. У 41,5% мужчин, получавших Пермиксон, по сравнению с 25,4%, принимавших тамсулозин, отмечено снижение, по крайней мере, на 9 баллов IPSS. А клинически значимое ухудшение (увеличение IPSS на 4 балла) наблюдали лишь у 1,5% в группе Пермиксона и у 6,8% пациентов, получавших тамсулозин (рис. 3).
![Кумулятивная доля пациентов (%), в зависимости от величины изменения общего балла IPSS [18]. Уменьшение сумы баллов в % - отрицательные значения на графике, увеличение суммы баллов – положительные значения. Кумулятивная доля пациентов (%), в зависимости от величины изменения общего балла IPSS [18]. Уменьшение сумы баллов в % - отрицательные значения на графике, увеличение суммы баллов – положительные значения.](http://ecuro.ru/sites/default/files/issue/2020-4/13-3.jpg)
Рис. 3. Кумулятивная доля пациентов (%), в зависимости от величины изменения общего балла IPSS [18]. Уменьшение сумы баллов в % - отрицательные значения на графике, увеличение суммы баллов – положительные значения.
Fig. 3. Cumulative proportion of patients (%), depending of the change in the total IPSS score [18]. Reducing the sum of points in % - negative values on the chart, increasing the sum of points-positive values
Механизм действия SRE: «мишень» – только предстательная железа или еще и мочевой пузырь?
Традиционно улучшение параметров мочеиспускания у больных ДГПЖ при терапии Пермиксоном связывают с его действием на гиперплазированную предстательную железу, в частности с антиандрогенныи эффектом за счет ингибирования 5-α-редуктазы, с антипролиферативным действием и с уменьшением хронического воспаления, часто сопровождающим ДГПЖ [12, 26, 27].
Однако накопленые данные в отношении патогенеза дисфункции мочеиспускания у больных ДГПЖ дают основание считать, что не следует рассматривать только предстательную железу в качестве «мишени» терапевтических воздействий, но нужно учитывать изменения, происходящие и в самом мочевом пузыре [28]. Многие авторы в патогенезе расстройств мочеиспускания у больных с ДГПЖ основное значение придают развитию инфравезикальной обструкции. Однако у значительной части пациентов, помимо затруднения мочеиспускания, выявляют симптомы гиперактивности детрузора, причем в 10-35% случаев эти симптомы сохраняются после оперативного лечения и устранения механической обструкции уретры [29, 30]. Таким образом, дисфункция мочеиспускания у больных ДГПЖ может быть в большей или меньшей степени обусловлена патологическими изменениями в мочевом пузыре [31, 32], а эффект медикаментозной терапии расстройств мочеиспускания, в том числе Пермиксоном, может быть в определенной степени обусловлен действием препаратов на патологические процессы в детрузоре, приводящим к улучшению его функции.
Хотя в литературе имеется немного данных о влиянии SRE на мочевой пузырь, тем не менее в ряде публикаций представлены данные, свидетельствующие, что механизм действия этих препаратов затрагивает влияние на метаболические процессы, происходящие не только в гиперплазированной предстательной железе, но и в мочевом пузыре. Клинические исследования, представленные в предыдущем разделе, показывают, что терапия SRE больных ДГПЖ способствует уменьшению симптомов накопления и ноктурии, то есть симптомов, связанных непосредственно с функциональным состоянием мочевого пузыря.
Возможными механизмами воздействия SRE на мочевой пузырь являются описанные выше: способность блокировать α1-адренорецепторы, М-холинолитический и противовоспалительный эффекты.
Рассматривая влияние SRE на α-адренорецепторы, следует учитывать, что они представлены не только в предстательной железе, но и в мочевом пузыре, в частности в области его шейки и простатическом отделе уретры [33]. Поэтому при системном назначении препарата он может взаимодействовать с α1-адренорецепторами как предстальной железы, так и мочевого пузыря (рис. 4).
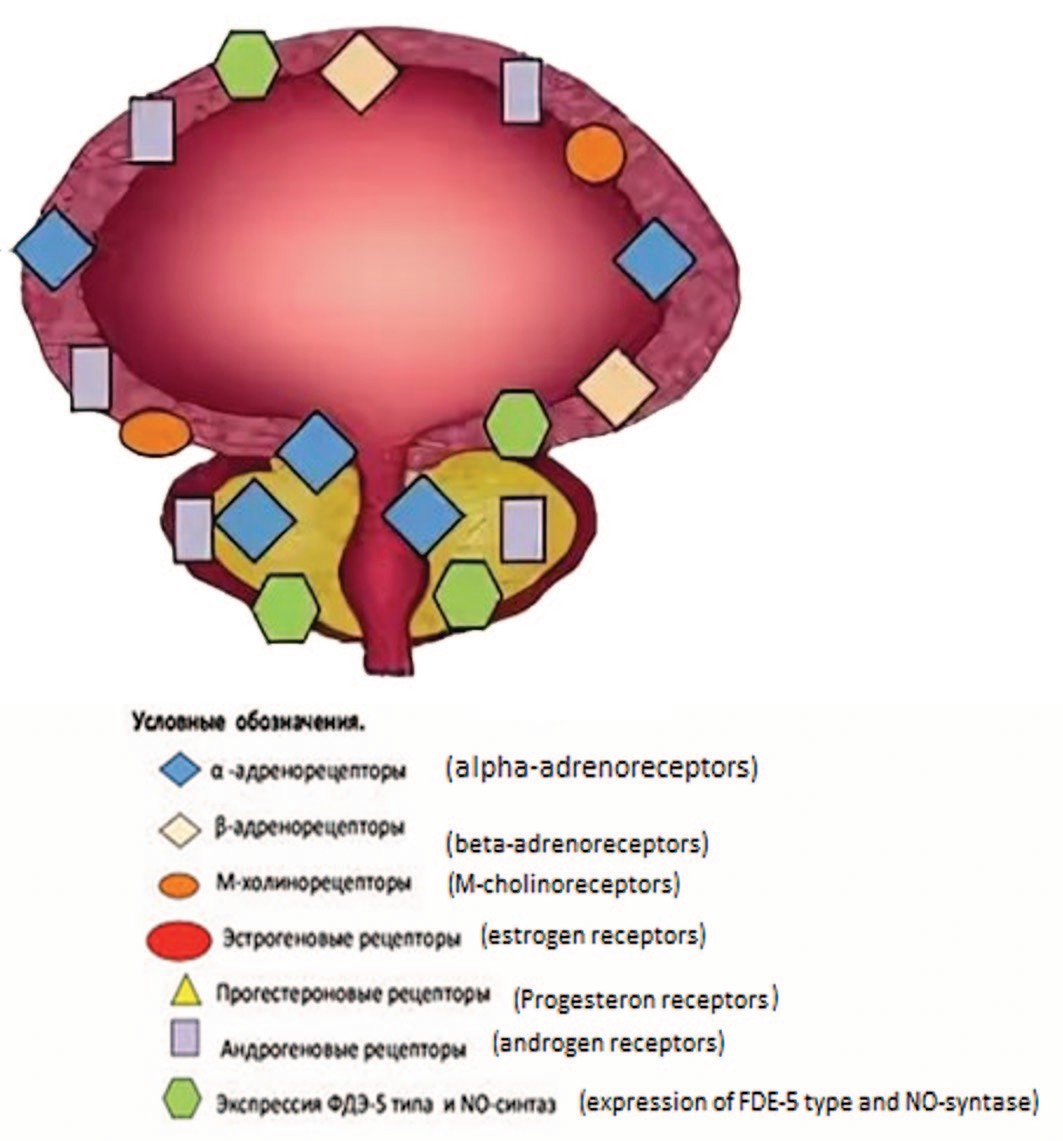
Рис. 4. Схема распределения различных типов рецепторов в мочевом пузыре и предстательной железе
Fig. 4. Distribution of different types of receptors in the bladder and prostate gland
В экспериментах in vitro и in vivo подтверждено, что SRE связывается с рецепторами автономной нервной системы нижних мочевых путей, включая как предстательную железу, так и мочевой пузырь [15, 34, 35]. SRE препятствовал in vitro связыванию Н3-празозина (антагонист α-адренорецепторов) и Н3-N-метилскополамина (антагонист М-холинорецепторов), не влияя на связывание αβМе-АТФ (антагонист пуринэргических рецепторов) с тканями предстательной железы и мочевого пузыря, в дозозависимом отношении, что свидетельствует о его способности блокировать α1-адренорецепторы и М-холинорецепторы не только в железе, но и в мочевом пузыре. При этом способность к связыванию с М-холинорецепторами, которые широко представлены в детрузоре , была в 2-4 раза выше, чем с α-адренорецепторами (рис. 4). Установлено, что SRE блокирует 45% мест связывания для Н3-празозина и Н3-N-метилскополамина как в ПЖ, так и в мочевом пузыре [15, 35].
В опытах in vivo M. Suzuki и соавт. при пероральном введении SRE крысам в течение 4 недель выявили значительное снижение мест связывания М-холинорецепторов в мочевом пузыре и в слюнной железе (как орган сравнения), причем эффект SRE на холинорецепторы мочевого пузыря проявлялся в значительно меньших дозах препарата (0,6 и 6 мг/кг в сутки), чем на рецепторы слюнной железы (60 мг/кг в сутки), что свидетельствует о большей тропности экстракта к клеткам мочевого пузыря. В то же время количество мест связывания α-адренорецепторов в предстательной железы при дозе препарата 6 мг/кг в сутки возрастало.
То есть улучшение мочеиспускания у больных ДГПЖ, помимо снижения тонуса предстательной железы и простатической части уретры, в определенной степени обусловлено его действием на рецепторы мочевого пузыря. Блокада α1-адренорецепторов шейки мочевого пузыря также способствует снижению сопротивления потоку мочи при мочеиспускании, а блокада М-холинорецепторов препятствует детрузорной гиперактивности.
Помимо действия на адрено- и холинорецепторы мочевого пузыря, SRE способны ингибировать ваниллоидные рецепторы 1-го типа (TRPV1). Эти рецепторы локализуются в эпителии мочевого пузыря и участвуют в нейрогенной регуляции мочеиспускания, вероятно, во взаимодействии с TRPV1 нервных волокон [36, 37]. Активацию TRPV1 отмечали при развитии гиперактивности детрузора. Позже, в эксперименте T. X. Phan и соавт. продемонстрировали выраженную экспрессию TRPV1 в сенсорных нервах и артериолах гладких мышц мочевого пузыря. Авторы считают, что экспрессия TRPV1 отражает капсаицин-вызванное поступление Са2+ в клетки артериол гладких мышц мочевого пузыря и сужение артериол мочевого пузыря [38]. В публикации M. Suzuki и соавт. [39] упоминается исследование Ito Y. и соавт., в котором показано, что SRE способен значительно ингибировать индуцированный капсаицином приток Са2+ в культуре клеток, экспрессирующей рецепторы TRPV1. В этой работе также продемонстрировано, что SRE ингибирует специфическое связывание [3H]-резинфератоксина в культуре клеток, в зависимости от концентрации. Авторы предполагают, что SRE ингибирует активацию ваниллоидных рецепторов 1 типа в мочевом пузыре. Приведенные факты объясняют эффективность SRE в отношении симптомов фазы накопления у больных ДГПЖ.
Это мнение нашло отражение в результатах экспериментов in vivo на крысах с индуцированным циститом.
S. Nasrin и соавт. изучали влияние SRE на уродинамические показатели, мускариновые и пуринергические рецепторы мочевого пузыря, а также цитокины в моче у крыс с геморрагическим циститом, индуцированным циклофосфамидом (150 мг/кг внутрибрюшинно). SRE (60 мг/кг в сутки) вводили крысам перорально два раза в день в течение 7 дней. Уродинамические параметры у крыс контролировали цистометрическим методом под наркозом. Мускариновые и пуринергические рецепторы в мочевом пузыре и подчелюстной железе были измерены с помощью радиорецепторного метода, с использованием [N-метил-3Н] хлорид скополамина и αβ-метилен-АТФ [2,8-3Н] соли тетранатрия, соответственно. Уровень цитокинов мочи (IL-1β, IL-6 и L-17) измеряли с помощью наборов для иммуноферментного анализа. У крыс с индуцированным циститом интервал между мочеиспусканиями и объемы мочеиспусканий были значительно уменьшены, а частота мочеиспусканий и базальное давление – значительно увеличены.
Пероральное введение SRE значительно увеличивало интервал между мочеиспусканиями и объем мочеиспусканий, а также снизило частоту мочеиспусканий и величину внутрипузырного давления (рис. 5). При этом уровень интерлейкинов IL-1β, IL-6 и L-17 в моче достоверно снижался [40] (рис. 5, 6).
![Результаты цистометрии у крыс, получавших плацебо (а), с индуцированным циститом (b) и получавших SRE (с) [40]. Результаты цистометрии у крыс, получавших плацебо (а), с индуцированным циститом (b) и получавших SRE (с) [40].](http://ecuro.ru/sites/default/files/issue/2020-4/13-5.jpg)
Рис. 5. Результаты цистометрии у крыс, получавших плацебо (а), с индуцированным циститом (b) и получавших SRE (с) [40].
Fig. 5. Results of cystometry in rats receiving placebo (a), with induced cystitis (b) and receiving SRE (c) [40]
![Показатели IL-1β (a), IL-6 (b) и IL-17 (c) в моче у крыс, получавших плацебо, с индуцированным циститом и получавших SRE [40] Показатели IL-1β (a), IL-6 (b) и IL-17 (c) в моче у крыс, получавших плацебо, с индуцированным циститом и получавших SRE [40]](http://ecuro.ru/sites/default/files/issue/2020-4/13-6.jpg)
Рис. 6. Показатели IL-1β (a), IL-6 (b) и IL-17 (c) в моче у крыс, получавших плацебо, с индуцированным циститом и получавших SRE [40]
Fig. 6. Indicators of IL-1β (a), IL-6 (b) and IL-17 (c) in the urine of rats treated with placebo, with induced cystitis and treated with SRE [40]
В другом, уже упомянутом исследовании T. Oki и соавт., также исследовали методом цистометрии функцию мочевого пузыря у крыс с циститом, вызванным введением 0,1% уксусной кислоты. Интрадуоденальное введение SRE (12, 20 или 60 мг/кг) при цистометрии анестезированных крыс вызывало значительное и дозозависимое увеличение интервалов между мочеиспусканиями, объемов мочеиспусканий и емкости мочевого пузыря при внутрипузырной инфузии физиологического раствора. Кратное пероральное введение SRE в дозе 6 мг/кг ежедневно, постепенно привело к увеличению интервалов между мочеиспусканиями и, одновременно, – к снижению частоты опорожнения мочевого пузыря [34].
Таким образом, улучшение СНМП и параметров уродинамики, наблюдаемое при терапии SRE больных ДГПЖ, может, помимо известного воздействия на предстательную железу, быть обусловлено влиянием препарата на адрено-, холино- и ваниллоидные рецепторы мочевого пузыря.
Антипролиферативный эффект – важный механизм действия SRE, вероятно, проявляется не только в отношении клеток предстательной железы, но и мочевого пузыря. По данным J.V. Espinosa-Juárez и соавт., у крыс с моделированным метаболическим синдромом, терапия липидным SRE препятствовала развитию не только гиперплазии и гипертрофии предстательной железы с нормализацией контрактильности ее гладкомышечных элементов, но и приводила к снижению пролиферативной активности клеток мочевого пузыря и нормализации упорядоченности его гладкомышечных волокон, нарушенной у крыс контрольной серии [41].
Противовоспалительное действие SRE активно используют при лечении пациентов с СНМП/ДГПЖ, у которых нередко присутствуют признаки хронического воспаления предстательной железы. Подавление воспалительной реакции вносит существенный вклад в улучшение мочеиспускания и предотвращение прогрессирования ДГПЖ. На фоне терапии Пермиксоном, наряду с уменьшением гистологических признаков воспаления в предстательной железе, снижается экспрессия основных маркеров воспалительной реакции [42, 43].
Однако хронический абактериальный воспалительный процесс развивается и в обструктивном мочевом пузыре, с развитием анатомических и функциональных изменений в клетках детрузора и уротелии [44]. S. Inamura и соавт. полагают, что развитие гиперактивности детрузора у больных ДГПЖ может быть также следствием воспалительного процесса в мочевом пузыре, а не в гиперплазированной предстательной железе [45].
В исследовании P.S. de Conti и соавт. у 71 больного с ДГПЖ, подвергнутого оперативному лечению – трансуретральной резекции предстательной железы, определяли уровень маркеров воспалительной реакции до и в разные сроки после операции (до 12 месяцев). Было установлено, что более высокий уровень матриксной металлопротеазы-1 (ММП-1) коррелировал с более высоким детрузорным давлением, определенным до операции, а уровень моноцитарного хемоаттрантного белка- 1 (MCP-1) – с наличием у больных до операции гиперактивности детрузора. Повышенные до операции уровни фактора роста нервов и ММП-1 коррелировали с сохранением гиперактивности детрузора через 12 месяцев после операции. То есть уровень маркеров воспаления коррелировал с функциональным состоянием мочевого пузыря и прогнозом его восстановления [46].
К таким же выводам пришли I. Offiah и соавт., которые установили повышенную экспрессию генов FGF7 и CCL21, связанных с воспалением, у больных с выраженной дисфункцией мочевого пузыря, причем степень экспрессии коррелировала с выраженностью клинических симптомов расстройства мочеиспускания [47].
Кроме того, по данным Vela Navarrete и соавт., терапия гексановым SRE (Пермиксон) в течение 3 месяцев приводила к уменьшению индекса IPSS, что сопровождалось снижением уровня провоспалительных цитокинов, интерлейкина 1β и фактора некроза опухолей в моче [48].
Учитывая приведенные данные логично предположить, что противовоспалительное действие SRE может реализовываться не только в отношении предстательной железы, но и мочевого пузыря.
ВЫВОДЫ
Механизмы действия SRE при СНМП/ДГПЖ следует рассматривать более широко и комплексно, включая возможное влияние препаратов не только на предстательную железу, но и на обструктивный мочевой пузырь. Именно этим можно объяснить клиническую эффективность SRE в отношении симптомов фазы накопления и уродинамических показателей. Однако объективных данных по этому вопросу немного, что требует новых специальных исследований.
ЛИТЕРАТУРА
- Russo A, La Croce G, Capogrosso P, Ventimiglia E, Colicchia M, Serino A, et al. Latest pharma-cotherapy options for benign prostatic hyperplasia. Expert Opin Pharmacother 2014;15(16):2319-28. https://doi.org/10.1517/14656566.2014.955470.
- Management of Non-neurogenic Male LUTS. URL: ttps://uroweb.org/guideline/treatment-ofnon-neurogenic-male-luts/
- Dedhia RC, McVary KT. Phytotherapy for lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol 2008;179(6):2119-25. https://doi.org/10.1016/j.juro.2008.01.094.
- Bent S, Kane C, Shinohara K, Neuhaus J, Hudes ES, Goldberg H, et al. Saw palmetto for benign prostatic hyperplasia. N Engl J Med 2006;354(6):557-66.
- Пермиксон (Permixon). Инструкция по применению. URL: https://www.vidal.ru/drugs/permixon__656. [Permixon. Instructions for use. URL: https://www.vidal.ru/drugs/permixon__656. (In Russian)]
- Scaglione F, Lucini V, Pannacci M, Caronno A, Leone C. Comparison of the potency of different brands of Serenoa repens extract on 5alpha-reductase types I and II in prostatic co-cultured epithelial and fibroblast cells. Pharmacology 2008;82(4):270-5. https://doi.org/10.1159/000161128.
- Latil A, Libon C, Templier M, Junquero D, Lantoine-Adam F, Nguyen T. Hexanic lipidosterolic extract of Serenoa repens inhibits the expression of two key inflammatory mediators, MCP-1/CCL2 and VCAM- 1, in vitro. BJU Int 2012;110(6 Pt B):E301-7. https://doi.org/10.1111/j.1464-410X.2012.11144.x.
- Scaglione F. How to Choose the Right Serenoa repens Extract. Eur Urol Suppl 2015;14(9):1464-1469
- Levin RM, Das AK. A scientific basis for the therapeutic effects of Pygeum africanum and Serenoa repens. Urol Res 2000; 28(3):201–9. https://doi.org/10.1007/s002409900098.
- Habib FK, Wyllie MG. Not all brands are created equal: a comparison of selected components of different brands of Serenoa repens extract. Prostate Cancer Prostatic Dis 2004;7(3):195–200. https://doi.org/10.1038/sj.pcan.4500746.
- Booker A, Suter A, Krnjic A, Strassel B, Zloh M, Said M, Heinrich M. A phytochemical compari-son of saw palmetto products using gas chromatography and 1H nuclear magnetic resonance spectros-copy metabolomic profiling. J PharmPharmacol 2013; 66(6):811–822. https://doi.org/10.1111/jphp.12198.
- Kwon Y. Use of saw palmetto (Serenoa repens) extract for benign prostatic hyperplasia. Food Sci Biotechnol 201917;28(6):1599-1606. https://doi.org/10.1007/s10068-019-00605-9.
- Raynaud JP, Cousse H, Martin PM. Inhibition of type 1 and type 2 5alpha-reductase activity by free fatty acids, active ingredients of Permixon. J Steroid Biochem Mol Biol 2002;82(2-3):233–9. https://doi.org/10.1016/s0960-0760(02)00187-5.
- Abe M, Ito Y, Suzuki A, Onoue S, Noguchi H, Yamada S. Isolation and pharmacological charac-terization of fatty acids from saw palmetto extract. Anal Sci 2009;25(4):553-7. https://doi.org/10.2116/analsci.25.553
- Suzuki M, Oki T, Sugiyama T, Umegaki K, Uchida S, Yamada S. Muscarinic et al. Alpha 1- adrenergic receptor binding characteristics of saw palmetto extract in rat lower urinary tract. Urology 2007;69(6):1216-1220. doi:10.1016/j.urology.2007.02.038.
- Vela-Navarrete R, Alcaraz A, Rodríguez-Antolín A, Miñana López B, Fernández-Gómez JM, Angulo JC, et al.. Efficacy and safety of a hexanic extract of Serenoa repens (Permixon® ) for the treatment of lower urinary tract symptoms associated with benign prostatic hyperplasia (LUTS/BPH): systematic review and meta-analysis of randomised controlled trials and observational studies. BJU Int 2018;122 (6):1049-1065. https://doi.org/10.1111/bju.14362. Epub 2018 Jun 6.
- Debruyne F, Koch G, Boyle P, Da Silva FC, Gillenwater JG, Hamdy FC, et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha-blocker (Tamsulosin) in the treatment of benign pros-tatic hyperplasia: a 1-year randomized international study. Eur Urol 2002;41(5):497-506.
- Debruyne F, Boyle P, Calais Da Silva F, Gillenwater JG, Hamdy FC, Perrin P, et al. Evaluation of the clinical benefit of Permixon and tamsulosin in severe BPH patients-PERMAL study subset analy-sis. Eur Urol 2004; 45(6):773–9. https://doi.org/10.1016/j.eururo.2004.01.015
- Yagi H, Sato R, Nishio K, Arai G, Soh S Okada H. Effects of a supplement combining Pycno-genol® and L-arginine aspartate on lower urinary dysfunction compared with saw palmetto extract. J Tradit Complement Med 2017;7(1):117–120. https://doi.org/10.1016/ j.jtcme.2016.05.008: 10.1016/j.jtcme.2016.05.008.
- Ulbricht C, Basch E, Bent S. Evidence-based systematic review of saw palmetto by the natural standard research collaboration. J Soc Integr Oncol 2006;4(4):170–186. https://doi.org/10.2310/7200.2006.016
- MacDonald R, Tacklind JW, Rutks I, Wilt TJ. Serenoa Repens Monotherapy for Benign Prostatic Hyperplasia (BPH): An Updated Cochrane Systematic Review. Review BJU Int 2012;109(12):1756-61. https://doi.org/10.1111/j.1464-410X.2012.11172.x.
- Suter A, Saller R, Riedi E, Heinrich M. Improving BPH symptoms and sexual dysfunctions with a saw palmetto preparation? Results from a pilot trial. Phytother Res 2013;27(2):218–226. https://doi.org/10.1002/ptr.4696
- Ryu YW, Lim SW, Kim JH, Ahn SH, Choi JD. Comparison of tamsulosin plus serenoa repens with tamsulosin in the treatment of benign prostatic hyperplasia in Korean men: 1-year randomized open label study. Urol Int 2015;94(2):187-93. https://doi.org/10.1159/000366521.
- Al-Shukri SH, Deschaseaux P., Kuzmin I.V., Amdiy R.R. Early urodynamic effects of the lipidosterolic extract of Serenoa repens (Permixon) in patients with lower urinary tract symptoms due to benign prostatic hyperplasia. Prostate Cancer Prostatic Dis 2000;3(3):195-199. https://doi.org/10.1038/sj.pcan.4500477.
- Сивков А.В., Синюхин В.Н., Причепа В.В., Аполихин О.И. Опыт применения гексанового экстракта Serenoa repens (Пермиксон) при хронических заболеваниях предстательной железы. Экспериментальная и клиническая урология 2018;4:82-92. [Sivkov A.V., Sinyukhin V.N., Prichepa V.V., Apolikhin O.I. Our experience in application of hexane extract of serenoa repens (permixon) extract in case of chronic prostatitis. Eksperimental'naya i klinicheskaya urologiya = Experimental and Clinical Urology 2018;4:82-92. (In Russian)]
- Сивков А.В. Пермиксон: механизм действия, клиническая эффективность и место в лечении ДГПЖ. В кн.: Доброкачественная гиперплазия предстательной железы [под ред. Н.А. Лопаткина], М.: 1999, С. 117-133. [Sivkov A.V. Permikson: mechanism of action, clinical efficacy and place in the treatment of BPH. In the book: Benign prostatic hyperplasia. [ed. N.A. Lopatkina], M .: 1999, P. 117-133. (In Russian)]
- Сивков А.В., Синюхин В.Н. Пермиксон: место препарата в патогенетической терапии ДГПЖ. Экспериментальная и клиническая урология 2017;4:50-62. [Sivkov A.V., Sinyukhin V.N. Permixon: place of drug in pathogenetic therapy of BPH. Eksperimental'naya i klinicheskaya urologiya = Experimental and Clinical Urology 2017;4:50-62 (In Russian)].
- Lee C-L, Kuo H-C. Pathophysiology of benign prostate enlargement and lower urinary tract symptoms: current concepts. Ci Ji Yi Xue Za Zhi 2017;29(2):79-83. https://doi.org/10.4103/tcmj.tcmj_20_17
- Singla N, Singla AK. Evaluation and management of lower urinary tract symptoms after outlet surgery for benign prostatic hyperplasia. Curr Bladder Dysfunct Rep 2016;11(3):242-247. doi:10.1007/s11884-016-0376-1.
- de la Taille A, Robert G, Descazeaud A. Consequences of prostatic obstruction on bladder function, impact of removal, and management of recurrence after surgery. Prog Urol 2018; 28(15):813-820. https://doi.org/10.1016/j.purol.2018.08.013.
- Michel MC, Chess-Williams R, Hegde SS. Are blood vessels a target to treat lower urinary tract dysfunction? Naunyn Schmiedebergs Arch Pharmacol 2015 Jul;388(7):687-94. doi:10.1007/s00210-015-1137-y.
- Barbosa JABA, Reis ST, Nunes M, Ferreira YA, Leite KR, Nahas WC, et al. The obstructed bladder: expression of collagen, matrix metalloproteinases, muscarinic receptors, and angiogenic and neurotrophic factors in patients with benign prostatic hyperplasia. Urology 2017;106:167- 172. https://doi.org/10.1016/j.urology.2017.05.010.
- Andersson K. Alpha1-adrenoceptors and bladder function. Eur Urol 1999;36(Suppl 1):96-102. https://doi.org/10.1159/000052328.
- Oki T, Suzuki M, Nishioka Y, Yasuda A, Umegaki K, Yamada S. Effects of saw palmetto extract on micturition reflex of rats and its autonomic receptor binding activity. J Urol 2005; 173:1395–9.
- Suzuki M, Oki T, Maruyama S, Takagi Y, Umegaki K, Nishioka Y, et al. Pharmacological effects of Saw Palmetto Extract on urodynamic functions and automic receptors in lower urinary tract of rats. Jpn Neurogenic Bladder Soc 2005;16:191–201.
- Birder LA, Kanai AJ, de Groat WC, Kiss S, Nealen ML, Burke NE, et al. Vanilloid receptor ex-pression suggests a sensory role for urinary bladder epithelial cells. Proc Natl Acad Sci USA 2001;98:13396–401.
- Apostolidis A, Brady CM, Yiangou Y, Davis J, Fowler CJ, Anand P. Capsaicin receptor TRPV1 in urothelium of neurogenic human bladders and effect of intravesical resiniferatoxin. Urology 2005; 65(2):400–5. https://doi.org/10.1016/j.urology.2004.10.007.
- Phan TX, Ton HT, Chen Y, Basha ME, Ahern GP. Sex-dependent expression of TRPV1 in bladder arterioles. Am J Physiol Renal Physiol 2016, Nov 1;311(5):F1063-F1073. https://doi.org/10.1152/ajprenal.00234.2016.
- Suzuki M, Ito Y, Fujino T, Abe M, Umegak K, Onoue S, et al. Pharmacological effects of saw palmetto extract in the lower urinary tract. Acta Pharmacol Sin 2009; 30(3):271–281. https://doi.org/10.1038/aps.2009.1
- Nasrin S, Masuda E, Kugaya H, Osano A, Ito Y, Yamada S. Effects of saw palmetto extract on urodynamic parameters, bladder muscarinic and purinergic receptors and urinary cytokines in rats with cyclophosphamide-induced cystitis. Low Urin Tract Symptoms 2014;6(1):57-63. https://doi.org/10.1111/luts.12015
- Espinosa-Juárez J.V, Colado-Velázquez JI, Mailloux-Salinas P, Medina-Contreras J, CorreaLópez PV, Gómez-Viquez NL.. Beneficial effects of lipidic extracts of saladette tomato pomace and serenoa repens on prostate and bladder health in obese male wistar rats. J Sci Food Agric 2017;97(13):4451-4458. https://doi.org/10.1002/jsfa.8308.
- Bernichtein S, Pigat N, Camparo P, Latil A, Viltard M, Friedlander G, et al. Antiinflammatory properties of lipidosterolic extract of Serenoa repens (Permixon) in a mouse model of prostate hyperplasia. Prostate 2015;75(7):706-22. https://doi.org/10.1002/pros.22953.
- Latil A, Petrissanss MT, Rouquet J, Robert G, de la Taille A. Effects of hexanic extract of Serenoa repens (Permixon 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Prostate 2015;75(16):1857-67. https://doi.org/10.1002/pros.23059
- Kim JC. Underlying mechanisms of detrusor overactivity following bladder outlet obstruction. LUTS 2009;1:15-7.
- Inamura S, Ito H, Shinagawa T, Tsutsumiuchi M, Taga M, Tsuchiyama K, et al. Serum C-reactive protein level is not associated with prostatic inflammation but with overactive detrusor in patients with benign prostatic hyperplasia. Neurourol Urodyn 2019;38(6):1728-1736. https://doi.org/10.1002/nau.24051
- de Conti PS, Barbosa JABA, Reis ST, Viana NI, Gomes CM, Borges L, et al. Urinary biomarkers of inflammation and tissue remodeling may predict bladder dysfunction in patients with benign prostatic hyperplasia. Int Urol Nephrol 2020. 52(11):2051-2057. https://doi.org/10.1007/s11255-020-02537-4
- Offiah I, Didangelos A, Dawes J, Cartwright R, Khullar V, Bradbury EJ, et al. The expression of inflammatory mediators in bladder pain syndrome. European Association of Urology. Published by Elsevier B.V., 2016, Аn open access article under the CC BY license (http://creativecommons.org/licenses/by/4.0/)
- Vela Navarrete R, Garcia Cardoso JV, Barat A, Manzarbeitia F, Lopez Farre A. BPH and inflammation: pharmacological effects of Permixon on histological and molecular inflammatory markers. Results of a double blind pilot clinical assay. Eur Urol 2003;44(5):549–55. https://doi.org/10.1016/s0302-2838(03)00368-3.










Комментарии