В.К. Карпов 1,3, С.А. Капранов 3, Б М. Шапаров 1,2
- Кафедра урологии и андрологии факультета фундаментальной медицины МГУ им. М.В. Ломоносова, Москва, Россия
- МНОЦ МГУ им. М.В. Ломоносова, Москва, Россия 3ГБУЗ «ГКБ №31 ДЗМ», Москва, Россия
Продолжает работу наша рубрика, посвященная рентгенэндоваскулярным методам диагностики и лечения в урологии. Тема сегодняшней статья – суперселективная эмболизация артерий мочевого пузыря в лечении макрогематурии у пациентов с раком мочевого пузыря.
Введение Распространенность рака мочевого пузыря (РМП) в России за последние 10 лет возросла с 49,6 до 74,1 больных на 100 тыс. населения. По росту первичной заболеваемости среди онкоурологических заболеваний РМП занимает 3-е место после рака простаты и рака почки. Согласно данным мировой статистики, по первичной заболеваемости и смертности среди онкоурологических заболеваний РМП занимает 2-е место после рака простаты.
Одним из тяжелых осложнений и частой причиной летальности при поздних стадиях РМП является тотальная макрогематурия. Некупируемая макрогематурия может встречаться примерно у 10% пациентов. Консервативные методы гемостаза не всегда позволяют достичь стойкого эффекта. При некупируемом кровотечении пациенту показано оперативное лечение. Наиболее широкое распространение в данном случае имеют эндоскопические коагуляционные методики, лигирование внутренних подвздошных артерий (ВПА), а также открытые хирургические вмешательства вплоть до цистэктомии.
Несмотря на высокую распространенность, стандартные трансуретральные методы гемостаза не лишены недостатков. Трансуретральная электрохирургическая резекция мочевого пузыря (МП) и коагуляция кровоточащих сосудов в условиях плохой визуализации из-за продолжающегося кровотечения может быть причиной большого числа осложнений вплоть до перфорации МП и в обязательном порядке требует анестезиологического пособия. Лапароскопическое или открытое лигирование ВПА и ее ветвей также требует общего наркоза, не всегда бывает достаточно эффективным и делает невозможным выполнение в последующем эндоваскулярного гемостаза. Ретгенэндоваскулярная эмболизация передней порции ВПА не имеет противопоказаний по анестезиологическому риску, однако ввиду недостаточной селективности зачастую бывает неэффективна и связана с ишемией органов малого таза. Наиболее предпочтительным минимально-инвазивным хирургическим методом гемостаза для пациентов группы высокого анестезиологического риска с продолжающимся кровотечением из опухоли МП является суперселективная эмболизация артерий.
История вопроса
Технологический прогресс позволил существенно раздвинуть границы применения ангиографии, расширив возможности рентгенэндовскулярной хирургии с диагностических процедур до выполнения внутрисосудистого лечения, одним из вариантов которого стала рентгенэндоваскулярная эмболизация артерий. Впервые в мире эту методику применил R.H.M. Dawbarn в 1898 г. при злокачественной опухоли наружной сонной артерии [1]. В качестве эмболизационного материала использовалась смесь парафина и вазелина. Родоначальниками применения рентгенэндоваскулярной эмболизации в урологии являются А.F. Lalli и соавт., в 1969 г. впервые экспериментально выполнившие эмболизацию почечной артерии [2]. В 1973 г. L.E. Almgard и соавт. впервые применили данную методику в клинической практике [3]. Эмболизационным материалом послужила гомогенизированная аутомыщца. В 1979 г. E.K. Lang и соавт. сообщили об успешном выполнении билатеральной эмболизации передней порции ВПА ней подвздошной артерии у 14 пациентов с тотальной макрогематурией [4]. В России первопроходцами в области эндоваскулярной эмболизации в урологии стали А.М. Гранов [5], Н.А. Лопаткин [6], В.С. Рябинский [7], применившие данную технику для эндоваскулярной окклюзии почечной артерии. Для остановки кровотечения из артерий МП эмболизация впервые была применена T.D. Schuhrke и соавт. в 1976 г. [8]. Впервые в нашей стране о подобном опыте в 1985 г. сообщили А.М. Гранов и соавт. [9]. По их данным, эмболизация передней порции внутренней подвздошной артерии была успешно выполнена 30 пациентам с продолжающимся кровотечением из опухоли МП.
Техника выполнения
Для выполнения эффективной окклюзии сосудистого русла принципиальное значение имеет пред- и интраоперационная ангиография, при которой определяется ангиоархитектоника малого таза и тактика выполнения процедуры.
Кровоснабжение МП осуществляется по нижней пузырной артерии, которая является ветвью ВПА, обычно отходит от ее переднего отдела вместе со средней ректальной артерией и питает бόльшую часть МП, кроме верхушки. Нижняя пузырная артерия может отходить как общим стволом с верхней ягодичной и внутренней срамной артериями, так и быть ветвью внутренней срамной артерии. Верхняя ягодичная артерия посредством многочисленных ответвлений кровоснабжает верхушку МП и является продолжением пупочной артерии (рис. 1).
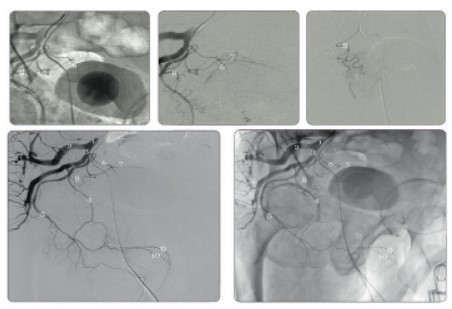
Рис. 1 Рентгенанатомия артерий мужского таза: 1 – а. iliaca interna, 2 – a. glutea superior, 3 – a. glutea inferior, 4 – a. obturatoria, 5 – a.pudenda interna, 6 – a. vesicales inferior, 7 – a. vesicales superior, 8 – a. prostatica, 9 – a. dorsalis penis, 10 – a. profunda penis.
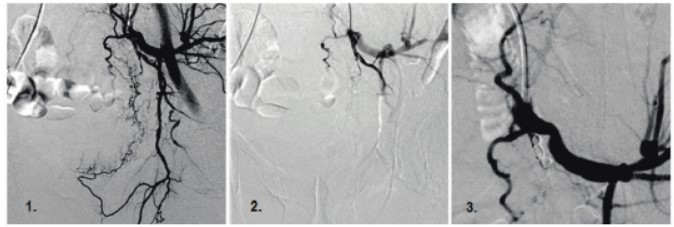
Рис. 2 Катетеризация левой ВПА (1) с последующей эмболизацией нижней пузырной артерии частицами ПВА (2) и установкой спирали Gianturco (3)
Процедура обычно выполняется под местной анестезией с применением цифровой субтракционной ангиографии. Доступ осуществляется по Сельдингеру через бедренную артерию с одной или двух сторон с использованием катетера 5 Fr или 6 Fr. Затем с применением микрокатетера 5 Fr «Кобра» или катетера Симмонса выполняется селективная ангиография ВПА для визуализации сосудистого рисунка малого таза. Пузырные артерии могут отходить как в виде отдельных ответвлений переднего отдела ВПА, так и виде ветвей из срамных артерий у мужчин и маточных артерий у женщин. На основании ангиографических данных с помощью коаксиального микрокатетера 3 Fr выполняется селективная катетеризация пузырных ветвей. Для эмболизации в дистальных отделах артерий применяются микроэмболы диаметром 300–500 мкм, в то время как эмболы 500–700 мкм применяются для эмболизации более проксимальных частей конечных артерий. В случае выявления ангиографических признаков контрастной экстравазации дистальная эмболизация может быть выполнена с применением N-бутил-2- цианоакрилатного клея, который смешивают с ультражидким липиодолом в соотношении 1:3 для придания ему рентгенконтрастных свойств. При невозможности селективной катетеризации пузырных артерий используется петлевая блокада. Этот метод состоит во временной петлевой окклюзии дистальных ветвей переднего отдела ВПА с сохранением кровотока в пузырной артерии для выполнения селективной эмболизации, в то время как петля предохраняет пациента от нежелательной эмболизации дистальных ветвей ВПА. В данном случае применяются спирали 0,018-inch или «сендвич-терапия» платиновыми микроспиралями с эмболизационными частицами (рис. 2). Когда основные ветви переднего отдела ВПА не могут быть селективно катетеризированы, кончик катетера остается в переднем отделе ВПА, и эмболизация выполняется с применением 0,035-inch стальных спиралей типа Gianturco или абсорбируемой желатиновой губки, которые имплантируются в передний отдел ВПА вне зависимости от того, была ли обнаружена экстравазация контрастного препарата. При необходимости выполняется эмболизация противоположной стороны через ипсилатеральный или контрлатеральный доступ.
Эффективность
Единого мнения об объективных критериях успеха выполнения данного вида лечения не выработано, в связи с чем анализ международной литературы затруднен. Некоторые авторы рассматривали в качестве основных показателей эффективности гемостаза отсутствие рецидива макрогематурии с результатом от 43 до 100%. M. Korkmaz и соавт. подразделяют результаты выполнения процедуры на технический успех, краткосрочный клинический успех и долгосрочный клинический успех [10]. Технический успех был достигнут в 88% случаев, в то время как краткосрочный клинический успех в 100%, а долгосрочный клинический успех в 83%. J.M. Pisco и соавт. разделили результат на «Полный ответ», «Частичный ответ» и «Отсутствие ответа» в зависимости от необходимости повторного переливания крови [11]. S. Ozono и соавт. классифицировали эффективность процедуры в соответствии с уменьшением размера опухоли (56,7%), снижением кровотока в опухоли (72,7%) и достижением гемостатического эффекта (76,5%) [12]. В некоторых исследованиях основное внимание уделялось необходимости переливания крови как основному показателю успешности выполнения процедуры, в то время как другие были ориентированы на уровень гемоглобина и гематокрита. D. Halpenny и соавт. сообщили, что средняя потребность в переливании была 8,6 единиц донорской эритроцитарной массы до эмболизации и 0,3 единицы после выполнения процедуры [13]. G. Liguori и соавт. сообщили, что из 44 пациентов, которым была выполнена эмболизации артерий МП, полный гемостаз был достигнут у 36 (82%) пациентов [14]. В ходе дальнейшего наблюдения 5 (11%) пациентам была выполнена повторная эмболизация.
В настоящее время в связи с увеличением накопленного опыта, внедрением суперселективной эмболизации и улучшением материально-технической базы частота рецидивов значительно снизилась. В частности, A. El-Assmy и соавт. сообщали об успешном выполнении суперселективной эмболизации артерий МП 7 пациентам с рецидивом макрогематурии у 3 из них в течение 6–12 месяцев, одному из них была выполнена повторная эмболизация [15]. Об успешном выполнении рентгенэндоваскулярной суперселективной эмболизации артерий МП у 80 пациентов с некупируемой макрогематурией в 2013 г. сообщили А.М. Тибилов и соавт. [16]. Стойкий гемостаз с отсутствием повторных эпизодов макрогематурии был достигнут у 95% пациентов. По сообщению G. Nabi и соавт., по результатам выполнения билатеральной суперселективной эмболизации артерий МП 6 пациентам, одному из них потребовалась повторная эмболизация [17]. При последующем наблюдении в течение 22 месяцев рецидива макрогематурии не было. C. Palma Ceppi и соавт. выполнили суперселективную эмболизацию артерий МП 6 пациентам с массивной макрогематурией, 2 из которых в течение недели потребовалась реэмболизация [18].
Осложнения
Наиболее распространенным осложнением суперселективной эмболизации артерий МП является постэмболизационный синдром, который включает в себя субфебрильную лихорадку и боль в тазовой области, данное осложнение полностью купируется консервативно. Кроме того, встречаются острый тубулярный некроз, ассоциированный с нефротоксичным действием контрастного препарата, а также синдром Броуна-Секара – половинное поперечное поражение спинного мозга, проявляющееся параличом, утратой суставно-мышечной чувствительности и утратой вибрационной чувствительности на противоположной стороне. Причиной развития синдрома Броуна-Секара является непреднамеренная эмболизация коллатералей между пузырными артериями и боковыми крестцовыми артериями.
Собственный опыт
С 2016 г. в ГКБ №31 ДЗМ 16 пациентам с диагнозом РМП в стадии T1N0M0-T4аN1M0, осложнившимся рецидивирующим жизнеугрожающим кровотечением, в связи с неэффективностью консервативной терапии и отягощенным соматическим статусом выполнена экстренная эмболизация артерий МП. Средний возраст составил 66,5 (от 32 до 81 года) года. Все пациенты были госпитализированы по экстренным показаниям. Эмболизация артерий МП выполнялась на рентгеноскопической установке Toshiba MS INFINIX VC-i. В 15 случаях был использован трансфеморальный доступ, в 1 случае был использован трансрадиальный доступ. Для эмболизации использовались интродьюсеры диаметром 5 Fr и 6 Fr. В качестве эмболизационного материала использовались желатиновая губка, микрочастицы 500–710 мкм, спирали Gianturco, а также их комбинация по типу «сендвич-терапии». Экстренная эмболизация артерий МП была выполнена всем 16 пациентам. Эмболизация была выполнена билатерально у 15 пациентов, одному выполнена унилатерально.
В 14 случаях выполнена суперселективная эмболизация, у 2 пациентов была применена эмболизация передней порции ВПА от устья. Полный гемостаз был достигнут у 12 больных, отмечалась стабилизация показателей гемоглобина и гематокрита, отсутствие необходимости в гемотрансфузии. Это позволило избежать нежелательной наркозной нагрузки и экстренных операций у соматически отягощенных пациентов. У 4 пациентов оптимальный клинический эффект достигнут не был. Также был отмечен один случай технической неудачи – невозможность катетеризации ВПА у пациента с синдромом Лериша.
Заключение
Одним из главных преимуществ суперселективной эмболизации артерий МП является отсутствие необходимости выполнения анестезиологического пособия. Применение данной методики гемостаза позволяет избежать экстренных операций у соматически отягощенных пациентов, но при этом более эффективно и связано с меньшим числом осложнений, чем неселективные техники рентгенэндоваскулярного гемостаза. Суперселективная эмболизация артерий МП является эффективным и безопасным малоинвазивным методом купирования макрогематурии при опухолях МП и должна рассматриваться как метод выбора для соматически отягощенных пациентов с некупируемой макрогематурией.
ЛИТЕРАТУРA
- Dawbarn R.H. Carotid Excision for Malignant Growths. Ann. Surg. 1898;27(1):127–28.
- Lalli A.F, Peterson N., Bookstein J.J. Roentgen-guided infarctions of kidneys and lungs. A potential therapeutic technic. Radiol. 1969;93(2):434–5.
- Almgard L.E., Fernstrom I., Haverling M., Ljundquist A. Treatment of renal adenocarcinoma by embolic occlusion of the renal circulation. Br. J. Urol. 197;45:474.
- Lang E.K., Deutsch J.S., Goodman J.R., et al. Transcatheter embolization of hypogastric branch arteries in the management of intractable bladder hemorrhage. J. Urol. 1979;121:30–6.
- Гранов А.М., Карелин М.И., Таразов П.Г. и др. Рентгеноэндоваскулярная хирургия в онкоурологии. Вестн. рентгенологии. 1996;1:35–7.
- Лопаткин Н.А., Морозов А.В. Эмболизация и окклюзия почечной артерии в клинике. Урология и нефрология. 1982;1:3–5.
- Рябинский В.С., Степанов В.Н., Перельман В.М. и др. Эмболизация почечной артерии конусообразной металлической спиралью. Урология и нефрология. 1985;(4):9–12.
- Schuhrke T.D., Barr J.W. Intractable bladder hemorrhage: therapeutic angiographic embolization of the hypogastric arteries. J. Urol. 1976;116(4):523–5.
- Гранов А.М., Анисимов В.Н., Гринвальд В.А. и др. Рентгеноэндоваскулярная окклюзия и перевязка внутренних подвздошных артерий при кровоточащих опухолях мочевого пузыря. Вестн. хирургии им. И.И. Грекова. 1985;135(Вып. 8):51–5.
- Korkmaz M., Sanal B., Aras B., et al. The short- and long-term effectiveness of transcatheter arterial embolization in patients with intractable hematuria. Diagn. Interv. Imaging. 2016;97:197– 201
- Pisco J.M., Martins J.M., Correia M.G. Internal iliac artery: embolization to control hemorrhage from pelvic neoplasms. Radiol. 1989;172:337–9.
- Ozono S., Okajima E., Hirao Y., et al. Transcatheter arterial embolization of vesical artery in the treatment of invasive bladder cancer. Eur. Urol. 1988;15:176–9.
- Halpenny D., Salati U., Torregiani W.C., Browne R. Selective arterial embolization for control of haematuria secondary to advanced or recurrent transitional cell carcinoma of the bladder. JBR-BTR. 2013;96:282–5.
- Liguori G., Amodeo A., Mucelli F.P., et al. Intractable haematuria: long-term results after selective embolization of the internal iliac arteries. BJU Int. 2010;106:500–53
- 15 El-Assmy A., Mohsen T. Internal iliac artery embolization for the control of severe bladder hemorrhage secondary to carcinoma: long-term follow-up. Sci. World J. 2007;7:1567–74.
- Тибилов А.М., Байматов М.С., Кульчиев А.А. и др. Артериальная эмболизация в лечении неоперабельных опухолей мочевого пузыря, осложненных кровотечением. Материалы V российского съезда интервенционных кардиоангиологов. 2013;35:79.
- Nabi G., Sheikh N., Greene D., Marsh R. Therapeutic transcatheter arterial embolization in the management of intractable haemorrhage from pelvic urological malignancies: preliminary experience and long-term follow-up. BJU Int. 2003;92: 245–7.
- Palma Ceppi C., Reyes Osorio D., Palma Ceppi R., Palavecino P. Experience in superselective embolization of bladder arteries in the treatment of intractable hematuria. Actas. Urol. Esp. 2008;32(5):542.










Комментарии