Прохоров А.В.
Молниеносная гангрена мошонки, более известная как гангрена Фурнье (ГФ), является разновидностью некротизирующего фасциита полимикробной этиологии с преимущественным поражением наружных половых органов и промежности, она характеризуется крайне тяжелым, стремительным и прогредиентным течением [1-3]. Прогноз при ГФ определяется, прежде всего, сроками оказания хирургической помощи. Задержка в проведении лечебных мероприятий сопровождается высокой летальностью, достигающей при лечении 47-80% и заболевания при отсутствии лечения в 100% случаев, вследствие развития септического шока и его осложнений [4, 5]. В связи с этим пациентам с подозрением на ГФ требуется проведение неотложных диагностических и лечебных мероприятий, которые начинаются с экстренного эксплоративного хирургического вмешательства [4, 6].
Лечение ГФ – очень сложная задача, даже для специализированных учреждений. В настоящее время подход к лечению ГФ является многоплановым, он включает целый ряд организационных и лечебных мер и требует участия врачей различных специальностей. Несмотря на многообразие и непрерывное совершенствование применяемых методов лечения, прогноз заболевания в тяжелых случаях, по мнению авторитетных авторов, длительное время занимающихся этой проблемой, остается серьезным, а чаще – неутешительным [3, 4, 7, 8].
Цель работы: анализ лечебной тактики и обзор современных методов лечения, применяемых при ГФ.
ОРГАНИЗАЦИЯ ЛЕЧЕНИЯ БОЛЬНЫХ ГФ
Лечение пациентов с ГФ осуществляется в специализированных стационарах хирургического профиля, занимающихся лечением гнойно-септических заболеваний мягких тканей. Однако в действительности больные ГФ с ошибочными диагнозами (флегмона мошонки, парапроктит) обычно поступают в стационары урологического и проктологического профиля, в которых проводится полный курс лечения в случае, если состояние пациента не позволяет перевести его в специализированный стационар [7, 9, 10].
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ГФ
Краеугольным камнем в лечении ГФ является экстренное хирургическое вмешательство в сочетании с антибактериальной и дезинтоксикационной терапией [3, 4, 11-14]. При высокой степени подозрения на ГФ, по данным клинико-лабораторной и лучевой картины, применяется эксплоративная операция поискового характера, которая на сегодняшний день является «золотым стандартом» диагностики ГФ [1, 5, 6, 13]. При этом под местной анестезией выполняется небольшой разрез кожи мошонки или промежности, при обнаружении подкожного некроза или эмфиземы разрез продолжается до глубоких фасциальных мышечных влагалищ, при этом хирург оценивает степень адгезии фасциальных структур между собой. При наличии некротизирующего фасциита пальцевая диссекция фасциальных листков невозможна, пораженные фасции тесно спаяны между собой и с мягкими тканями, что не позволяет хирургу легко скользить пальцем вдоль них. В противном случае, при отсутствии некротизирующего фасциита, хирургу при пальцевой ревизии раны легко удается отслоить фациальные листки от окружающих тканей [1, 8].
В сомнительных случаях пальцевая ревизия раны дополняется экспресс биопсией фасций с целью морфологической и бактериологической верификации некротизирующего фасциита [7, 8, 15]. При очевидных интраоперационных и морфологических признаках ГФ объем эксплоративной операции расширяется до исечения омертвевших тканей с применением широких «лампасных» разрезов уже под общим обезболиванием [13, 14]. Хирургическое иссечение глубокой фасции и подлежащих мышц обычно не требуется, так как они редко поражаются при ГФ [9, 13, 14]. Границы некрэктомии определяются визуально и при пальцевой ревизии – по легкости диссекции тканей, поскольку кожный некроз не является надежным маркером некротизирующего фасциита [9]. Некоторые авторы рекомендуют выполнять радикальное иссечение пораженных тканей с применением электрокоагуляции для уменьшения объема кровопотери [8, 16]. Высока вероятность повторных хирургических вмешательств до полной санации некротизирующей инфекции [9]. После получения результатов микробиологического исследования биоптата фасций проводится, если необходимо, коррекция начатой антибактериальной терапии.
В ранних публикациях можно встретить рекомендации по выжидательной тактике: в начальной фазе ГФ проводить консервативное лечение, а к некрэктомии прибегать лишь при наличии четкой демаркационной линии, обозначающей зону некроза [13, 17]. В настоящее время выжидательная тактика признана порочной и в литературе уже не обсуждается, она способствуют генерализации гнойнонекротического процесса с развитием сепсиса и летального исхода [9, 14]. На вооружение принята агрессивная хирургическая тактика, включающая широкое иссечение всех некротизированных тканей с применением лампасных разрезов, вскрытие и дренирование флегмон мягких тканей наружных половых органов и промежности, абсцессов паховых лимфатических узлов [11, 14, 17, 18]. Операция должна носить не срочный, а экстренный характер – сразу же при поступлении пациента в стационар, после минимальной необходимой предоперационной подготовки (рис. 1, 2). При этом обращается внимание, что хирургический разрез, будь он даже лампасный, не в состоянии остановить некроз фасции и прогрессирование процесса. Поэтому в план лечения следует включать повторные хирургические вмешательства для дополнительного контроля над инфекционным процессом [13, 14].
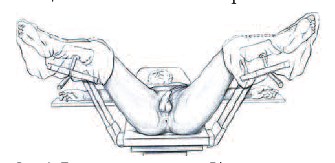
Рис. 1. Положение пациента с ГФ на операционном столе [25]
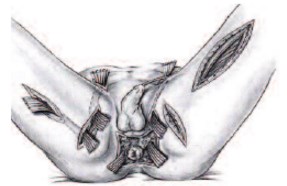
Рис. 2. Некрэктомия с применением «лампасных» разрезов при ГФ аноректальной области с гнойными затеками в пах и на бедро [25]
Радикальная ликвидация гнойного очага в оптимальные сроки (3-6 суток от начала ГФ) совместно с противовоспалительной и дезинтоксикационной терапией обычно приводят к выздоровлению большинства больных ГФ [9]. Если же лечебные мероприятия осуществляются в более поздние сроки, то высока вероятность развития сепсиса и полиорганной недостаточности [9, 19, 20]. Даже широкое иссечение всех некротизированных тканей не всегда является гарантией выздоровления, что свидетельствует о системном характере поражений при ГФ [9, 18]. Кроме того, как свидетельствует ретроспективный анализ, на радикализм первичной операции в определенных ситуациях может оказывать влияние психологическая проблема последующего закрытия обширных ран после полного иссечения некротизированных тканей [9, 17, 20]. Вместе с тем недостаточный объем первично выполненной операции может в свою очередь обусловить прогрессирование процесса [9, 11, 15, 16]. Поэтому радикализм и принцип иссечения, а не рассечения омертвевших тканей являются основополагающими в хирургическом лечении ГФ, а сократить сроки заживления ран и длительность стационарного лечения возможно, лишь базируясь на методах пластической хирургии [9, 17, 18].
Хирургическую обработку гнойно-некротического очага осуществляют с соблюдением основных принципов гнойной хирургии, создания условий для беспрепятственного оттока раневого отделяемого, для достаточного доступа кислорода к тканям пораженной зоны, что особенно важно при наличии анаэробной инфекции. С этой целью некоторые авторы после широкого иссечения некротизированных тканей края раны выворачивают и подшивают к окружающей здоровой коже в виде манжеты для лучшей аэрации раневой поверхности [8, 10, 15].
Спектр неотложных хирургических вмешательств при ГФ может быть самым разнообразным и не ограничиваться лишь некрэктомией, абсцессотомией, вскрытием и дренированием гнойных затеков мягких тканей аногенитальной зоны. Для изучения характера неотложных операций при ГФ был проведен собственный анализ 793 случаев ГФ, представленных в 10-ти крупных клинических исследованиях за последние 10 лет [21-30]. Среди неотложных хирургических вмешательств при ГФ были выполнены некрэктомия, абсцессотомия, вскрытие и дренирование гнойных затеков мягких тканей наружных половых органов, промежности и малого таза, колостомия, эпицистостомия, орхиэктомия, пенэктомия и вазэктомия (рис. 3).
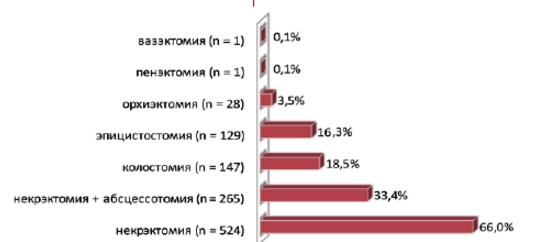
Рис. 3. Структура неотложных оперативных вмешательств при ГФ (n = 793)
Некрэктомия мягких тканей наружных половых и промежности при ГФ была выполнена в 789 (99,5%) случаях, среди которых сочетание некрэктомии с вскрытием и дренированием абсцессов, флегмон и гнойных затеков аногенитальной области и малого таза было в 265 (33,6%) случаях. Количество некрэктомий варьировало от 1 до 8 (в среднем, 3,7 ± 1,3), более двух некрэктомий было произведено в 555 (70%) случаях. Наличие взаимосвязи между количеством некрэктомий и показателем летальности при ГФ убедительно не установлено ввиду отсутствия широкомасштабных исследований. В отдельных публикациях показано, что количество некрэктомий в целом не влияет на показатель летальности при ГФ [24, 26, 30]. Однако, по данным других авторов, повторные агрессивные санационные некрэктомии с интервалом 1-2 дня достоверно приводят к снижению летальности [12, 29]. Сроки выполнения некрэктомии являются статистически значимым показателем витального прогноза при ГФ и разногласий не вызывают [24, 25, 30]. Так, в серии наблюдений H.R. Unalp и соавт. (2008), включающей 68 пациентов с ГФ, сроки выполнения первого хирургического вмешательства были почти в 2 раза больше среди умерших пациентов, чем среди выживших: 5,3 (3-8) суток и 2,9 (1-8) суток, соответственно (p = 0,047) [30].
Отведение мочи было выполнено у 349 (44,3%) пациентов с ГФ. При этом катетеризация мочевого пузыря осуществлена у 220 (63,3%) и эпицистостомия – у 129 (36,7%) больных ГФ. В зависимости от серии наблюдений процент превентивной катетеризации мочевого пузыря достигает 100, что связано с необходимостью проведения инфузионной терапии. Отведение мочи из мочевого пузыря проводилось путем периодической и перманентной катетеризации, открытой надлобковой или троакарной эпицистостомии. Большинство авторов предпочитает постоянную катетеризацию мочевого пузыря, выполняемую с превентивной целью уже в отделении интенсивной терапии для контроля объема инфузионной терапии [11, 15, 21, 23]. Показания к выполнению эпицистостомии возникают реже: при дисфункции наружного сфинктера уретры, которая развивается при обширном поражении промежности, полового члена или уретры [12, 19, 20]. Сообщений об осложнениях, наблюдающихся при отведении мочи указанными способами у пациентов с ГФ, в литературе не приводится.
Отведение кала путем традиционной (открытой) колостомии было выполнено у 147 (18,5%) больных ГФ (в отдельных наблюдениях процент колостомий варьировал от 1,4 до 43). Показаниями для колостомии были случаи обширного гнойно-некротического поражения аноректальной области, несостоятельность анального сфинктера в виде недержания кала, опасность загрязнения фекалиями открытой раны промежности и наружных половых органов, перфорация или наружный свищ прямой кишки. Колостомия осуществлялась как с превентивной целью в ходе первичной санационной некрэктомии, так и в отсроченном порядке при повторных хирургических санациях (рис. 4).
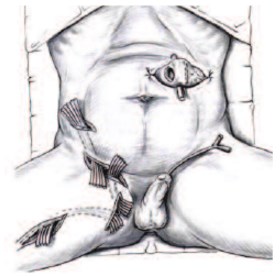
Рис. 4. Временное отведение мочи и кала при помощи постоянного уретрального катетера и трансверзоколостомии при ГФ промежности с гнойными затеками на переднюю брюшную стенку и бедро [25]
Количество публикаций, специально посвященных вопросу колостомии при ГФ, в литературе не так много [31 – 33]. Показания к колостомии при ГФ активно обсуждаются. Наибольшие разногласия существуют в отношении показаний к превентивной колостомии, так как имеются противоречивые данные по влиянию превентивной колостомии на показатель смертности при ГФ. Так, M. Korkut и соавт. в рандомизированном исследовании, включающем 45 случаев ГФ, показали, что смертность среди пациентов, перенесших превентивную колостомию, была в 5,5 раз выше, чем у пациентов без колостомии: 38% и 7%, соответственно [29]. Противоположные результаты были получены H.R. Unalp и соавт. [30]. Согласно данным этих авторов, в клиническом исследовании, состоящем из 68 больных ГФ, колостомия была выполнена у 22 (32,4%) больных, при этом летальность в группе пациентов без колостомы была в 3 раза выше, чем среди пациентов с колостомой: 13% и 4,5%, соответственно. Было также показано, что у пациентов с превентивной колостомой летальность ниже, чем у пациентов с отстроченной колостомой [32, 33]. A. Akcan и соавт. в серии наблюдений, состоящей из 37 пациентов, при сравнении показателя летальности при превентивной и отстроченной колостомии показали статистически значимое увеличение смертности при выполнении отсроченной колостомии: 29% и 42%, соответственно (p=0,031) [32].
Сторонники превентивной колостомии полагают, что она позволяет осуществлять более раннее пероральное питание пациентов с ГФ, значительно уменьшает риск микробной контаминации и способствует более быстрому заживлению раны промежности и мошонки [33]. Противники превентивной колостомии считают, что она не только не спасает от летального исхода, но и наоборот увеличивает вероятность летального исхода из-за ее осложнений [29]. Было показано, что колостомия может сопровождаться наличием осложнений в виде раневой инфекции, ишемии стомы, пролонгированной кишечной непроходимости, эвисцерации [29, 32]. Колостомия дополнительно вызывает физическую и психологическую травму у соматически тяжелого контингента больных, к которому относятся пациенты с ГФ [32, 33]. Несмотря на то, что колостомия не сопровождается увеличением сроков госпитализации, она не исключает необходимость многократных санаций раны и тем самым не приводит к уменьшению количества некрэктомий [29, 32]. Таким образом, на сегодняшний день, принимая во внимание положительные и отрицательные стороны превентивной колостомии, рекомендуется ее выполнение лишь по строгим показаниям [31, 33].
В последнее время в качестве альтернативы традиционной колостомии предложена самоудерживающаяся гибкая система для отведения каловых масс в виде силиконового катетера с надувным баллоном (по типу катетера Фолея), которая устанавливается в анальный канал и соединяется с калоприемником [1, 4, 25] (рис. 5). Атравматичная колостома хорошо защищает раневую поверхность от фекальной контаминации и тем самым ускоряет раневой регенераторный процесс, она показана при диарее, ожогах и язвах аноректальной области [1, 4]. Считается, что такая альтернативная колостома помогает избежать осложнений, связанных с выполнением рутинной колостомии, она физически и психологически легче переносится пациентами, а также экономически выгодна [24, 33]. Перед установкой отводящего устройства в прямую кишку рекомендуется провести пальцевое и визуальное исследование прямой кишки на предмет опухолевого заболевания или повреждения. Злокачественные опухоли, перфорация и свищи прямой кишки являются противопоказаниями для установ-ления катетера в прямую кишку [4, 33]. В этих случаях выполняется обычная колостомия.
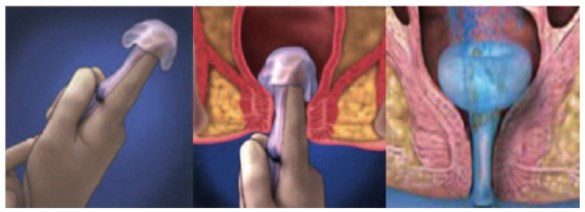
Рис. 5. Временное отведение кала при помощи самоудерживающейся системы по типу катетера Фолея [4]
Орхиэктомия была выполнена в 28 (3,5%) случаях (в зависимости от серии наблюдений это количество достигало 30%), пенэктомия и вазэктомия – в 1 (0,1%) случае (в зависимости от серии наблюдений – до 5%). Показанием для этих операций при ГФ было вовлечение в гнойно-некротический процесс полового члена, яичек и семявыносящего протока. Низкий процент орхиэктомии еще раз подтверждает известный факт редкого поражения яичек при ГФ, что объясняется раздельным кровообращением мошонки и яичек [1, 4, 8, 14].
АНТИБАКТЕРИАЛЬНОЕ ЛЕЧЕНИЕ ГФ
Рекомендации по антимикробной терапии ГФ основаны на низком уровне доказательности и степени клинических рекомендаций [11, 15, 16]. Антибактериальная терапия должна проводиться сразу после постановки диагноза ГФ одновременно с подготовкой больного к операции. С учетом полимикробной (аэробной и анаэробной) каузативной микрофлоры, лечение ГФ рекомендуется начинать с антибиотиков широкого спектра действия [11, 18, 19]. Предусматривается влияние на основные вероятные возбудители ГФ, включая золотистый стафилококк, стрептококки (в первую очередь Str. руоgenes), анаэробы и энтеробактерии.
Согласно новым клиническим рекомендациям Американского общества инфекционных болезней (IDSA – 2015) к препаратам выбора при ГФ относится триада: цефтриаксон (цефтазидим) или флоксан (ципрофлоксацин), гентамицин и метронидазол (метрогил) [34]. При молниеносных и быстро прогрессирующих формах ГФ в комплекс антибактериальной терапии включаются антибиотик из класса карбапенов (имипенем, меропенем, эртапенем, дорипенем, фаропенем, биапенем), относящихся к классу βлактамных антибиотиков с широким спектром действий, а также пиперациллина-тазобактам – новый комбинированный антибактериальный препарат, содержащий пиперациллин (полусинтетический антибиотик широкого спектра действия) и тазобактам (ингибитор большинства β-лактамаз). При непереносимости пенициллинов рекомендуется применять тигерциклин, относящийся к группе макролидов с широким антибактериальным спектром и низкой нефротоксичностью (по сравнению с другими аминогликозидами). При наличии в анамнезе повторных госпитализаций с длительными курсами антибактериальной терапии целесообразно добавить к терапии линезолид или даптомицин, используемые для лечения тяжелых инфекций, вызванных большинством антибиотикорезистентных штаммов грамположительных бактерий (включая стрептококки, устойчивые к ванкомицину, энтерококки и метициллин – резистентный золотистый стафилококк) [4, 34, 35].
Предложены также и другие схемы антибактериальной терапии, заслуживающие внимания [36-39]. Для эмпирической антибактериальной терапии широкого спектра действия до получения результатов микробиологического анализа можно использовать комбинацию пенициллина G, клиндамицина, ванкомицина, и гентамицина [38]. Пенициллин G обладает значительной активностью в отношении стрептококков и клостридий. Ванкомицин эффективен при метициллин-резистентном золотистом стафилококке. Клиндамицин имеет относительно широкую антиаэробную и антианаэробную активность, уменьшает продукцию α-токсина клостридиальной флоры и суперантигена M стрептококковой флоры. Гентамицин обеспечивает широкое антибактериальное действие на многие грамотрицательные палочки и анаэробные бактерии [38, 39]. Возможно также применение сочетания цефалоспоринов III-IV поколений (цефотаксим, цефтриаксон, цефепим) с метронидазолом [11, 15, 16]; эмпирической монотерапии ингибиторозащищенными пенициллинами (амоксициллин / клавуланат, тикарциллин / клавуланат) [15, 21, 36].
Суточная доза указанных препаратов и продолжительность антибактериальной терапии определяется индивидуально в зависимости от степени распространенности, обширности гнойно-некротического поражения и тяжести состояния больных. Длительность комбинированной антибактериальной терапии составляет в среднем 7-10 суток, максимально – 14 суток [7, 8, 13].
ПОСЛЕОПЕРАЦИОННОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ГФ
Осуществляется в специаль-ных палатах отделения интенсивной терапии, крайне тяжелых больных – в режиме искусственной вентиляции легких продолжительностью не менее 3 суток [1, 2, 4, 11, 16]. Лечебные мероприятия направлены на поддержание гемодинамики, прежде всего сердечного выброса, а также проведение дезинтоксикационной и инфузионной терапии с использованием вазопрессорных аминов для обеспечения адекватной тканевой перфузии, снижения концентраций токсических метаболитов и цитокинов [3, 15, 16, 18]. При инфузионной и дезинтоксикационной терапии применяются кристаллоидные растворы, растворы альбумина, плазмареферез и гемосорбция; при обширных кровоточащих раневых поверхностях – плазмозамещающая терапия и гемотрансфузии [13, 14].
Строгому контролю подлежат азотовыделительная функция почек и гликемический статус пациента. Следует помнить, что почечная недостаточность, обусловленная тканевой гипоперфузией и массивной эндотоксемией, является одним из наиболее распространенных осложнений ГФ и, в ряде случаев, для коррекции может потребовать применения неотложного гемодиализа [19, 20, 23]. Как правило, ГФ развивается у пациентов с сахарным диабетом, который на фоне сепсиса может легко декомпенсироваться и потребовать применения больших доз инсулина в виде постоянной инсулиновой помпы [3, 4].
Немаловажное значение в интенсивном лечении больных ГФ в условиях отделения реанимации придается парентеральному питанию с полным возмещением потерянных калорий (не менее 125% от нормативных показателей, в среднем около 3000 ккал/сут), незаменимых аминокислот (таких как аргинин, цитруллин и глютамин) [25, 26]. Показано, что концентрация L-аргинина существенно снижается в плазме крови на фоне сепсиса и коррелирует с высокой летальностью у пациентов с ГФ [4, 21]. Аргинин принимает участие в процессах заживления ран и иммуногенеза, система аргинин-NO играет важную роль в регуляции сосудистого тонуса и артериального давления. Тем не менее, необходимы дальнейшие исследования, чтобы определить потенциальную полезность добавок с аргинином или глутамином у больных сепсисом [4, 38, 39].
Среди адъювантных методов лечения ГФ заслуживает отдельного внимания применение гипербарической оксигенотерапии (ГБОТ), которая официально признана Обществом подводной и гипербарической Медицины США для клинического применения [40-45]. Она осуществляется в условиях инсуфляции кислорода при давлении равном 2,5 абсолютных атмосфер в течение 90 – 120 минут за один сеанс. Экспериментальными исследованиями показано, что ГБОТ приводит к увеличению оксигенации артериальной крови и тканей, активности макрофагов в очаге воспаления, предотвращает дальнейшее распространение некроза тканей и уменьшает общие проявления эндотоксемии [40, 41]. ГБОТ имеет прямой антибактериальный эффект по отношению к клостридиальной флоре путем образования свободных радикалов кислорода; приводит к увеличению внутриклеточного транспорта антибиотиков, повышает эффективность аминогликозидов к синегнойной палочке [41, 43]. ГБОТ играет важную роль в заживлении ран: уменьшает отек за счет вазоконстрикции, стимулирует ангиогенез, синтез фибробластов и образование грануляционной ткани [40-43].
К нежелательным эффектам ГБОТ относятся цитотоксические, приводящие к спазмам мелких сосудов легких в виде одышки наподобие высотной болезни; нейротоксические в виде воздействия на центральную нервную систему с развитием судорог; травматические в виде возможной баротравмы среднего уха [45]. В некоторых случаях до начала ГБОТ рекомендуется выполнение превентивной миринготомии (тимпаностомии) или хирургической имплантации временной тимпаностомической трубки [40, 43].
Эффективность и целесообразность применения ГБОТ при ГФ остаются спорными. Некоторые авторы сообщают о снижении смертности пациентов с ГФ при использовании ГБОТ [40, 42, 43, 44]. R.S.Jr. Hollabaugh и соавт. при анализе 26 случаев ГФ показали различие в летальности при сравнении двух групп пациентов, получавших сеансы ГБОТ (n = 14) и не получавших их (n = 12). В группе без ГБОТ летальность составила 42% против 7% в группе пациентов, получавших ГБОТ в рамках комплексной терапии [43]. Аналогичная работа была проведена F. Ayan и соавт. : на небольшой группе больных (n = 11) была показана меньшая летальность в случае применения ГБОТ в качестве адъювантной терапии ГФ [42]. Заслуживает внимание работа J.J. Shaw и соавт. из Массачусетского университета (США) [40]. Авторы в 2008 – 2010 гг. на базе 14 лечебных центров США впервые провели широкомасштабное мультицентровое исследование эффективности ГБОТ у 1583 пациентов с некротическим фасциитом разной локализации, включая случаи ГФ. Было показано значительное снижение количества осложнений и летальности в группе пациентов, получавших ГБОТ (соответственно 45% и 66%, 4% и 23% при p< 0,01). При этом прямые затраты на лечение и длительность госпитализации в изучаемой и контрольной группах существенно не различались. Однако, в другом более раннем и меньшем по масштабу ретроспективном исследовании M.E. George и соавт., объединяющем 78 пациентов с ГФ в 2 лечебных центрах США, было установлено, что применение ГБОТ не приводит к значительному снижению летальности, количеству санационных некрэктомий и осложнений, длительности антибактериальной терапии и срокам пребывания в стационаре [41].
В настоящее время отсутствует единый протокол ГБОТ при ГФ, что затрудняет разработку официальных рекомендаций по применению ГБОТ в клинической практике в целом [43, 44, 45]. Наличие серьезных побочных реакций ГБОТ пока еще ограничивает рутинное применение метода, прежде всего, у гемодинамически нестабильных пациентов с ГФ [40, 45]. К тому же многие клиники не имеют возможности проведения ГБОТ. В дискуссиях по ГБОТ подчеркивается, что показания к ГБОТ при ГФ должны быть строго обоснованы. Даже при наличии ГБОТ в арсенале клиники, применение данного метода нисколько не должно препятствовать проведению неотложного хирургического лечения (санационной некрэктомии) у пациентов с ГФ [1, 4, 43, 45].
УПРАВЛЕНИЕ РАНЕВЫМ ПРОЦЕССОМ. ТРЕБОВАНИЯ К РАНЕВЫМ ПОВЯЗКАМ. УХОД ЗА РАНАМИ И КОНТРОЛЬ БОЛИ
Управление раневым процессом, учитывая гнойно-некротический характер повреждения мягких тканей наружных половых органов и промежности, которые являются, как известно, рефлексогенными (шокогенными) зонами, относится к важным аспектам раннего послеоперационного периода и начинается уже в операционной [7, 8, 13, 14, 15, 18]. В целом, управление раневым процессом при ГФ определяется множеством факторов, зависящих от конкретного случая, научных воззрений и возможностей клиники.
Температура в операционной должна быть комфортной, чтобы предотвратить переохлаждение, а перевязочные материалы – в широком ассортименте для перевязки анатомически сложных и загрязненных ран. Раневые повязки накладываются таким образом, чтобы из-бежать негативного воздействия на сухожилия, кости или хрящи и предотвратить их от высыхания. Повязки должны обеспечить визуальный контроль течения раневого процесса, развития раневых осложнений в виде присоединения вторичной инфекции и роста дрожжевой флоры [1, 4, 16]. В протоколе первичной хирургической операции важно документировать локализацию и размеры раны, состояние краев раны и окружающих кожныхпокровов, что также позволяет эффективно контролировать ход раневого процесса и оценить необходимость дальнейшей хирургической обработки раны [1, 5, 11, 15]. Раневые повязки не должны ограничивать физическую активность и мобильность пациента для предотвращения внутрибольничных осложнений, таких как пневмония, инфекции мочевыводящих путей, тромбоэмболические осложнения [46-48].
В отношении частоты и вида раневых повязок в 1-ой фазе раневого процесса – фазе гидратации в литературе нет единого мнения. Большинство авторов выполняют ежедневные перевязки, некоторые из них с многократной сменой повязок в течение суток [7, 8, 13]. Некоторые авторы отдают предпочтение редким перевязкам с использованием, так называемых, итерационных (от лат. iteratio — повторяю, в данном случае, способность повязки принимать анатомическую форму раневой поверхности) раневых повязок, на основе антимикробного или пенного перевязочного материала [1, 3, 4, 21, 25]. К преимуществам итерационных повязок относятся: возможность изменение формы повязки, что очень важно при покрытии таких анатомически сложных ран, к каким относятся наружные половые органы и промежность; наличие антимикробного слоя; уменьшение частоты смены повязки; сокращение сроков раневого процесса и времени, требующего для ухода за сложными ранами; возможность визуального исследования раневого экссудата непосредственно через повязку [21, 25]. Главными достоинствами итерационных повязок являются возможность визуальной оценки эволюции раневого процесса (не снимая повязки) и активного воздействия на течение раневого процесса путем орошения раны через повязку различными антисептиками. Для повязок используют перекись водорода, бетадин, левомиколь, жировые эмульсии или альгинат кальция (альгостерил) и т.д. Итерационные повязки накладывают в операционной и используют в период проведения поэтапных санационных некрэктомий до полного очищения раны [3, 4, 21, 25, 27].
После радикальной хирургической обработки и некрэктомии местную санацию гнойного очага проводят с учетом фазы раневого процесса. В фазе гидратации выполняется туалет раны растворами различных антисептиков (фурацилин, диоксидин, водный раствор хлоргексидина, 0,5% раствор гипохлорита натрия или раствор Дейкина, 3% раствор перекиси водорода) с применением влажно-высыхающих раневых повязок [1, 3, 7, 8]. Указывается на необходимость соблюдения мер предосторожности при использовании раствора перекиси водорода у больных ГФ, получающих одновременно сеансы ГБОТ [11, 15]. При этом возможны взрывоопасные ситуации и тромбоэмболические осложнения при высвобождении свободного кислорода под давлением. Кроме того, при применении раствора перекиси водорода необходимо помнить о развитии искусственной подкожной крепитации, которая может симулировать прогрессирование ГФ [33, 45, 46]. Для улучшения отторжения гнойно-некротических масс у ряда больных при перевязках также используются препараты, обладающие коллагенолитической активностью (ируксол, колладиосорб) и растворы протеолитических ферментов (химопсин, химотрипсин) [7, 9, 18]. Некоторые авторы придают значение применению ферментных санаций раны с использованием липофилизированной коллагеназы, фибринового клея для закрытия дефектов кожи, не имеющих активного бактериального заражения [11, 16, 37]. С целью ускорения процесса очищения раны применяют ультразвуковую кавитацию раны (аппарат УРСК-7н-18, ультразвук низкой частоты) [1, 7, 9]. Перспективными считается лазерное облучение раневой поверхности (гелий-неоновый лазер низкой интенсивности) с помощью аппарата АФЛ-1, орошение ран струей кислорода или озоновоздушной смесью, гидропрессивную обработку озонированным 0,9% раствором NaCl, местное применение комбинированного препарата офлотримол-2 и гемасепта, аппликации сорбционных тампонов-дренажей [25, 29, 38, 48].
В фазе дегидратации при перевязках используются водорастворимые мази на полиэтиленоксидной основе («Левомеколь» или «Диоксиколь»), обладающие высокими дегидратирующим и санирующим свойствами [7, 8, 9, 14]. Немало публикаций уделено применению медотерапии при ГФ [1, 3, 4, 49-51]. Природный и необработанный мед используется с хорошими результатами при лечении гнойных ран и трофических язв кожи различного генеза. Антибактериальный эффект меда, как полагают, связан с его гипертоническими свойствами и наличием феноловых кислот [49, 50]. Мед создает кислую среду (рН меда = 3,6), губительную для многих микроорганизмов, а также содержит ферменты, которые переваривают некротические ткани. При применении медотерапии очищение раны достигается быстро: в течение 57 дней [1, 4, 51]. К сожалению, рандомизированные исследования об эффективности меда у пациентов с ГФ в доступной литературе отсутствуют.
При переходе раневого процесса в фазу пролиферации (регенерации) основной задачей местной санации ран является стимуляция роста созревания соединительной ткани. С этой целью применяют поливалентную системную терапию с использованием топических препаратов местного применения (куриозин), антиоксидантов (токоферол, аевит) и депротеинизированных дериватов крови телят (солкосерил, актовегин) [6-9, 52-54]. Учитывая данные литературы о роли сосудистого фактора в сложном патогенезе ГФ, в комплекс лечения больных старше 40 лет включаются антикоагулянты (гепарин, фраксипарин), ангиопротекторы (трентал, пентоксифиллин) и препараты, улучшающие микроциркуляцию и реологические свойства крови (реополиглюкин) [11, 13, 16, 54].
Среди новых технологий в качестве местного адъювантного лечения обширных ран у пациентов с ГФ применяется метод локальной вакуумной терапии (ЛВТ) с использованием отрицательного атмосферного давления (около 125 мм. рт. ст.) [55-64]. ЛВТ рекомендуется во 2-й фазе раневого процесса (фазе дегидратации), как правило, после неоднократных операций – некрэктомий, на этапе очищения раны и формирования грануляционной ткани [57, 61]. Система для создания отрицательного атмосферного давления состоит из портативного вакуумного усилителя (устройства переменного тока), гибкого шланга и клейкой полиуретановой пленки, которой герметично закрывают раневую поверхность. Устройство работает циклически, каждый цикл работы включает 5-ти минутное воздействие отрицательного давления на раневую поверхность с последующим 2-х минутным перерывом (рис. 6).
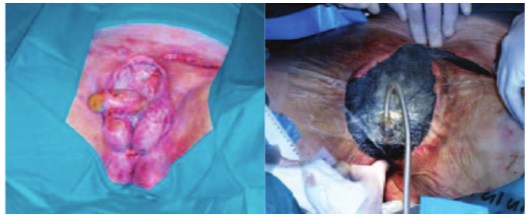
Рис. 6. Применение итерационной раневой повязки и вакуумной терапии после некрэктомии при ГФ с тотальным некрозом мошонки и кожи полового члена [63]
Механизмы терапевтического воздействия отрицательного давления на раневой процесс окончательно не изучены. В экспериментальных и клинических исследованиях показано, что метод ЛВТ позволяет уменьшить раневой отек, улучшить микроциркуляцию в ране и формирование грануляционной ткани, оптимизирует процессы фагоцитоза и элиминации бактерий из раны [55, 56, 60, 61, 64]. Кроме того, циклическое применение отрицательного атмосферного давления изменяет «клеточный скелет» раневого ложа, вызывая каскад внутриклеточных сигналов, повышающих скорость деления клеток и последующее формирование грануляционной ткани [61-64]. В итоге, применение ЛВТ позволяет сократить сроки заживления ран и число перевязок, уменьшить количество и объем реконструктивных операций, обеспечивает лучшую приживаемость кожных трансплантатов [62, 64]. Достоинством ЛВТ является также возможность ее использования на анатомически сложных раневых поверхностях, к которым относятся промежность, наружные половые органы и аноректальная область [55, 58].
К сожалению, с учетом редкости заболевания, в настоящее время в доступной литературе отсутствуют сообщения о широкомасштабных (мультицентровых) рандомизированных исследованиях, посвященных эффективности ЛВТ при ГФ. Выводы авторов основываются, как правило, на небольшом количестве наблюдений, за исключением, пожалуй, работы R. Czymek и соавт. [55]. Авторы выполнили проспективное исследование 35 пациентов с ГФ, которые после хирургического лечения (некрэктомии) в зависимости от способа местной терапии были разделены на две группы. 1-ая группа пациентов (n = 16) получала традиционное лечение с использованием обычных антисептических перевязок с полигексанидом, во 2-ой группе (n = 19) применялась ЛВТ. По возрасту, соматическому статусу, каузативной микрофлоре и тяжести ГФ пациенты обеих групп не различались. В результате лечения смертность во 2-ой группе пациентов, получающих ЛВТ, была в 7,5 раз ниже смертности в 1-ой группе пациентов (5,3% и 37,5%, соответственно). Однако при этом сроки госпитализации и количество энтеростомий были в 3 и в 2 раза выше во 2-ой группе (27,8 койкодней и 96,8 койко-дней; 43,8% и 89,5%, соответственно в 1-ой и во 2-ой группах), что отчасти объясняется высокой летальностью в 1-ой группе пациентов. Несмотря на эти противоречивые результаты, авторы считают, что ЛВТ является методом выбора при лечении сложных ран (по анатомическому рельефу раневой поверхности и площади) у пациентов с ГФ и позволяет значительно снизить летальность у этого контингента больных. Длительность применения ЛВТ в приведенных публикациях не ограничена и определяется площадью раневой поверхности и индивидуальными сроками течения раневого регенераторного процесса [56, 59, 63, 64]. Через каждые 2-3 суток происходит смена вакуумной раневой повязки [61, 62].
ЛВТ хорошо переносится пациентами и в настоящее время широко применяется в лечении сложных хирургических и травматических ран, открытых переломов, пролежней, диабетических и венозных трофических язв конечностей [59]. К возможным недостаткам ЛВТ относятся высокая стоимость лечения и необходимость иммобилизации пациента [60, 64].
Учитывая выраженность и обширность гнойно-некротического поражения при ГФ, одной из важных проблем ухода за раной является купирование боли, которую пациенты с ГФ многократно испытывают в ходе заживления раны и реабилитации [7, 8, 13, 14, 38, 65]. Применяются фармакологические и нефармакологические методы купирования болей. Фармакологические методы обезболивания и седации являются основными, нефармакологические методы лечения в виде релаксации, массажа, гипноза относятся к вспомогательным. Для объективной оценки выраженности болей разработаны аналоговые шкалы полуколичественной (балльной) оценки, основанные на мимике и жестах [11, 15, 38]. У пациентов с ГФ выделяют 3 типа болей: фоновые; острые, связанные с физической активностью; и острые, связанные с перевязкой [38, 65]. Каждый тип болей требует дифференцированного подхода для купирования. Фоновые боли являются относительно постоянными и возникают с развитием ГФ. Они могут быть разной степени выраженности: от легкой до умеренной, их лучше всего купировать наркотическими анальгетиками длительного действия, например: метадоном, сохраняющим терапевтическую активность в течение 24-48 часов в зависимости от дозы и индивидуального метаболизма препарата [3, 4, 7, 21]. Острая боль, спровоцированная физической активностью и негативными эмоциями, хорошо купируется применением опиатов короткого действия – морфином или оксикодоном [9, 13, 16, 48]. В качестве дополнения к опиатам применяют препараты синергетического действия – ацетаминофен или нестероидные противовоспалительные средства, позволяющие существенно уменьшить дозу наркотических анальгетиков. Острые боли жгучего характера, возникающие во время смены повязки, санации раны или физиолечения, сопровождаются эмоциальной тревогой и хорошо купируются фентанилом в сочетании с морфином или оксикодоном или препаратами анксиолитического действия – мидазоламом или лоразепамом [15, 38]. В некоторых тяжелых случаях пациенты с ГФ продолжают принимать наркотические анальгетики в домашних условиях, вопрос о продолжении анальгетической терапии решается в индивидуальном порядке. В последнее время для уменьшения острой боли используется противоэпилептический препарат габапентин, который показал свою эффективность в небольших рандомизированных клинических исследованиях [3, 38, 65]. Препарат обладает противосудорожным, опиоидным и диуретическим действием и используется для облегчения боли при постгерпетической невралгии, нейропатической боли после крупных хирургических санаций или ампутаций, у больных с ожоговой травмой [4, 65].
ИММУНОТЕРАПИЯ ГФ
Наличие в ране газообразующей флоры является основанием для применения лечебной дозы (150 000 МЕ) поливалентной противогангренозной сыворотки. Некоторые авторы при открытых травмах аногенитальной области применяют противостолбнячную сыворотку [14, 38, 45, 52]. Поливалентную медикаментозную терапию проводят на фоне стимуляции иммунобиологической реактивности организма и репаративных процессов в ране. С этой целью применяются тималин, иммуномакс, переливание эритроцитной массы, нативной и антистафилококковой плазмы, антистафилококковый гамма-глобулин и альбумин [7, 8, 38, 53, 54]. Применение последних трех препаратов при ГФ остается предметом дискуссий, так как нерандомизированными исследованиями выявлена их низкая и сомнительная эффективность при ГФ [38, 53, 54]. Тем не менее, работами некоторых авторов показано, что антистафилококковый гаммаглобулин при внутривенном введении способен связывать и дезактивировать стафилококковый и стрептококковый экзотоксины, а также ограничивать системный воспалительный ответ при ГФ, особенно, у иммунодефицитных больных [3, 4, 38].
РЕКОНСТРУКТИВНОПЛАСТИЧЕСКИЕ ОПЕРАЦИИ ПРИ ГФ
Кроме активной хирургической санации, задачами оперативного лечения ГФ являются реконструкция мягких тканей аногенитальной зоны местными тканями и по показаниям – восстановительные операции, направленные на пластическое закрытие дефектов пораженных зон [2, 5, 6, 9, 13, 14]. Реконструктивно-пластические операции проводятся после очищения раны от некротизированных тканей и формирования грануляционной ткани. К этим операциям относятся кожная пластика местными тканями, аутодермопластика расщепленным или перфорированным лоскутом, мышечная пластика, стебельчатая пластика и их комбинации [3, 12]. Пластическим материалом служат паховый лоскут, лоскуты медиальных поверхностей бедер, микрохирургические лоскуты. Они применяются для замещения утраченных тканей мошонки и полового члена, перианальной области с большим дефицитом покровных тканей [1, 4, 11, 13, 14, 18, 25]. Используются также методы дермотензии при помощи временных подкожных экспандеров для закрытия кожных дефектов, которые часто бывают весьма обширными и напоминают последствия глубоких ожогов во второй фазе раневого процесса [7, 8, 15].
Для временной пластики больших кожных дефектов у соматически тяжелых и ослабленных пациентов при загрязненной ране в ряде случаев применяют временные заменители кожи (ксенотрансплантаты кожи свиньи и композитные ксенотрансплантаты крупного рогатого скота, кожные трупные аллотрансплантаты, силиконовые перфорированные трансплантаты и т.д.) [25, 50, 51, 53]. Они позволяют быстро и полностью закрыть раневую поверхность, чтобы уменьшить потерю жидкости, белков и электролитов, защитить рану от микробной контаминации, обеспечить менее болезненный уход за раной и раннюю мобилизацию. Через 10-14 суток после улучшения состояния пациента временный трансплантат удаляется и осуществляется окончательный этап дерматопластики одним из указанных выше способом [50, 53, 65].
Пластика мошонки при поражении менее 50% ее площади осуществляется местными тканями, учитывая хорошую эластичность мошонки; если площадь поражения мошонки превышает 50%, выполняют пластику мошонки и/или полового члена полнослойным кожным лоскутом [11, 15, 18, 65, 66]. При полном обнажении яичек и/или полового члена самым простым методом является временное перемещение полового члена яичек под кожу лобковой и паховых областей передней брюшной стенки, медиальной поверхности бедер с последующей кожной пластикой полового члена и мошонки через 1-2 месяца (операции Б.А. Вицина; А. Такача) [17, 18, 21].
Результаты пластических операций при ГФ хорошие. При обобщенном анализе результатов хирургического лечения 274 больных ГФ (по данным различных авторов за последние 10 лет) в пластическом закрытии обширных дефектов кожи после выполненных некрэктомий нуждались 177 пациентов (64,5% или от 50% до 83,6% больных в зависимости от серии наблюдений) [24, 66-70]. При этом пластика собственными тканями выполнена у 30% больных, свободными лоскутами – у 55% и комбинированные виды пластик – у 10%. В качестве свободных лоскутов использовались мышечно-кожный лоскут нежной мышцы бедра, срамной фасциальнокожный лоскут бедра, бедренные и паховые тонкие (0,016 дюйма) и супертонкие (0,012 дюйма) кожные лоскуты, обширные кожные лоскуты передней брюшной стенки. Удовлетворительные результаты пластических операций были достигнуты в большинстве случаев: в 50 (94,4%) из 53 [24] и в 33 (90,2%) из 40 случаев [67].
СРОКИ ГОСПИТАЛИЗАЦИИ И ЭКОНОМИЧЕСКИЕ ЗАТРАТЫ НА ЛЕЧЕНИЕ ПРИ ГФ
ГФ сопровождается длительной госпитализацией: от 2 до 278 койко-дней (для выживших пациентов – 34,8±18,8 койко-дней, для умерших – 61,6±38,9 койко-дней) [21, 27, 33, 70]. При собственном анализе 769 случаев ГФ, представленных в 14 крупных клинических исследованиях за последние 15 лет [21-30, 53, 66, 67, 70], сроки госпитализации варьировали от 1 до 106 койко-дней. Минимальный, средний и максимальный сроки госпитализации пациентов с ГФ составили: 1-8 койко-дней (4,2±2,2 койкодней), 9,2-48,0 койко-дней (25,4 ± 11,2 койко-дней) и 31 – 106 койкодней (55,3 ± 23,8 койко-дней), соответственно. Более чем в 65% случаев средний срок госпитализации при ГФ превышал 20 койко-дней. Длительность лечения была обусловлена соматически тяжелым контингентом пациентов, гнойно-некротическим характером и обширной площадью поражения мягких тканей, септическим течением заболевания, необходимостью проведения хирургического восстановительного лечения по устранению дефектов мягких тканей и нормализации функции наружных половых органов.
Лечение пациентов с ГФ сопровождается немалыми экономическими затратами. Расходы на лечение одного пациента в среднем составляют 27 646 долларов (для выживших больных – 26 574 долларов, для умерших – 40 871 долларов) [68]. После выписки из стационара нуждаются в постоянном уходе не менее 30% пациентов, в повторных реконструктивно-пластические операциях на наружных половых органах и промежности – более 50% больных, перенесших ГФ [16, 68].
ЗАКЛЮЧЕНИЕ
Лечебная тактика при ГФ строится на принципах оказания специализированной медицинской помощи пациентам с некротическими и гнойно-септическими поражениями мягких тканей, лечение начинается с неотложных хирургических мероприятий, прежде всего, с иссечения некротизированных мягких тканей наружных половых органов и промежности (рис. 7). С учетом соматически тяжелого контингента пациентов, лечение ГФ может оказаться непростой задачей, требующей мультидисциплинарного подхода с привлечением специалистов по гнойной, пластической, гравитационной хирургии, реаниматологов, клинических фармакологов, иммунологов, терапевтов, эндокринологов и т.д. Лечение пациентов с ГФ является многоплановым, в зависимости от стадии заболевания и тяжести больного оно включает применение различных хирургических и терапевтических методик. Выбор лечебных мероприятий уточняется в каждом конкретном случае и зависит от объема и характера поражения мягких тканей, фазы раневого процесса, тяжести состояния пациента, наличия осложнений и сопутствующих заболеваний. Некоторые аспекты применения различных видов лечения при ГФ (антибактериальная и вакуумная терапия, гипербарическая оксигенотерапия, иммунотерапия, реабилитационное лечение) нуждаются в дальнейшем изучении.
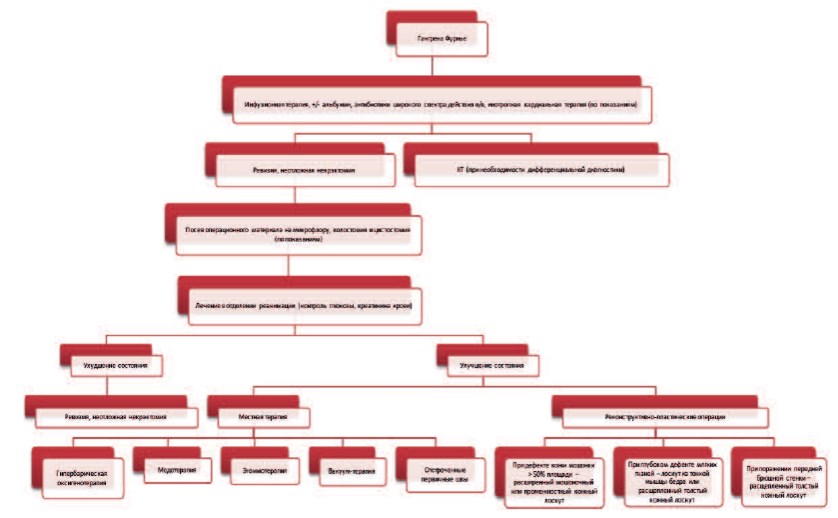
Рис. 7. Алгоритм лечения больных ГФ ( [25] с дополнениями)
ЛИТЕРАТУРА
1. Temiz M. Fournier’s gangrene. Emerg Med 2014;4(3):1 – 2.
2. Привольнев В.В. Гангрена Фурнье. Медицинский вестник МВД 2013;67(6):2632.
3. Sroczyński M, Sebastian M, Rudnicki J, Sebastian A, Agrawal AK. A comlex approach to the treatment of Fournier’s gangrene. Adv Clin Exp Med 2013;22(1):131-135.
4. Mallikarjuna MN, Vijayakumar A, Patiel VS, Shivswamy BS. Fournier’s gangrene: current practices. ISRN Surgery 2012;2012:942437. doi: 10.5402/2012/942437. Epub 2012 Dec 3.
5. Новошинов Г.В., Шереметьева А.А., Старченкова Л.П. Гангрена Фурнье у ребенка 1 месяца. Детская хирургия 2016(1):51-52.
6. Привольнев В.В., Плешков В.Г., Козлов Р.С., Савкин В.А., Голуб А.В. Диагностика и лечение некротических инфекций кожи и мягких тканей на примере гангрены Фурнье. Амбулаторная хирургия 2015;(34):50 – 57.
7. Алиев С.А., Алиев Э.С., Мирзоев Р.А., Мирзоева К.А. Гангрена Фурнье – разновидность клинической модели критических состояний в хирургии. Вестник хирургии им. И.И. Грекова 2015;(1):84-89.
8. Алиев С.А., Алиев Э.С. Гангрена Фурнье – актуальные аспекты старой болезни в свете современных представлений о патогенезе. Вестник хирургии им. И.И. Грекова 2014;(2):122 – 126.
9. Черепанин А.И., Светлов К.В., Чернов А.Ф., Бармин Е.В. Другой взгляд на «болезнь Фурнье в практике хирурга». Хирургия 2009;(10):47-50.
10. Khamnuan P, Chongruksut W, Jearwattanakanok K, Patumanond J, Yodluangfun S, Tantraworasin A. Necrotizing fasciitis: risk factors of mortality. Risk Management and Healthcare Policy 2015;(8):1-7.
11. Егоркин М.А. Современные подходы к лечению острого анаэробного парапроктита. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2011;(3):74-79.
12. Yanar H, Taviloglu K, Ertekin C, Guloglu R, Zorba U, Cabioglu N, et al. Fournier’s gangrene: risk factors and strategies for management. World J Surg 2006;30(9):1750-1754.
13. Алиев С.А., Рафиев С.Ф., Рафиев Ф.С., Алиев Е.С. Болезнь Фурнье в практике хирурга. Хирургия 2008;(11):58-63.
14. Алиев С.А., Алиев Е.С, Зейналов В.М. Болезнь Фурнье в свете современных представлений. Хирургия 2014;(4):34-39.
15. Егоркин М.А. Гангрена Фурнье и анаэробный парапроктит – разные клинические формы одного клинического процесса? Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2012;(4):66-72.
16. Ефименко Н.А., Привольнев В.В. Гангрена Фурнье. Клиническая микробиология и антимикробная химиотерапия 2008;10(1):34-42.
17. Гринев М.В., Сорока И.В., Гринев К.М. Гангрена Фурнье – клиническая разновидность некротизирующего фасциита. Урология 2007;(6):69-73.
18. Ягудаев Д.М., Дербенев В.А., Айвазян Д.Р., Соколов Д.А. Современный взгляд на лечение гнойных ран мошонки (обзор литературы). Лазерная медицина 2015;(2):57-65.
19. Тимербулатов М.В., Тимербулатов В.М., Гайнутдинов Ф.М., Куляпин А.В. Анаэробный парапроктит. Креативная хирургия и онкология 2011;(3):4-7.
20. Гринев К.М., Гринев М.В. Гангрена Фурнье. Вестник хирургии им. И.И. Грекова 2008;(1):113-116.
21. Altarac S, Katušin D, Crnica S, Papeš D, Rajković Z, Arslani N. Fournier’s gangrene: etiology and outcome analysis of 41 patients. Urol Int 2012;88(3):289-293.
22. Barreda JT, Scheiding MM, Fernandez CS, Campaña CJM, Aguilera JR, Miranda EF, et al. Fournier’s gangrene. A retrospective study of 41 cases. Cir Esp 2010;87(4):218-223.
23. Benjelloun el B, Souiki T, Yakla N, Ousadden A, Mazaz K, Louchi A, et al. Fournier’s gangrene: our experience with 50 patients and analysis of factors affecting mortality. World J Emerg Surg 2013;8(13):1-5.
24. Eskitaşcıoğlu T, Özyazgan I, Coruh A, Günay GK, Altıparmak M, Yontar Y, et al. Experience of 80 cases with Fournier’s gangrene and “trauma” as a trigger factor in the etiopathogenesis. Ulus Travma Acil Cerrahi Derg 2014;20(4):265-274.
25. Ferreira PC, Reis JC, Amarante JM, Silva AC, Pinho CJ, Oliveira IC, et al. Fournier’s gangrene: a review of 43 reconstructive cases. Plast Reconstr Surg 2007;119(1):175-184.
26. Ghnnam WM. Fournier’s gangrene in Mansoura Egypt: a review of 74 cases. J Postgrad Med 2008;54(2):106-109.
27. Rohan Khandelwal, Chintamani, Megha Tandon, Arjun Saradna A, Deepansh Gupta D, Bhavya Bahl B. Fournier’s gangrene severity index as a predictor of outcome in patients with Fournier’s gangrene: a prospective clinical study at a tertiary care center. J Young Med Res 2013;1(1):1-5.
28. Koukouras D, Kallidonis P, Panagopoulos C, Al-Aown A, Athanasopoulos A, Rigopoulos C, et al. Fournier’s gangrene, a urologic and surgical emergency: presentation of a multiinstitutional experience with 45 cases. Urol Int 2011;86:167-172.
29. Korkut M, Içöz G, Dayangaç M, Akgün E, Yeniay L, Erdoğan O, et al. Outcome analysis in patients with Fournier’s gangrene: report of 45 cases. Dis Colon Rectum 2003;46(5): 649-652.
30. Unalp HR, Kamer E, Derici H, Atahan K, Balci U, Demirdoven C, et al. Fournier’s gangrene: evaluation of 68 patients and analysis of prognostic variables. J Postgrad Med 2008;54(2):102-105.
31. Erol B, Tuncel A, Hanci V, Tokgoz H, Yildiz A, Akduman B, et al. Fournier's gangrene: overview of prognostic factors and definition of new prognostic parameter. Urology 2010;75(5):1193-1198.
32. Akcan A, Sözüer E, Akyildiz H, Yilmaz N, Küçük C, Ok E. Necessity of preventive colostomy for Fournier's gangrene of the anorectal region. Ulus Travma Acil Cerrahi Derg 2009;15(4):342-346.
33. Estrada O, Martinez I, Del Bas M, Salvans S, Hidalgo LA. Rectal diversion without colostomy in Fournier's gangrene. Tech Coloproctol 2009;13(2):157-159.
34. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJ, Gorbach SL, et al. Practice Guidelines for the Diagnosis and Management of Skin and Soft Tissue Infections: 2015 Update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59(2):147-59.
35. Grabe M, Bartoletti R, Bjerklund TE, Cai T, Çek M, Köves B, et al. Guidelines on Urological Infections. European Association of Urology. 2015. 86 p.
36. Бутранова О.И., Рязанова А.Ю. Лекарственная терапия инфекций кожи и мягких тканей. Лекарственный вестник 2011;6(1):27-35.
37. Голуб В.В., Привольнев В.В. Местная антибактериальная терапия хирургических инфекций кожи и мягких тканей в амбулаторных условиях: слагаемые успеха. Раны и раневые инфекции 2014;1(1):33-38.
38. Hakkarainen TW, Kopare NM, Fellow B, Evans HL. Necrotizing soft tissue infections; review and current concepts in treatment, systems of care, and outcomes. Curr Probl Surg 2014;51(8):344-362.
39. Al Shukry S, Ommen J. Necrotizing fasciitis – report of 10 cases and review of recent literature. J Med Life 2013;6(2):189-194.
40. Shaw JJ, Psoinos Ch, Emboff TA, Shan ShA, Santry HP. Not just full of hot air: hyperbaric oxygen therapy increases survival in cases of necrotizing tissue infections. Surg Infect 2014;15(3):328-335.
41. George ME, Rueth NM, Skarda DE, Chipman JG, Quickel RR, Beilman GJ. Hyperbaric oxygen does not improve outcome in patients with necrotizing soft tissue infection. Surg Infect 2009;10(1):21-28.
42. Ayan F, Sunamak O, Paksoy SM, Polat SS, As A, Sakoglu N, et al. Fournier's gangrene: a retrospective clinical study on forty-one patients. ANZ J Surg 2005;75(12):1055-1058.
43. Hollabaugh RSJr, Dmochowski RR, Hickerson WT, Cox SE. Fournier's gangrene: therapeutic impact of hyperbaric oxygen. Plast Reconstr Surg 1998;101(1):94-100.
44. Багаев В.Г., Сергеева В.В., Боброва А.А., Мединский П.В., Налбандян Р.Т., Давыдов М.Ю. и др. Гипербарическая оксигенация в комплексной терапии ран у детей. Раны и раневые инфекции 2014;1(2):31-37.
45. Wróblewska M, Kuzaka B, Borkowski T, Kuzaka P, Kawecki D, Radziszewski P. Fournier’s gangrene – current concepts. Pol J Microbiol 2014;63(3):267-273.
46. Machado NO. Necrotizing fasciitis: The importance of early diagnosis, prompt surgical debridement and adjuvant therapy. North Am J Med Sci 2011;3(3):107-118.
47. Строй А.А., Баныра О.Б., Мицик Ю.О., Лесняк О.М., Шеремета Р.З., Шатинська-Мицик И.С. и др. Молниеносная спонтанная гангрена мошонки: наш опыт лечения. // Экспериментальная и клиническая урология. 2010;(10):53-55.
48. Тимербулатов В.М., Хасанов А.Г., Тимербулатов М.В. Гангрена Фурнье. Хирургия 2009;(3):26-28.
49. Sarani B, Strong M, Pascual J, Schwab C.W. Necrotizing fasciitis: current concepts and review of the literature. J Am Col. Surg 2009;208(2):279-288.
50. Thwaini A, Khan A, Malik A, Cherian J, Barua J, Shergill I, et al. Fournier’s gangrene and its emergency management Postgrad Med J 2006;82(970):516-519.
51. Shyam DC, Rapsang AG. Fournier’s gangrene. Surgeon 2013;11(4):222-232.
52. Fabri PJ. Necrotizing soft tissue infections. J Am Coll Surg 2014;218(2):302-303.
53. Sabzi Sarvestani A, Zamiri M, Sabouri M. Prognostic factors for Fournier’s gangrene; a 10-year experience in Southeastern Iran. Bull Emerg Trauma 2013;l(3):116-122.
54. Roje Z, Roje Z, Matić D, Librenjak D, Dokuzović S, Varvodić J. Necrotizing fasciitis: literature review of contemporary strategies for diagnosing and management with three case reports: torso, abdominal wall, upper and lower limbs. World J Emerg Surg 2011;6(1):1-17.
55. Czymek R, Schmidt A, Eckmann C, Bouchard R, Wulff B, Laubert T, et al. Fournier's gangrene: vacuum-assisted closure versus conventional dressings. Am J Surg 2009;197(2):168-176.
56. Ozturk E, Ozguc H, Yilmazlar T. The use of vacuum assisted closure therapy in the management of Fournier's gangrene. Am J Surg 2009;197(5):660-665.
57. Morykwas MJ, Simpson J, Punger K, Argenta A, Kremers L, Argenta J. Vacuum-assisted closure: state of basic research and physiologic foundation. Plast Reconstr Surg 2006;117(7 Suppl):121S-126S.
58. Ye J, Xie T, Wu M, Ni P, Lu S. Negative pressure wound therapy applied before and after split-thickness skin graft helps healing of Fournier gangrene: a case report (CARE-Compliant). Medicine (Baltimore) 2015;94(5):e426.
59. Herlin C. Negative pressure therapy in the loss of perineal substance. Soins 2014;(782):37-38.
60. Yeo ES, Kam MH, Eu KW. Management of Fournier's gangrene with vacuumassisted closure dressing. Ann Acad Med Singapore 2010;39(10):806-808.
61. Cuccia G, Mucciardi G, Morgia G, Stagno d’Alcontres F, Gali A, et al. Vacuum-assisted closure for the treatment of Fournier's gangrene. Urol Int 2009;82(4):426-431.
62. Tucci G, Amabile D, Cadeddu F, Milito G. Fournier's gangrene wound therapy: our experience using VAC device. Langenbecks Arch Surg 2009;394(4):759-760.
63. Zagli G, Cianchi G, Degl’innocenti S, Parodo J, Bonetti L, Prosperi P, et al. Treatment of Fournier’s gangrene with combination of vacuum-assisted closure therapy, hyperbaric oxygen therapy, and protective colostomy. Case Rep Anesthesiol 2011; 2011:430983. doi: 10.1155/2011/430983. Epub 2012 Jan 23.
64. Сергеев К.Н., Жаглин А.В. Использование системы лечения ран отрицательным давлением у пациентов с осложненной костной травмой. Раны и раневые инфекции 2014;1(2):44-50.
65. Agostini T, Mori F, Perello R, Dini M, Russo GL. Successful combined approach to a severe Fournier's gangrene. Indian J Plast Surg 2014;47(1):132-136.
66. Каштальян М.А., Герасименко О.С., Околец В.П., Масунов К.Л. Хирургическое лечение некротических инфекций мягких тканей. Шпитальна Хiрургiя 2013;(3):96-98.
67. Carvalho JP, Hazan A, Cavalcanti AG, Favorito LA. Relation between the area affected by Fournier’s gangrene and the type of reconstructive surgery used. A study with 80 patients. International Braz J Urol 2007;33(4):510-514.
68. Sorensen MD, Krieger JN, Rivara FP, Klein MB, Wessels H. Fournier’s gangrene: management and mortality predictors in a population based study. J Urol 2009;182(6):2742-2747.
69. Baris Yildiz, Derya Karakoc, Erhan Hamaloglu, Arif Ozdemir, Ahmet Ozenc. What changed in necrotizing fasciitis in twenty-five years? African J of Microbiol Research 2011;5(16):2229-2233.
70. Gӧktas C, Yildirim M, Horuz R, Faydaci G, Akca O, Cetinel CA. Factors affecting the number of debridements in Fournirs’s gangrene: our results in 36 cases. Ulus Travma Acil Cerrahi Derg 2012;18(1):43-48.










Комментарии