Перепечай В. А.2 , Коган М.И.1 , Васильев О.Н.1
1 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Клиническая больница №1, ФГУ «Южный окружной медицинский центр ФМБА России», г.Ростов-на-Дону Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014448 Эл.почта: perepechay_va@mail.ru, dept_kogan@mail.ru, vasilyev_on@mail.ru
Введение
Радикальная цистэктомия (РЦЭ) является стандартным методом лечения инвазивного и немышечноинвазивного рака мочевого пузыря высокого риска рецидива и прогрессии. РЦЭ в настоящее время не рассматривается как инвалидизирующая операция, сопряженная с высоким риском летальности, тяжелыми послеоперационными осложнениями и последующим неблагоприятным прогнозом в отношении продолжительности жизни больных. Этого удалось достигнуть благодаря усовершенствованию техники РЦЭ и разработке новых, более надежных методов послеоперационного отведения мочи. К настоящему времени разработаны разнообразные виды деривации мочи после РЦЭ, однако ортотопическая неоцистопластика лучше всего моделирует врожденный мочевой пузырь, обеспечивая адекватную емкость созданного резервуара, функцию его опорожнения и лучшее качество жизни пациентов. Ортотопическое замещение мочевого пузыря является стандартной формой после РЦЭ при отсутствии противопоказаний. Многочисленные исследования показывают безопасность и отдаленную надежность данного вида деривации мочи, а также преимущества перед инконтинентными методиками. Создание ортотопического резервуара с достаточной емкостью, низким внутрипросветным давлением и адекватной защитой верхних мочевых путей позволяет достичь максимальной медицинской и социальной реабилитации больных, подвергнутых РЦЭ. Основным условием полноценной социальной и психологической реабилитации пациентов сегодня следует считать восстановление самостоятельного мочеиспускания. Учитывая данный факт, при возможности выполнения ортотопического замещения мочевого пузыря, его следует предпочесть другим способам деривации мочи. Для ортотопической реконструкции мочевого пузыря используются сегменты подвздошной кишки, восходящей, поперечной, нисходящей, сигмовидной толстых кишок, сочетание этих сегментов, реже – стенка желудка, кожно-мышечные лоскуты. В середине 90-х годов ортотопическое замещение мочевого пузыря в большинстве медицинских центров мира стало стандартным методом реконструкции, а у 90% больных используется с этой целью ортотопический мочевой пузырь из подвздошной кишки (Moutie J.F. 1997 г., Studer R.E. et al. 1998 г., Hautmann R.E. et al 1999, 2001 гг.).
Описывается несколько методик ортотопической кишечной цистопластики в различных модификациях, однако широко применяемыми являются методики Camey II, Hemi Kock, Hautmann и Studer. Данные методики имеют минимальные различия по функциональным результатам, при наличии как преимуществ, так и своих недостатков (таблица 1). По континентности и адекватности опорожнения имеет место закономерная дневная и ночная вариабельность. Удержание мочи улучшается на протяжении 3 лет после ортотопической деривации мочи, результатом чего является дневное удержание у 90% пациентов, ночное – у 70-85 % соответственно [8].
Таблица 1. Результаты различных методик ортотопической энтероцистопластики
| Camey I [1] | Camey I [2,3] | Hautmann И1 | Hemi-Kock [4, 5, 6, 7] | Studer [41 | |
|---|---|---|---|---|---|
| Дневное удержание | 20-80% | 96% | 83,70% | 85-87% | 92% |
| Ночное удержание | 0-80% | 78% | 66% | 75-94% | 80% |
| Рефлюкс в верхние мочевые пути | 15% | 15% | 3,30% | 17% | - |
| Максимальное давление в резервуаре | 43 см Н20 | 32 cm Н20 | 30 см Н20 | <40 см Н20 | 20-30 см Н20 |
| Ранние п/операционные осложнения | - | 12% | 15% | 17,80% | 11% |
| Поздние п/операционные осложнения | - | 24% | 23% | 15,70% | 18% |
| Средняя емкость неоциста | - | - | 433 мл | 709 мл | 450-500 мл |
В настоящее время необходимо выбирать метод деривации мочи с наименьшим количеством ранних и отдаленных осложнений и обеспечением наилучшего качества жизни больного после операции [9]. Большинство исследований за последние десять лет показывает на предпочтение при выборе метода ортотопической илеоцистопластики – операции по Studer. Однако результаты этой и других методик тонкокишечной ортотопической реконструкции значительно хуже при интраоперационно выявленной короткой брыжейке тонкой кишки, которая обусловливает натяжение тканей по линии уретрорезервуароанастомоза, что препятствует безопасному выполнению ортотопической операции и вынуждает хирурга прибегать к альтернативным вариантам кишечной деривации мочи. Таким образом, к одному из недостатков тонкой кишки относят ограниченные возможности применительно к ортотопической цистопластике из-за того, что у ряда пациентов оказываются короткими сосуды брыжейки для беспрепятственного низведения сегмента подвздошной кишки в малый таз и наложения анастомоза между кишечным мочевым пузырем и уретрой без натяжения [10]. В связи с этим известно, что одним из характерных осложнений среди прочих является несостоятельность резервуароуретрального анастомоза при всех известных и наиболее применяемых методиках ортотопической илеоцистопластики. Даже минимальное натяжение в зоне анастомоза между кишечным резервуаром и уретрой остается серьезной проблемой и является основной причиной несостоятельности анастомоза с формированием мочевых затеков, перитонита, сепсиса, кишечной непроходимости, мочевых свищей с необходимостью повторных операций.
Это заставляет хирурга в случае имеющегося натяжения в анастомозе менять интраоперационно план реконструкции, отказываться от ортотопической операции, прибегать к другим, более сложным ее вариантам (гетеротопической, кондуитной, отведению в непрерывный кишечник и др.), которые с позиции качества жизни оказываются заведомо хуже в сравнении с ортотопической деривацией, либо выполнять дополнительные резекции кишечника и т.п. Это неоправданно затягивает время операции, увеличивает ее стоимость и объем хирургической травмы, число послеоперационных койко-дней, риск осложнений и летальности.
Хирургами предпринимаются всевозможные способы ликвидации натяжения тканей в зоне уретро-резервуароанастомоза, либо, если это не удается, ортотопическая цистопластика не выполняется, что значительно ухудшает непосредственные и отдаленные результаты, а также значимо снижает качество жизни больных. В связи с этим становится очевидной необходимость создания простого, не требующего дополнительных затрат, не увеличивающего времени операции и объема хирургической травмы метода, позволяющего безопасно выполнить ортотопическую тонкокишечную реконструкцию мочевого пузыря в условиях недостаточной длины брыжейки тонкой кишки.
Материалы и методы
Анализированы результаты лечения 326 пациентов, подвергнутых радикальной цистэктомии при раке мочевого пузыря в период с 1995 по 2012 гг. Среди всех видов реконструктивной субституции мочевого пузыря чаще выполняли ортотопическую интестиноцистопластику в различных вариантах – 152 (41,3%) пациентов. При наличии противопоказаний к ортотопической реконструкции (в том числе при выявлении короткой тонколибо толстокишечной брыжейки, препятствующей ортотопической цистопластике) у 38 (10,3%) пациентов выполнили гетеротопическую континентную пластику, а у 27 (7,3%) и 53 (14,4%) – внутреннюю деривацию мочи в кишечник и наружную неконтинентную деривацию в различных вариантах соответственно. Ортотопическая интестиноцистопластика по Studer выполнена 69 (18,7%) больным, из них короткая брыжейка тонкой кишки была у 48 (69,6%). Данные пациенты были ретроспективно разделены на две группы для проведения сравнительного анализа. Критерием групповой дифференциации явилась интраоперационная оценка допустимости натяжения тканей в формируемом уретрорезервуароанастомозе, которую проводили в соответствии с общепринятыми рекомендациями: при помощи пинцета и незначительной тракции, заранее определенную зависимую точку резервуара (место предполагаемого наложение анастомоза со стороны резервуара) низводили к культе уретры. В некоторых случаях дополнительно мобилизовали выделенный сегмент кишки путе м рассечения серозы над сосудистыми аркадами брыжейки [11]. В случае адекватного сопоставления краев культи уретры и стенки резервуара выполняли их анастомозирование (I группа, 15 (31,3%) пациентов). При невозможности сопоставления краев культи уретры и стенки резервуара без значимого натяжения, применяли модификацию методики Studer – оригинальную инвертирующую ортотопическую илеоцистопластику (II группа, 33 (68,7%) пациентов).
Предложенный метод операции [12], примененный нами во II группе, направлен на предотвращение натяжения тканей в зоне резервуаро-уретрального анастомоза путем продольного, а не поперечного сшивания резервуара и его инвертирующего позиционирования в малом тазу для максимального приближения стенки резервуара к культе уретры и выполнения уретро-резервуарного анастомоза без натяжения.
Технические отличия сводятся к тому, что резецируется не 60-65 см подвздошной кишки, а 55 см. А проксимальный тубулярный конец сохраняется на протяжении 15 см, а не 20 см. Далее детубуляризированную часть кишечного трансплантата складывают симметрично U-образно (вершина U направлена каудально, длина колен – 20 см), прилежащие края сшивают однорядным обвивным непрерывным швом через все слои со стороны слизистой (Полисорб 3/0). Таким образом, формируют заднюю стенку резервуара. Затем резервуар складывают не в поперечном, как при операции Studer, а в продольном направлении (рис. 1) путем совмещения противоположных длинных сторон.
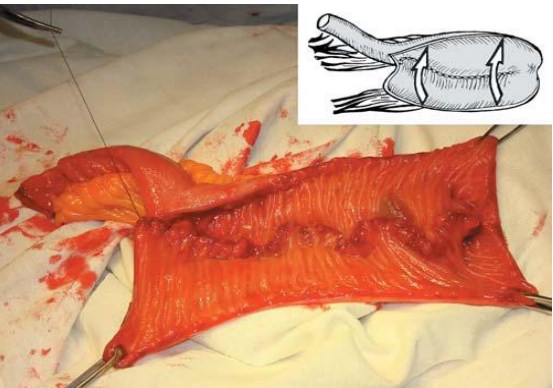
Рис. 1. Формирование задней стенки U-образного резервуара
При этом образуется трубчатый резервуар U-образной формы, который ушивают наглухо однорядным обвивным непрерывным серозно-мышечноподслизистым швом со стороны серозной оболочки кишки (рис. 2). Продольное сшивание U-образного резервуара обеспечивает более близкое прилежание нижней точки резервуара к культе уретры (на 3-4 см) в сравнении с поперечным складыванием при методике Studer.
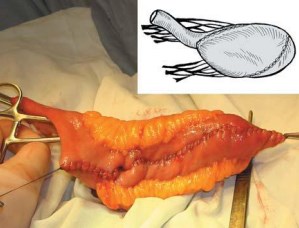
Рис. 2. Ушивание передней стенки U-образного резервуара
Однако в большинстве случаев при короткой брыжейке это не обеспечивает отсутствия натяжения в анастомозе с уретрой. Для еще большего низведения нижней стенки резервуара в малый таз выполняют инвертирующее позиционирование сформированного резервуара в малом тазу. Для этого осуществляют «выворачивание» сформированного U-образного резервуара между листками брыжейки кверху, начиная от вершины «U» (рис. 3).
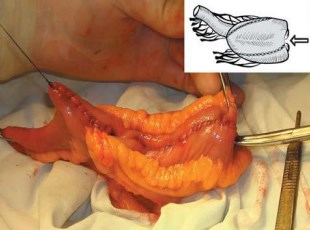
Рис. 3. Инвертирование сформированного U-образного резервуара от его вершины
После завершения полного выворачивающего позиционирования (рис. 4) и ротации резервуара вместе с приводящим тубуляризированным сегментом (рис. 5), задняя стенка резервуара, свободная от брыжейки, оказывается расположенной кпереди и еще более свободно низводится в малый таз, сокращая расстояние до культи уретры еще на 3-4 см. При этом не происходит перегиба брыжейки, она свободно ротируется под резервуаром. А сам резервуар не оказывается «перетянутым» сосудами брыжейки в сагиттальной плоскости, как при поперечном его складывании. Этот момент является весьма важным для последующего адекватного и беспрепятственного расправления резервуара в малом тазу (увеличения его емкости) в послеоперационном периоде.
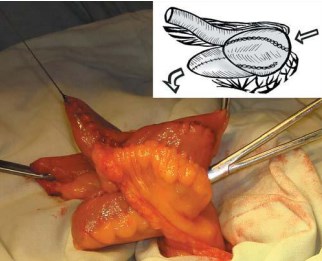
Рис. 4. Выворачивание U-образного резервуара между листками брыжейки резецированного кишечного сегмента
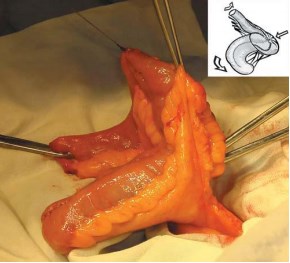
Рис. 5. Свободная ротация брыжейки под резервуаром без ее перегиба
Далее в самой нижней точке резервуара, прилежащей к уретре, формируют отверстие, пропускающее кончик указательного пальца, производят анастомоз с уретрой узловыми швами через все слои, Полисорб 2/0, на 2, 4, 6, 8, 10 и 12 ч условного циферблата. По уретре в полость неоциста устанавливают катетер Foley Ch№ 20-22. Стентированные мочеточники проводят забрюшинно, и через разрез париетальной брюшины вводят в брюшную полость на уровне верхнего края приводящего тубуляризированного сегмента. По методике Wallace (анастомоз Y-типа) мочеточники анастомозируют с открытым концом кишки приводящего сегмента резервуара. До полного ушивания анастомоза мочеточниковые стенты выводят по уретре наружу. К катетеру Foley у меатуса фиксируют мочеточниковые стенты. Катетер Foley фиксируется к уздечке penis (либо к большой половой губе). После этого окончательно ушивают мочеточниковорезервуарный анастомоз. Дополнительный цистостомический дренаж не устанавливают. Резервуар ушивают наглухо и дренируют исключительно трансуретрально, что максимально сокращает сроки восстановления самостоятельного мочеиспускания.
Результаты
В I группе у 10 пациентов (66,6%) в раннем послеоперационном периоде развилась несостоятельность анастомоза между резервуаром и уретрой. Это потребовало реанастомозирования уретры и резервуара у 3 больных, а у 7 пациентов пролонгированного удержания уретрального катетера (от 3 до 8 недель), тогда как во II группе подобного осложнения не отмечено. Средняя емкость неоциста после удаления уретрального катетера на 14 сутки в I и II группах – 190 и 110 мл, через 3 мес. – 200 и 350 мл, через 12 мес. – 420 и 490 мл. Максимальное давление в резервуаре к 6 мес. в I группе не превышает 45 см. вод. ст. (в среднем 35 см. вод. ст.) и 40 см. вод. ст. (в среднем 30 см. вод. ст.) во II группе соответственно. Дневное удержание мочи к 6 мес. в I и II группах – 86,0 и 94,7%, ночное удержание при одной принудительной ночной микции – 70,0 и 79,0%.
Заключение
Модификация ортотопической илеоцистопластики путем инвертации резервуара целесообразна к применению у пациентов при создании ортотопического тонкокишечного мочевого резервуара и короткой брыжейке тонкой кишки. Инвертация резервуара позволяет минимизировать осложнения после цистэктомии и улучшить функциональные показатели резервуара. Предложенный способ прост, надежен и позволяет добиться максимального качества жизни больных после радикальной цистэктомии. Описанный принцип инверсии применим и при других вариантах ортотопической кишечной цистопластики, когда необходимо уменьшить натяжение в кишечно-уретральном анастомозе.
Литература
1. Roehrborn, C.G. Functional characteristics of the Camey ileal bladder / C.G. Roehrborn, C.M. Teigland, A.I. Sagalowsky // J. Urol. – 1987. – V.138(4). – P.739-742.
2. Camey, M. Complications of the Camey procedure / M. Camey, H. Botto, E. Richard // Urol. Clin. North. Am. – 1988. – V.15(2). – P.249-255.
3. Orthotopic bladder replacement using ileum: techniques and results / J. Ramon, P. Leandri, G. Rossignol, H.Botto // Reconstructive Urology. – Oxford: Blackwell Scientific Publications, 1993. – P.445-457.
4. Коган, М.И. Современная диагностика и хирургия рака мочевого пузыря. / М.И. Коган, В.А. Перепечай. – Ростов н/Д, 2002. – 242 с.
5. Steven, K. The orthotopic Kock ileal neobladder: functional results, urodynamic features, complications and survival in 166 men / K. Steven, A.L. Poulsen // J. Urol. –2000. – V.164(2). – P.288-295.
6. The Kock ileal neobladder: updated experience in 295 male patients / D.A. Elmajian, J.P. Stein, D. Esrig et al. // J. Urol. – 1996. – V.156(3). – P.920-925.
7. The urethral Kock pouch: long-term functional and oncological results in men / A.A. Shaaban, A. Mosbah, M.S. ElBahnasawy et al. // BJU Int. – 2003. – V.92(4). – P.429-435.
8. Wright, E.J. Urinary diversion. Scientific Foundations and Clinical Practice / Eds K.J. Kreder, A.R. Stone / 2nd Ed. London and New York, 2005. – P.135-141.
9. Hautmann, R.E. Urinary diversion: ileal conduit to neobladder / R.E. Hautmann // J. Urol. 2003. – V.169(3). – P.834-842.
10. Zinman, L.N. Bladder Reconstruction and Continent Urinary Diversion / Eds L.R. King, A.R. Stone, G.D. Webster / 2nd Ed. St. Louis, 1991. – P.6887.
11. Морозов, А.В. Ортотопический «энтеро-неоцистис» низкого давления / A.В. Морозов, К.А. Павленко // М: ИД Медпрактика-М, 2006. – С. 66-67.
12. Перепечай, В.А. Инверсия ортотопического кишечного мочевого резервуара для предотвращения натяжения в уретрорезервуароанастомозе / В.А. Перепечай // Клиническая практика. – 2011. – №1 – С.18-26.
Статья опубликована в журнале "Вестник урологии". Номер №3/2013 стр. 3-12










Комментарии