Катибов М.И., Алибеков М.М.
Сведения об авторах:
- Катибов М.И. – д.м.н., доцент, заведующий урологическим отделением Государственного бюджетного учреждения Республики Дагестан «Городская клиническая больница № 1», г. Махачкала, mikatibov@mail.ru, AuthorID 633540
- Алибеков М.М. – врач-уролог урологического отделения Государственного бюджетного учреждения Республики Дагестан «Городская клиническая больница № 1», г. Махачкала, m.alibeckov@mail.ru
Хронический простатит (ХП) относят к числу самых распространенных и наиболее трудных для диагностики и лечения заболеваний в урологической практике. К примеру, от 15 до 50% мужчин в различные периоды жизни страдают от симптомов, присущих данной нозологической форме. При этом рецидивное течение болезни встречается до 50% наблюдений [1–3]. Cложности в диагностике и лечении ХП обусловлены многогранностью его патогенеза и мультифакторностью этиологической структуры, что проявляется хроническим цикличным течением заболевания с фазами обострений и ремиссий, нередкой сменой возбудителей и нарастанием их антибиотикоустойчивости [4–6].
Хотя среди пациентов с диагнозом простатита только в 5–10% случаев имеет место подтверждение бактериальной этиологии этого заболевания [7], недавнее клиникоэкспериментальное исследование А.Г. Горбачева и соавт. [8] выявило, что хроническое воспаление предстательной железы (ПЖ), которое первоначально развивается как асептическое, с течением времени в большинстве случаев становится инфекционным (бактериальным). С учетом этого необходимо понимать, что истинная доля пациентов с бактериальным ХП намного больше, чем фактически регистрируется. Среди основных причин неудачи лечения бактериального ХП ведущую позицию на современном этапе занимает антибиотикорезистентность, ставшая глобальной проблемой всемирного здравоохранения [9]. Исходя из этого фактора, актуальным представляется разработка и использование дополнительных лечебных опций при бактериальном ХП. В качестве таковых могут быть указаны озоно- и магнитотерапия, показавшие возможную перспективность и эффективность в лечении ХП [10,11]. Однако наличие лишь единичных исследований в области применения озонотерапии, а также отсутствие работ по изучению сочетанного использования указанных двух лечебных факторов при ХП определяют необходимость продолжения дальнейших научных исследований в данном направлении.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование основано на обследовании и лечении в период с 2013 по 2018 гг. 154 мужчин с бактериальным ХП, т.е. с ХП II в соответствии с классификацией Национального института здоровья США от 1995 года. Критерием для установления данного диагноза служило культуральное подтверждение бактериальной этиологии ХП. Высеянный бактериальный штамм считали возбудителем ХП, если концентрация колониеобразующих единиц в секрете ПЖ или моче после массажа ПЖ превышала концентрацию в первой или средней порции мочи в 10 и более раз при проведении четырехстаканной пробы мочи по E.M. Meares и T.A. Stamey [12]. Помимо культурального подтверждения бактериальной этиологии заболевания, другими условиями включения пациентов в исследование служили: наличие одного или нескольких клинических признаков ХП (боли в тазовой области, расстройства мочеиспускания и эякуляции); повышение количества лейкоцитов (более 10 в поле зрения) в секрете ПЖ или в моче после массажа ПЖ; длительность заболевания не менее 6 месяцев; возраст от 20 до 50 лет; приверженность пациентов к назначенному лечению и их информированное согласие.
Вся выборка пациентов в зависимости от выбранной тактики лечения была подразделена на 4 группы:
- Группа 1 (43 пациента, средний возраст 37,5±7,1 лет) – проводили стандартную терапию (антибактериальные средства, α-адреноблокаторы, энзимы, витамины, антиагреганты, массаж ПЖ) продолжительностью 6 недель.
- Группа 2 (38 пациентов, средний возраст 35,6±9,3 лет) – дополнительно к стандартной терапии проводили трансректальную магнитотерапию в течение 10 дней в режиме ежедневного одного сеанса продолжительностью 15 минут с помощью специального устройства, разработанного сотрудниками Дагестанской государственной медицинской академии [13]. Данное устройство представляет собой соленоид цилиндрической формы длиной обмотки 25 мм и диаметром 4 мм, внутри которого помещается ферритовый сердечник М-200-НН диаметром 2 мм и длиной 25 мм. Соленоид работает от источника постоянного либо переменного тока с напряжением от 20 до 1000 Гц и содержит 2 вывода для подключения к источнику питания. Устройство заливается композитом и помещается внутри двухпросветной трубки с внутренним диаметром 4 мм и внешним – 7 мм. В стенке полиэтиленовой трубки имеется микроирригатор с боковыми наружными отверстиями на уровне соленоида для введения в полость лекарственной смеси. Соединительные провода соленоида изолированы и пропущены через фторопластовый кембрик, проходящий внутри дренажной трубки. Подключение соленоида к источнику постоянного тока (батарейка-выпрямитель) с V=1,5–6 В или к трансформатору переменного тока с выходным напряжением 1,5–6 В позволяет создать переменное или постоянное магнитное поле интенсивностью 9–10 мТл на концах самого соленоида (рис. 1).
- Группа 3 (40 пациентов, средний возраст 35,1±8,8 лет) – дополнительно к стандартной терапии проводили трансректальную озонотерапию в течение 10 дней в режиме одного сеанса в день. Методика озонотерапии заключалась в том, что в положении лежа на боку с согнутыми и прижатыми к животу коленями в прямую кишку вводили 20 мл озонированного раствора с концентрацией озона 1200 мкг/л при длительности процедуры от 5 минут с последующим увеличением до 25 минут. Озонированный 0,9% раствор хлорида натрия получали с помощью «Установки для получения озонированных растворов с заранее заданной концентрацией – ОЖК-1» или установки УОТА-60-01 «Медозон» и вводили в течение 15-20 минут после его получения.
- Группа 4 (33 пациента, средний возраст 35,1±8,2 лет) – дополнительно к стандартной терапии проводили трансректально и магнито-, и озонотерапию: на первом этапе – магнитотерапию (10 сеансов в течение 10 дней), на втором этапе – озонотерапию (10 сеансов в течение 10 дней).
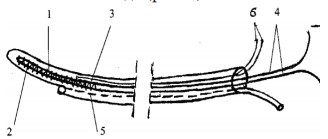
Рис. 1. Схема устройства для трансректальной магнитотерапии: 1 – соленоид; 2 – ферритовый сердечник; 3 – двухпросветная трубка; 4 – выводы для подключения к источнику питания; 5 – микроирригатор; 6 – соединительные провода соленоида
Результаты проведенного лечения оценивали через 3 месяца после окончания курса терапии по следующим критериям: количество лейкоцитов и лецитиновых зерен в секрете ПЖ, эрадикация возбудителей ХП по данным бактериологического исследования.
Статистическая обработка полученных данных проведена с помощью программы Statistica-6.0. Распределение показателей оцениваемых параметров представлены в виде их относительной (%) и абсолютной (n) частот. Сравнение групп пациентов по различным признакам проводили с использованием U-критерия Манна-Уитни, а динамику данных параметров в результате лечения – критерия Вилкоксона. Различие считали достоверным при уровне значимости (р) менее 0,05.
РЕЗУЛЬТАТЫ
При градации количества лейкоцитов в секрете ПЖ были выбраны следующие критерии: норма – ≤10 в поле зрения; незначительное повышение – 11-20 в поле зрения; умеренное повышение – 21-50 в поле зрения; выраженное повышение – >50 в поле зрения. При классификации количества лецитиновых зерен в секрете ПЖ были использованы следующие категории: скудное – 0-1 в поле зрения; умеренное – 2-3 в поле зрения; большое – >3 в поле зрения. Распределение пациентов внутри групп в зависимости от количества лейкоцитов и лецитиновых зерен в секрете ПЖ приведено в таблице 1. По данным показателям достоверных различий между группами пациентов не выявлено.
Таблица 1. Распределение пациентов в зависимости от количества лейкоцитов и лецитиновых зерен в секрете ПЖ, % (n)
| Показатель | Группа 1 (п=43) | Группа 2 (п=38) | Группа 3 (п=40) | Группа 4 (п=33) | Р |
|---|---|---|---|---|---|
| Количество лейкоцитов в поле зрения в секрете ПЖ: | |||||
| норма | 0 | 0 | 0 | 0 | 0,486 |
| незначительное повышение | 9,3% (4) | 18,4% (7) | 7,5% (3) | 9,1% (3) | |
| умеренное повышение | 27,9% (12) | 29,0% (11) | 30,0% (12) | 30,3% (10) | |
| выраженное повышение | 62,8% (27) | 52,6% (20) | 62,5% (25) | 60,6% (20) | |
| Количество лецитиновых зерен в поле зрения в секете ПЖ: | |||||
| скудное | 65,1% (28) | 65,8% (25) | 65,0% (26) | 69,7% (23) | 0,891 |
| умеренное | 34,9% (15) | 34,2% (13) | 35,0% (14) | 30,3% (10) | |
| большое | 0 | 0 | 0 | 0 | |
* p - сравниваются все четыре группы по указанным параметрам
Распределение возбудителей ХП по данным бактериологического исследования секрета ПЖ среди отмеченных групп пациентов представлено в таблице 2. По данному критерию статистически значимых различий между представленными группами пациентов не обнаружено.
Таблица 2. Частота и виды возбудителей, выявленных в секрете ПЖ, % (n)
| Возбудитель | Группа 1 (n=43) | Группа 2 (n=38) | Группа 3 (n=40) | Группа 4 (n=33) | Р |
|---|---|---|---|---|---|
| Staph, epidermidis | 27,9% (12) | 28,9% (11) | 30,0% (12) | 24,2% (8) | 0,991 |
| Staph, saprophyticus | 18,6% (8) | 18,4% (7) | 20,0% (8) | 21,2% (7) | 0,989 |
| E. coli | 13,9% (6) | 13,2% (5) | 12,5% (5) | 15,2% (5) | 0,891 |
| Staph, aureus | 9,3% (4) | 10,5% (4) | 7,5% (3) | 12,1% (4) | 0,967 |
| Proteus spp. | 7,0% (3) | 7,9% (3) | 5,0% (2) | 9,1% (3) | 0,956 |
| Enterococcus faecalis | 7,0% (3) | 5,3% (2) | 7,5% (3) | 3,0% (1) | 0,978 |
| Микробные ассоциации | 16,3% (7) | 15,8% (6) | 17,5% (7) | 15,2% (5) | 0,985 |
* p - сравниваются все четыре группы по указанным параметрам
В результате выбранной тактики лечения во всех группах пациентов отмечен положительный эффект при контрольном обследовании через 3 месяца после завершения курса терапии. При этом такой эффект был подтвержден данными всех оцениваемых лабораторных показателей: содержанием лейкоцитов и лецитиновых зерен в секрете ПЖ, эрадикацией возбудителей ХП.
Динамика такого параметра, как количество лейкоцитов в секрете ПЖ, вследствие проведенного лечения отражена на рисунке 2. Хотя достоверное улучшение данного показателя произошло во всех группах пациентов (p<0,05), наиболее существенная динамика произошла у пациентов группы 4. Только в этой группе наблюдали отсутствие пациентов с умеренным и выраженным повышением количества лейкоцитов в секрете ПЖ.
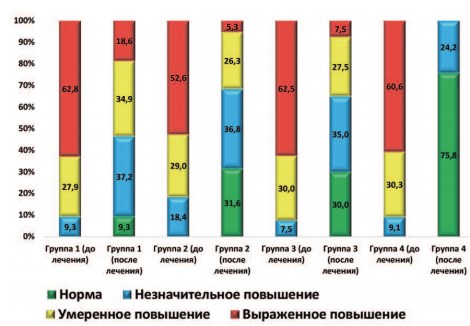
Рис. 2. Динамика распределения пациентов (в %) в зависимости от количества лейкоцитов в поле зрения в секрете ПЖ
Аналогичного характера изменения были выявлены и при оценке следующего параметра – количества лецитиновых зерен в секрете ПЖ. В результате выбранной терапии в каждой из групп пациентов было установлено статистически значимое улучшение этого показателя (p<0,05). Однако наиболее выраженные положительные изменения были характерны для группы 4. Именно в этой группе доля пациентов с большим количеством лецитиновых зерен в секрете ПЖ достигла наивысшей отметки и составила 30,3% (рис. 3).
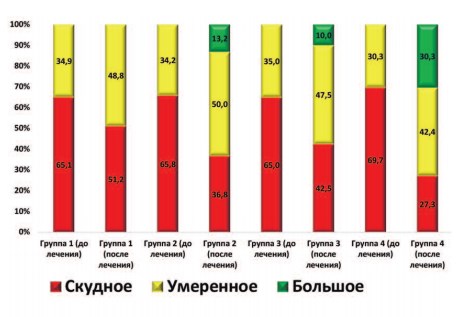
Рис. 3. Динамика распределения пациентов (в %) в зависимости от количества лецитиновых зерен в поле зрения в секрете ПЖ
Критерием бактериологической эффективности проводимой терапии ХП считали исчезновение первоначального возбудителя в секрете ПЖ после лечения. Среди пациентов группы 1 при контрольном бактериологическом исследовании полной эрадикации возбудителя удалось добиться у 48,8% (21/43) пациентов. У остальных 51,2% (22/43) пациентов были обнаружены те или иные микроорганизмы или их ассоциации, что потребовало назначения дополнительных курсов антибактериальных и химиотерапевтических препаратов. Анализ возбудителей, выявленных при контрольном обследовании у пациентов группы 2, установил, что проведенная в данной группe терапия была более эффективной, чем в предыдущей группе. Так, полная эрадикация возбудителей в группе 2 была достигнута у 68,4% (26/38) пациентов. Сопоставимый с группой 2 результат был получен для пациентов группы 3, среди которых эрадикация возбудителей имела место в 65,0% (26/40) наблюдений. Наиболее высокий показатель по степени эрадикации инфекционного агента ХП установлен в группе 4, в которой в результате лечения бактериальная флора была ликвидирована у 84,8% (28/33) пациентов (табл. 3).
Таблица 3. Динамика частоты и видов возбудителей в секрете ПЖ, % (n)
| Возбудитель | Группа 1 (n=43) | Группа 2 (n=38) | Группа 3 (n=40) | Группа 4 (n=33) | ||||
|---|---|---|---|---|---|---|---|---|
| До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | |
| Staph, epidermidis | 27,9% (12) | 11,6% (5) | 28,9% (11) | 7,9% (3) | 30,0% (12) | 7,5% (3) | 24,2% (8) | 9,1%(3) |
| Staph, saprophyticus | 18,6% (8) | 9,3% (4) | 18,4% (7) | 5,3% (2) | 20,0% (8) | 7,5% (3) | 21,2% (7) | 3,0%(1) |
| E. coli | 13,9% (6) | 4,7% (2) | 13,2% (5) | 5,3% (2) | 12,5% (5) | 5,0% (2) | 15,2% (5) | 3,0%(1) |
| Staph, aureus | 9,3% (4) | 7,0% (3) | 10,5% (4) | 2,6% (1) | 7,5% (3) | 5,0% (2) | 12,1% (4) | 0 |
| Proteus spp. | 7,0% (3) | 4,7% (2) | 7,9% (3) | 5,3% (2) | 5,0% (2) | 2,5% (1) | 9,1% (3) | 0 |
| Enterococcus faecalis | 7,0% (3) | 2,3% (1) | 5,3% (2) | 5,3% (2) | 7,5% (3) | 2,5% (1) | 3,0% (1) | 0 |
| Микробные ассоциации | 16,3% (7) | 11,6% (5) | 15,8% (6) | 0 | 17,5% (7) | 5,0% (2) | 15,2% (5) | 0 |
| Итого | 100% (43) | 51,2% (22) | 100% (38) | 31,6% (12) | 100% (40) | 35,0% (14) | 100% (33) | 15,2% (5) |
Таким образом, наши результаты показали, что применение любого из двух изучаемых лечебных факторов: магнито- или озонотерапии, позволяет добиться более выраженных положительных изменений в лабораторных показателях у пациентов с бактериальным ХП по сравнению с вариантом терапии, исключающим использование этих видов лечения. А применение обеих этих терапевтических опций приводит к положительному эффекту в еще большей степени, чем при использовании одной из них.
Патогенетическое обоснование терапевтического эффекта магнитотерапии при ХП нашло объяснение во многих работах, в которых было отмечено, что магнитное поле заметно уменьшает поглощение биологической тканью электромагнитных колебаний, увеличивая глубину проникновения света и уменьшая коэффициент отражения, тем самым потенцируя эффекты воздействия лечебных факторов. Благодаря таким свойствам достигается обезболивающий, противоотечный, антиагрегационный, сосудорасширяющий и бактериостатический эффекты магнитотерапии [14–16].
Что касается роли второго рассматриваемого лечебного фактора – озонотерапии, то в единичных исследованиях, посвященных этому вопросу, была подтверждена ее эффективность при ХП. Например, в работе Ю.Ю. Винника и соавт. представлены данные, согласно которым после применения общей и местной озонотерапии дополнительно к стандартной схеме лечения хронического уретрогенного простатита доля пациентов с небольшим количеством лецитиновых зерен в секрете ПЖ уменьшилась с 49% до 19,6%, пациентов с единичными лецитиновыми зернами – с 19% до 0%, а доля пациентов с умеренным и большим количеством лецитиновых зерен, наоборот, увеличилась с 32% до 38,9% и с 0% до 41,5% соответственно. Кроме того, данные авторы сообщили о полной элиминации инфекционного агента во всей выборке пациентов после проведенного курса терапии [17].
С учетом такого выраженного терапевтического эффекта магнитои озонотерапии, их низкой себестоимости и простоты практического применения нам представляется вполне обоснованным включение в комплексное лечение пациентов с бактериальным ХП обоих методов лечения. Использование магнитотерапии именно на первом этапе, а озонотерапии – на втором этапе лечения также имеет под собой теоретическую основу. Она заключается в гипотезе, что озон, вступая в окислительные реакции с гнойно-воспалительными тканями, теряет свою противовоспалительную активность и не может проникнуть через патологические барьеры [18]. Следовательно, необходимо вначале обеспечить устранение эпителиальных и гнойных «пробок», вызывающих обструкцию выводных протоков ПЖ, что достигается за счет предварительного применения магнитотерапии и способностью последней вызывать ориентацию биологически активных макромолекул и жидких кристаллов, составляющих основу многих внутриклеточных структур [19]. Дальнейшее использование озонотерапии на этом фоне обеспечивает оптимальную санацию патологических очагов в ПЖ.
ЗАКЛЮЧЕНИЕ
Включение в комплексное лечение бактериального ХП дополнительно к стандартной схеме терапии магнито- и озонотерапии позволяет значительно улучшить результаты лечения таких пациентов. Наиболее выраженный терапевтический эффект может быть достигнут при использовании обоих данных лечебных факторов. При этом принципиальным представляется использование магнитотерапии на первом этапе лечения, а озонотерапии – на втором. Высокая клиническая эффективность, низкая себестоимость, простота в применении и практическое отсутствие побочных эффектов у этих двух методов лечения могут быть указаны в качестве доводов для рассмотрения их в числе других перспективных направлений совершенствования результатов лечения пациентов с ХП. Безусловно, малое число подобных исследований и отсутствие сведений об отдаленных результатах комплексного использования магнито- и озонотерапии в лечении бактериального ХП диктуют необходимость продолжения таких работ, по результатам которых могут быть сделаны окончательные выводы.
ЛИТЕРАТУРА
- Евдокимов В.В. Демография и хронический простатит. Трудный пациент 2010;8(11):57–64.
- Polackwich AS, Shoskes DA. Chronic prostatitis/chronic pelvic pain syndrome: a review of evaluation and therapy. Prostate Cancer Prostatic Dis. 2016;19(2):132–138. doi: 10.1038/pcan.2016.8.
- Smith CP. Male chronic pelvic pain: An update. Indian J Urol 2016;32(1):34–39. doi: 10.4103/0970-1591.173105.
- Ибишев Х.С., Крайний П.А., Магомедов Р.Г., Крючкова М.Н. Хронический рецидивирующий бактериальный простатит. Иммунологические аспекты патогенеза. XII конференция врачей первичного звена здравоохранения Юга России «Ранняя диагностика и современные методылечения на этапе первичного звена здравоохранения»; Ноябрь 11, 2017; Ростов-наДону. URL: https://elibrary.ru/download/elibrary_32751977_51776559. pdf. Ссылка активна на 19.05.2019.
- Holt JD, Garrett WA, McCurry TK, Teichman JM. Common Questions About Chronic Prostatitis. Am Fam Physician 2016;93(4):290–296.
- Wagenlehner FM, Ballarini S, Naber KG. Immunostimulation in chronic prostatitis/chronic pelvic pain syndrome (CP/CPPS): a one-year prospective, double-blind, placebo-controlled study. World J Urol 2014;32(6):1595–603. doi: 10.1007/s00345-014-1247-z.
- Набер К.Г., Валенсик В., Вагенленер Ф.М.Е. Острый и хронический простатит – что важно для практики? Вестник урологии. 2016;(2):71–83.
- Горбачев А.Г., Боровец С.Ю., Аль-Шукри С.Х., Тюрин А.Г., Князькин И.В. Хронический простатит: инфекционный или неинфекционный? (Клинико-экспериментальное исследование). Медицина и образование в Сибири 2013;(5):3.
- Magri V, Boltri M, Cai T, Colombo R, Cuzzocrea S, De Visschere P, et al. Multidisciplinary approach to prostatitis. Arch Ital Urol Androl 2019;90(4):227–248. doi: 10.4081/aiua.2018.4.227.
- Винник Ю.Ю., Прохоренков В.И., Николаев В.Г. Особенности течения хронического простатита на фоне комплексного лечения с применением озонотерапии. Клиническая дерматология и венерология. 2013;11(4):47–50.
- Неймарк А.И., Алиев Р.Т., Райгородский Ю.М., Махова Г.Е. Вибромагнитная терапия с помощью аппарата АВИМ-1 при хроническом простатите с синдромом тазовой боли. Физиотерапия, бальнеология и реабилитация 2013;(3):11–14.
- Krieger JN, Nyberg L Jr, Nickel JC. NIH consensus definition and classification of prostatitis. JAMA 1999;282(3):236–237.
- Загиров У.З., Магомедов М.-Р.М., Абдуллаев Ш.А., Шахназарова З.А., Салихов М.А. Устройство для магнитофореза. Патент Российской Федерации на полезную модель № 48787, зарегистрирован 10 ноября 2005 г.
- Терешин А.Т., Бакуров Е.Е., Долаев Р.К., Дмитренко Г.Д., Ефименко А.П. Патогенетическое обоснование применения системной магнитотерапии в лечении больных хроническим простатитом с эректильной дисфункцией. Физиотерапия, бальнеология и реабилитация 2016;15(3):151–154.
- Буренина И.А., Хасанов В.В. Изучение эффективности применения бегущего магнитного поля в комплексном лечении больных хроническим простатитом. Вестник современной клинической медицины 2011;4(4):11а–13.
- Колмацуй И.А., Левицкий Е.Ф. Методологические подходы в оптимизации физиолечения у больных с хроническим простатитом /синдромом хронических тазовых болей. Курортная медицина 2015;(3):73–79.
- Винник Ю.Ю., Прохоренков В.И., Николаев В.Г. Клинико-лабораторные особенности течения хронического уретрогенного простатита на фоне комплексного лечения с применением озонотерапии. Сибирское медицинское обозрение 2015;(5):80–84.
- Хмелевская И.Г., Ковальчук Л.В. Анализ иммунотропной активности антибиотиков и протеолитических ферментов на различных экспериментальных моделях индукции иммунодефицитного состояния. Иммунология 2000;21(4):42–45.
- Исаев У.М. Лечение гнойных ран при местной озонотерапии на фоне низкочастотных магнитных полей. Вестник новых медицинских технологий 2008;15(1):111–112
Статья опубликована в журнале "Экспериментальная и клиническая урология" №2 2019 г., стр. 134-139










Комментарии