Олефир Ю.В., Коршунов М.Н., Живулько А.Р., Монаков Д.М.
Сведения об авторах:
- Олефир Ю.В. — д.м.н., профессор ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России; Москва, Россия; РИНЦ АuthorID 816947
- Коршунов М.Н. — к.м.н., доцент кафедры урологии ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента РФ; Москва, Россия; РИНЦ AuthorID 755479
- Живулько А.Р. — врач-уролог ООО «Центр иммунологии и репродукции»; Москва, Россия
- Монаков Д.М. — к.м.н., ассистент кафедры урологии и оперативной нефрологии РУДН; Москва, Россия; РИНЦ AuthorID 995385
ВВЕДЕНИЕ
Генетический материал сперматозоида играет важную роль в развитии эмбриона и здоровье будущего потомства [1-7]. Появляется все больше данных о роли повреждения хроматина гамет в развитии мужского бесплодия [8-14]. Высокий уровень фрагментации ДНК сперматозоидов (ФДС) может стать значимым фактором снижения потенциала фертильности. Он ассоциирован с повышением частоты спонтанных абортов и снижением эффективности лечения бесплодия с применением методов вспомогательных репродуктивных технологий (ВРТ) [15-17].
На сегодняшний день имеется ограниченное количество подходов к лечению таких пациентов. Вышеуказанное обуславливает актуальность и высокую социальную значимость данной проблемы.
В настоящем обзоре проведен анализ имеющихся методов лечения бесплодия, ассоциированного с высоким уровнем фрагментации ДНК сперматозоидов, а также место ВРТ в преодолении этой проблемы.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен поиск, анализ и систематизация публикаций в базах данных PubMed и e-Library с использованием ключевых слов «мужское бесплодие», «фрагментация ДНК сперматозоидов», «лечение», «ЭКО», «ИКСИ», «male infertility», «sperm DNA damage», «treatment», «IVF», «ICSI». После исключения тезисов конференций, диссертаций и их авторефератов отобрано 84 публикации, которые включены в настоящий обзор.
РЕЗУЛЬТАТЫ
Модификация образа жизни
Ионизирующее излучение, воздействие табачного дыма, высоких температур и химических агентов могут оказывать неблагоприятное влияние на целостность генетического материала сперматозоидов [18-23].
В многочисленных исследованиях была показана взаимосвязь между табакокурением и повышением уровня ФДС. Курящие пациенты имели более высокие показатели разрывов ДНК сперматозоидов по сравнению с некурящими [24-27].
В ряде исследований выявлена взаимосвязь высокого уровня фрагментации ДНК сперматозоидов при ожирении за счет усиления проницаемости кишечной стенки, которая приводит к эндотоксемии и оксидативному повреждению генетического материала половых клеток. Важно отметить, что ожирение – потенциально модифицируемый фактор и нормализация массы тела может быть одним из методов коррекции ФДС [28-30].
Устранение неблагоприятных факторов образа жизни представляется одним из наиболее простых и фундаментальных способов решении проблемы мужского бесплодия, ассоциированного с высоким уровнем ФДС. Рекомендации по ведению здорового образа жизни, отказу от вредных привычек, ограничению употребления спиртных напитков, отказу от посещения бань и саун, контролю массы тела являются установкой для пациента на первой консультации. Тем не менее, исследований, которые бы показывали статистически значимое снижение уровня фрагментации ДНК сперматозоидов после модификации факторов образа жизни нам выявить не удалось.
Антиоксидантная и метаболическая терапия
Так как одним из основных механизмов повреждения генетического материала сперматозоидов является оксидативный стресс, антиоксидантная терапия исторически рассматривалась в качестве основного метода лечения мужского бесплодия и пациентов с высоким уровнем ФДС. Антиоксиданты играют важную роль в организме инактивируя активные радикалы, и таким образом препятствуют окислительному повреждению генетического материала сперматозоидов. В ряде исследований оценивалась эффективность антиоксидантной терапии в лечении мужского бесплодия [31].
Наиболее распространенными антиоксидантами, используемыми в этих исследованиях, были витамин Е, L-карнитин, фолиевая кислота, цинк, витамин С, селен и коэнзим Q10. Эти вещества применялись как в качестве монотерапии так и в комбинации. При этом в большей части исследований проводилось лечение с использованием комбинации антиоксидантов.
Ранние исследования показали, что монотерапия витамином С оказывала протективное действие в отношении окислительного повреждения ДНК [32].
В двойном слепом плацебо-контролируемом исследовании, в которое было включено 74 пациента, J.C. Martínez-Soto и соавт. оценивали эффективность использования докозагексаеновой кислоты, 1500 мг в сутки. Ими было выявлено достоверное снижение уровня ФДС после 10 недель приема препарата [33].
Применение 200 мг цинка дважды в день в качестве монотерапии и в комбинации с витамином Е и С было ассоциировано с низким индексом ФДС [34].
Назначение тамоксифена цитрата (20 мг/сут), фолата фолиевой кислоты (5 мг/сут) и их комбинации также приводило к улучшению стандартных показателей спермограммы и снижению уровня ФДС [35].
M. Lipovac и соавт. сравнивали эффективность монотерапии L-карнитином и его комбинации с другими микронутриентами. В обеих группах отмечалось улучшение показателей спермограммы, тем не менее в группе с комбинированной терапией результаты были лучше [36].
В двойном слепом плацебо-контролируемом исследовании, проведенном E. A. Williams с соавт., 60 пациентам в течении 12 недель проводилась терапия ликопином в дозировке 14 мг/сут. Авторами не было выявлено достоверных различий уровня ФДС между исследуемыми группами [37].
Ежедневное употребление N-ацетилцистеина у 50 пациентов в дозировке 600 мг в течение 3 месяцев привело к выраженному снижению уровня ФДС при сравнении с исходными значениями [38].
Большая часть имеющихся сведений относительно эффективности антиоксидантной терапии в лечении мужского бесплодия, ассоциированного с высоким уровнем фрагментации ДНК сперматозоидов, получено из исследований комбинированной терапии несколькими антиоксидантами.
Ежедневный прием 1500 мг L-карнитина, 60 мг витамина С, 20 мг коэнзима Q10, 10 мг витамина Е, 200 мкг витамина В9, 1 мкг витамина В12, 10 мг цинка и 50 мкг селена у 20 бесплодных мужчин с варикоцеле 1 стадии приводил снижению ФДС на 22,1% при ее оценке методом Sperm Chromatin Dispersion (SCD – дисперсия хроматина сперматозоидов) [39].
K. Oleszczuk и соавт. оценили эффективность комбинированной антиоксидантной терапии, представленной 30 мг витамина C, 5 мг витамина E, 0,5 мкг витамина B12, 750 мг L-карнитина, 10 мг коэнзима Q10, 100 мкг фолиевой кислоты, 5 мг цинка и 25 мкг селена, в рамках двойного слепого плацебо-контролируемого исследования, в которое были включены 77 пациентов с индексом фрагментации более 25% при измерении методом SCSA. Авторами не было выявлено статистически значимой разницы в уровне ФДС как после 3 месяцев (30,0% против 34,5%, p=0,27), так и 6 месяцев (34,0% против 29,5%, p=0,18) лечения [40].
C.И. Гамидов и соавт. в свою очередь выявили статистически значимое снижение уровня ФДС после 3-х месяцев приема ацетил-L-карнитина, L-карнитина фумарата и альфа-липоевой кислоты в двойном слепом плацебо-контролированном исследовании [41].
Таким образом, результаты исследований эффективности антиоксидантной терапии в лечении мужского бесплодия, ассоциированного с высоким уровнем ФДС, достаточно противоречивы.
Хирургическое лечение варикоцеле
Варикоцеле — одна из наиболее распространенных устранимых причин мужского бесплодия [42].
Долгое время эффективность и целесообразность варикоцелэктомии в лечении мужского бесплодия была под вопросом, вероятно, по причине неадекватной селекции пациентов для хирургического лечения в исследованиях. Считалось, что хирургическая коррекция варикоцеле эффективна лишь у пациентов с клинически выраженным варикоцеле и снижением показателей спермограммы [43].
В мета-анализе K.H. Kim и соавт. показано, что оперативное лечение варикоцеле достоверно повышает вероятность наступления беременности [44].
Исследования показали, что пациенты с варикоцеле имеют значительно более высокие показатели фрагментации ДНК сперматозоидов по сравнению с мужчинами у которых нет этого заболевания, что подтверждает роль варикоцеле как фактора нарушения целостности генетического материала сперматозоидов [45-52]. В мета-анализе 12 исследований Y.J. Wang и соавт. выявили, что варикоцеле было ассоциировано со статистически значимым повышением уровня ФДС на 9,84% (95% CI=9,19–10,49; p<0,00001) [53].
Также было показано, что варикоцелэктомия приводила к снижению уровня фрагментации ДНК сперматозоидов. M. Roque and S.C. Esteves проанализировали результаты 21 исследования с включением более 1200 пациентов, которым выполнялось хирургическое лечение варикоцеле и измерялся уровень фрагментации ДНК сперматозоидов. Было выявлено значительное статистически значимое снижение уровня ФДС во всех наблюдениях в течение 3–12 месяцев после варикоцелэктомии [54].
В немногих исследованиях сообщается о частоте наступления беременности после хирургического лечения варикоцеле. В исследованиях, которые анализировали этот показатель, отмечалось что в парах, в которых у мужчины определялся низкий показатель ФДС чаще наступала беременность по сравнению с парами в которых этот показатель был высоким. Так M. Smit и соавт. измеряли уровень фрагментации ДНК сперматозоидов у пациентов с варикоцеле методом Sperm Chromatin Structure Assay (SCSA – структурный анализ хроматина сперматозоидов) как до, так и после оперативного лечения и выявили статистически значимое снижение этого показателя после варикоцелэктомии (MD=5%; p=0,019). У 18 (37%) из 49 пар наступила спонтанная беременность натуральным путем и у 11 (22%) – с применением ВРТ. Уровень фрагментации ДНК сперматозоидов был значительно ниже в парах где наступала беременность (26,6±13,7% против 37,3±13,9%; p=0,013) [55].
Роль субклинического варикоцеле в повышении уровня ФДС, а также целесообразность выполнения варикоцелэктомии таким пациентам остаются малоизученными.
K. Ni и соавт. было показано, что у пациентов с субклиническим варикоцеле стандартные показатели спермограммы были хуже по сравнению с фертильными мужчинами без варикоцеле, тем не менее статистически значимой разницы между группами по показателю ФДС выявлено не было [56].
В небольшом исследовании A. García‐Peiró и соавт. оценивали эффективность хирургической коррекции варикоцеле в снижении уровня ФДС при клиническом и субклиническом варикоцеле. Авторами не было выявлено статистически значимого снижения уровня ФДС в группе пациентов с субклиническим варикоцеле в отличие от группы с клинической формой [57].
Учитывая эти данные, можно сказать, что хирургическое лечение клинически выраженного варикоцеле на сегодняшний день является наиболее изученным и эффективным методом снижения уровня ФДС. Роль субклинического варикоцеле в повышении уровня ФДС, а также необходимость его лечения в этой группе пациентов остается дискутабельной. Необходимы дальнейшие исследования для оценки влияния субклинического варикоцеле на целостность генетического материала сперматозоидов.
Устранение воспалительного процесса и инфекций мочеполовых органов
Инфекции, передаваемые половым путем, а также воспалительный процесс в добавочных половых железах могут быть причиной повреждения генетического материала сперматозоидов [58, 59].
G. Gallegos и соавт. исследовали влияние хламидийиной и микоплазменной инфекции на целостность генетического материала сперматозоидов, а также эффективность антибактериальной терапии у этой категории пациентов. Для исследования ими были отобрано 143 пациента с инфекцией, вызванной Chlamydia trachomatis и Mycoplasma spp., подтвержденной культуральным и иммунофлюоресцентным методами, и 50 фертильных пациентов для контрольной группы. Авторами было выявлено статистически значимое увеличение уровня ФДС у пациентов исследуемой группы по сравнению с контрольной (35,2± 13,5% против 10,8±5,6%; p<0,001). После проведенного лечения отмечалось статистически значимое снижение уровня ФДС (37,7±13,6% против 24,2±11,2%; p<0,001 [60].
По данным S. I. Moskovtsev с соавт. антибактериальная терапия приводила к снижению уровня ФДС у 93% пациентов с бактериоспермией (50,4%+/-19,1 vs. 38,6%+/-18,7, p<0,001) [61].
Инфекции и воспалительный процесс в органах мужской репродуктивной системы являются устранимыми факторами снижения мужской фертильности. По этой причине их лечение необходимо для коррекции высокого уровня ФДС.
Гормональная терапия
Предполагается, что гормональная стимуляция сперматогенеза может способствовать активации спермато- и спермиогенеза, улучшению качества эякулята, включая показатели целостности хроматина.
N. Colacurci и соавт. провели проспективное многоцентровое исследования в котором оценили эффективность терапии рекомбинантным фолликулостимулирующим гормоном (рФСГ) у 115 бесплодных пациентов с повышенным уровнем фрагментации ДНК сперматозоидов. Все пациенты получали по 150 МЕ препарата Гонал-Ф через день в течение 3-х месяцев. После окончания курса отмечалось статистически значимое снижение уровня ФДС у 67% пациентов (в среднем на 35,4%). Данное исследование наиболее крупное на сегодняшний день, оценивающее эффект лечения препаратами рФСГ при повышении ФДС [62].
Безусловно, для подтверждения эффективности применения рФСГ в лечении мужского бесплодия, ассоциированного с высоким уровнем ФДС, необходимы широкомасштабные рандомизированные плацебоконтролируемые исследования с изучением показателя живорождения.
Вспомогательные репродуктивные технологии
Высокий уровень ФДС ассоциирован с повышением частоты спонтанных абортов и снижением эффективности лечения бесплодия с применением методов ВРТ. Уровень оксидативного стресса, который был недостаточен для индукции клеточной гибели путем апоптоза, может приводить к нарушению функции сперматозоидов, включая их иммобилизацию, нарушения связывания с зоной пеллюцида, экзоцитоза акросомы и пенетрации оболочки яйцеклетки [63].
Тем не менее сперматозоид с поврежденным хроматином может сохранять способность к оплодотворению [64].
Влияние ФДС на репродуктивные исходы зависит от баланса между уровнем фрагментации и способностью ооцита к восстановлению поврежденной структуры молекулы ДНК. В случае, если степень повреждения генетического материала в сперматозоиде превышает репаративный потенциал яйцеклетки, сохраняющиеся нарушения в структуре ДНК могут приводить к гибели эмбриона, его неспособности к имплантации в эндометрий и другим неблагоприятным репродуктивным исходам [65, 66].
Однако было показано, что даже в случае высокого уровня ФДС, нормальная фертилизация возможна при проведении ЭКО, так как ооциты молодых женщин восстанавливают структуру ДНК [67]. Несмотря на то, что репродуктивные исходы лечения бесплодия, ассоциированного с высоким уровнем ФДС, напрямую зависят от качества ооцита, сама методика также имеет большое значение.
Множество исследований было посвящено оценке влияния ФДС на репродуктивные исходы ЭКО и ИКСИ. В большинстве мета-анализов, опубликованных на сегодняшний день, было выявлено снижение частоты наступления беременности при проведении стандартного ЭКО [68-72].
L. Simon и соавт. сообщают о более низкой частоте беременности при проведении ИКСИ у пациентов с высоким уровнем ФДС, в то время как в других исследованиях этой зависимости выявлено не было [68-71].
В мета-анализе A. Osman c соавт. оценивалось влияние ФДС на частоту живорождения в программах ВРТ. Было выявлено статистически значимое снижение этого показателя как при выполнении ЭКО, так и ИКСИ [72].
В трех мета-анализах оценивалась частота спонтанных абортов при выполнении ЭКО и ИКСИ [68, 70, 73]. Высокий уровень ФДС был ассоциирован с рисками невынашивания как при проведении ЭКО, так и ИКСИ. Несмотря на то, что высокий уровень ФДС оказывает влияние на эффективность ИКСИ, по всей видимости, степень этого влияния на результативность стандартного ЭКО ниже [74]. По этой причине, в случае, если все мероприятия, направленные на снижение уровня ФДС, не увенчались успехом, и принимается решение о лечении бесплодия с использованием ВРТ целесообразно в качестве метода первой линии выбрать именно ИКСИ (рис. 1).
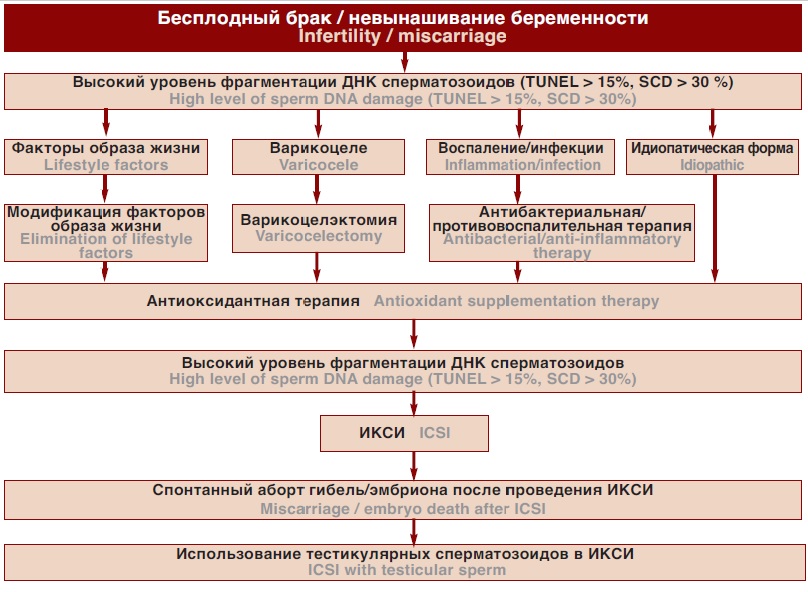
Рис. 1. Алгоритм лечебной тактики при фрагметации ДНК сперматозоидов
Fig. 1. Treatment of sperm DNA fragmentation
Одним из перспективных методов преодоления бесплодия вызванного высоким уровнем ФДС является использование для ИКСИ тестикулярных гамет, так как было показано, что уровень фрагментации ДНК сперматозоидов в яичках значительно ниже по сравнению с эякуляторными [7, 75].
E. Greco с соавт. в 2005 г. в группе использования тестикулярных сперматозоидов при ИКСИ наступление клинической беременности отмечено в 44% случаев против 6% в группе с использованием эякуляторных сперматозоидов [76].
В большинстве небольших исследований использование тестикулярных сперматозоидов также было ассоциировано с более высокой частотой беременности и живорождения, а также снижением числа репродуктивных потерь [7, 77-82].
Мета-анализ, выполненный S. C. Esteves и соавт. в 2017 году, показал более низкую частоту фертилизации, но при этом более высокую частоту беременности и живорождения при использовании тестикулярных сперматозоидов при сравнении с эякуляторными [83].
Учитывая все эти данные ИКСИ с использованием тестикулярных сперматозоидов, представляется перспективным методом в лечении бесплодия ассоциированного с высоким уровнем фрагментации ДНК сперматозоидов. Однако для внедрения этого метода в рутинную клиническую практику, безусловно, необходимо больше исследований. Учитывая инвазивный характер процедуры тестикулярной экстракции сперматозоидов, прибегать к ИКСИ с использованием тестикулярных сперматозоидов следует лишь в случае отсутствия успеха при выполнении других менее инвазивных методов (рис. 1).
ВЫВОДЫ
На сегодняшний день у врача клинициста имеется достаточно ограниченный арсенал методик лечения бесплодия, ассоциированного с высоким уровнем ФДС. Из этих методик, лишь хирургическое лечение варикоцеле подкреплено достаточно сильными данными с позиции доказательной медицины. Требуются крупные рандомизированные исследования для решения вопроса выбора оптимальных методов лечения мужского бесплодия, вызванного высоким уровнем фрагментации ДНК сперматозоидов, и разработки клинических алгоритмов ведения этой категории пациентов.
ЛИТЕРАТУРА
1. Krawetz SA. Paternal contribution: new insights and future challenges. Nat Rev Genet 2005;6(8):633–42. https://doi.org/10.1038/nrg1654.
2. Коршунов М.Н., Коршунова Е.С., Кызласов П.С., Коршунов Д.М., Даренков С.П. Структурные нарушения хроматина сперматозоидов. Патофизиологические аспекты. Клиническая значимость. Вестник урологии 2021;9(1):95-104. [Korshunov M.N., Korshunova E.S., Kyzlasov P.S., Korshunov D.M., Darenkov S.P. Structural disorders of sperm chromatin. Pathophysiological aspects. Clinical significance. Vestnik urologii = Urology herald 2021;9(1):95-104. (In Russian)]. https://doi.org/10.21886/2308-6424-2021-9-1-95-104.
3. Руднева С.А., Брагина Е.Е., Арифулин Е.А., Сорокина Т.М., Шилейко Л.В., Ермолаева С.А., и др. Фрагментация ДНК в сперматозоидах и ее взаимосвязь с нарушением сперматогенеза. Андрология и генитальная хирургия 2014;15(4):26-33. [Rudneva S.A., Bragina E.E., Arifulin E.A., Sorokina T.M., Shileyko L.V., Ermolaeva S.A., et al. DNA fragmentation in spermatozoa and its relationship with the violation of spermatogenesis. Andrologiia i genitalnaia khirurgiia = Andrology and genital surgery 2014;15(4):26-33. (In Russian)].
4. Рыжков А.И., Шорманов И.С., Соколова С.Ю. Фрагментация ДНК сперматозоидов. Есть ли связь с основными параметрами спермы и возрастом? Экспериментальная и клиническая урология 2020(4):58-64. [Ryzhkov A.I., Shormanov I.S., Sokolova S.Yu. Fragmentation of sperm DNA. Is there a connection with the main parameters of sperm and age? Eksperimentalnaia i klinicheskaia urologiia = Experimental and clinical urology 2020(4):58-64. (In Russian)]. https://doi.org/10.29188/2222-8543-2020-13-4-58-64.
5. Брагина Е.Е., Арифулин Е.А., Лазарева Е.М., Лелекова М.А., Коломиец О.Л., Чоговадзе А.Г., и др. Нарушение конденсации хроматина сперматозоидов и фрагментация ДНК сперматозоидов: есть ли корреляция? Андрология и генитальная хирургия 2017;18(1):48-61. [Bragina E.E., Arifulin E.A., Lazareva E.M., Lelekova M.A., Kolomiets O.L., Chogovadze A.G., etc. Violation of sperm chromatin condensation and fragmentation of sperm DNA: is there a correlation? Andrologiia i genitalnaia khirurgiia = Andrology and genital surgery 2017;18(1):48-61. (In Russian)]. https://doi.org/10.17650/2070-9781-2017-18-1-48-61.
6. Авадиева Н.Э. Применение ДНК фрагментации спермы в андрологической практике. Вестник урологии 2019;7(1):7-11. [Avadieva N.E. The use of DNA fragmentation of sperm in andrological practice. Vestnik urologii = Urology herald 2019;7(1):7-11. (In Russian)]. https://doi.org/10.21886/2308-6424-2019-7-1-7-11.
7. Коршунов М.Н., Коршунова Е.С., Даренков С.П. Клиническая эффективность использования тестикулярных сперматозоидов в программах репродуктивных технологий при высоком показателе ДНК-фрагментации. Урологические ведомости 2017;7(специальный выпуск):57-58. [Korshunov M.N., Korshunova E.S., Darenkov S.P. Clinical effectiveness of the use of testicular spermatozoa in reproductive technology programs with a high index of DNA fragmentation. Urologicheskie vedomosti = Urology reports 2017;7(special issue):57-58. (In Russian)].
8. Agarwal A, Majzoub A, Esteves SC, Ko E, Ramasamy R, Zini A. Clinical utility of sperm DNA fragmentation testing: practice recommendations based on clinical scenarios. Transl Androl Urol 2016;5(6):935–50. https://doi.org/10.21037/tau.2016.10.03.
9. Aitken RJ. Oxidative stress and the etiology of male infertility. J Assist Reprod Genet 2016;33(12):1691–2. https://doi.org/10.1007/s10815-016-0791-4.
10. Bui AD, Sharma R, Henkel R, Agarwal A. Reactive oxygen species impact on sperm DNA and its role in male infertility. Andrologia 2018;50(8):e13012. https://doi.org/10.1111/and.13012.
11. Esteves SC, Gosálvez J, López‐Fernández C, Núñez‐Calonge R, Caballero P, Agarwal A, et al. Diagnostic accuracy of sperm DNA degradation index (DDSi) as a potential noninvasive biomarker to identify men with varicocele‐associated infertility. Int Urol Nephrol 2015;47(9):1471–7. https://doi.org/10.1007/s11255-015-1053-6.
12. Rima D, Shiv BK, Bhavna C, Shilpa B, Saima K. Oxidative stress induced damage to paternal genome and impact of meditation and yoga — can it reduce incidence of childhood cancer? Asian Pac J Cancer Prev 2016;17(9):4517–25.
13. Saleh RA, Agarwal A, Nelson DR, Nada EA, El‐Tonsy MH, Alvarez JG, et al. Increased sperm nuclear DNA damage in normozoospermic infertile men: a prospective study. Fertil Steril 2002;78(2):313–8. https://doi.org/10.1016/S0015-0282(02)03219-3.
14. Sergerie M, Laforest G, Boulanger K, Bissonnette F, Bleau G. Longitudinal study of sperm DNA fragmentation as measured by terminal uridine nick end‐labelling assay. Hum Reprod 2005;20(7):1921–7. https://doi.org/10.1093/humrep/deh885.
15. González‐Marín C, Gosálvez J, Roy R. Types, causes, detection and repair of DNA fragmentation in animal and human sperm cells. Int J Mol Sci 2012;13(11):14026-52. https://doi.org/10.3390/ijms131114026.
16. Lopes S, Jurisicova A, Sun JG, Casper RF. Reactive oxygen species: potential cause for DNA fragmentation in human spermatozoa. Hum Reprod 1998;13(4):896-900. https://doi.org/10.1093/humrep/13.4.896.
17. Simon L, Lutton D, McManus J, Lewis SE. Sperm DNA damage measured by the alkaline Comet assay as an independent predictor of male infertility and in vitro fertilization success. Fertil Steril 2011;95(2):652–7. https://doi.org/10.1016/j.fertnstert.2010.08.019.
18. Pacey AA. Environmental and lifestyle factors associated with sperm DNA damage. Hum Fertil (Camb) 2010;13(4):189-93. https://doi.org/10.3109/14647273.2010.531883.
19. Rubes J, Selevan SG, Evenson DP, Zudova D, Vozdova M, Zudova Z, et al. Episodic air pollution is associated with in-creased DNA fragmentation in human sperm without other changes in semen quality. Hum Reprod 2005;20(10):2776-83. https://doi.org/10.1093/ humrep/dei122.
20. Sánchez-Peña LC, Reyes BE, López-Carrillo L, Recio R, Morán-Martínez J, Cebrián ME, et al. Organophosphorous pesticide exposure alters sperm chromatin structure in Mexican agricultural workers. Toxicol Appl Pharmacol 2004;196(1):108-13. https://doi.org/10.1016/j.taap.2003.11.023.
21. Zhou DD, Hao JL, Guo KM, Lu CW, Liu XD. Sperm quality and DNA damage in men from Jilin Province, China, who are occupationally exposed to ionizing radiation. Genet Mol Res 2016;15(1). https://doi.org/10.4238/gmr.15018078.
22. Jamal F, Haque QS, Singh S, Rastogi SK. The influence of organophosphate and carbamate on sperm chromatin and reproductive hormones among pesticide sprayers. Toxicol Ind Health 2016;32(8):1527-36. https://doi.org/10.1177/0748233714568175.
23. Lafuente R, García-Blàquez N, Jacquemin B, Checa MA. Outdoor air pollution and sperm quality. Fertil Steril 2016;106(4):880-96. https://doi.org/10.1016/j.fertnstert.2016.08.022.
24. Sharma R, Harlev A, Agarwal A, Esteves SC. Cigarette smoking and semen quality: a new meta-analysis examining the effect of the 2010 World Health Organization laboratory methods for the examination of human semen. Eur Urol 2016;70(4):635-45. https://doi.org/10.1016/j.eururo.2016.04.010.
25. Aboulmaouahib S, Madkour A, Kaarouch I, Sefrioui O, Saa-dani B, Copin H, et al. Impact of alcohol and cigarette smoking consumption in male fertility potential: looks at lipid peroxidation, enzymatic antioxidant activities and sperm DNA damage. Andrologia 2018;50(3). https://doi.org/10.1111/and.12926.
26. Ranganathan P, Rao KA, Thalaivarasai Balasundaram S. Deterioration of semen quality and sperm-DNA integrity as influenced by cigarette smoking in fertile and infertile human male smokers — a prospective study. J Cell Biochem 2019(120):11784-93. https://doi.org/10.1002/jcb.28458.
27. Mostafa RM, Nasrallah YS, Hassan MM, Farrag AF, Majzoub A, Agarwal A. The effect of cigarette smoking on human seminal parameters, sperm chromatin structure and condensation. Andrologia 2018;50(3). http://doi.org/10.1111/and.12910.
28. Yang Q, Zhao F, Hu L, Bai R, Zhang N, Yao G, et al. Effect of paternal overweight or obesity on IVF treatment outcomes and the possible mechanisms involved. Sci Rep 2016(6):29787. https://doi.org/10.1038/srep29787.
29. Pearce KL, Hill A, Tremellen KP. Obesity related metabolic endotoxemia is associated with oxidative stress and impaired sperm DNA integrity. Basic Clin Androl 2019(29):6. http://doi.org/10.1186/s12610-019-0087-5.
30. Dupont C, Faure C, Sermondade N, Boubaya M, Eustache F, Clément P, et al. Obesity leads to higher risk of sperm DNA damage in infertile patients. Asian J Androl 2013;15(2):622-5. https://doi.org/10.1038/aja.2013.65.
31. Buhling K, Schumacher A, Eulenburg CZ, Laakmann E. Influence of oral vitamin and mineral supplementation on male infertility: a meta-analysis and systematic review. Reprod Biomed Online, 2019;39(2):269–79. https://doi.org/10.1016/j.rbmo.2019.03.099.
32. Fraga CG, Motchnik PA, Shigenaga MK, Helbock HJ, Jacob RA, Ames BN. Ascorbic acid protects against endogenous oxidative DNA damage in human sperm. Proc Natl Acad Sci USA 1991;88(24):11003–6. https://doi.org/10.1073/pnas.88.24.11003.
33. Martínez-Soto JC, Domingo JC, Cordobilla B, Nicolás M, Fernández L, Albero P, et al. Dietary supple-mentation with docosahexaenoic acid (DHA) improves seminal an-tioxidant status and decreases sperm DNA fragmentation. Syst Biol Reprod Med 2016;62(6):387–95. https://doi.org/10.1080/19396368.2016.1246623.
34. Omu AE, Al-Azemi MK, Kehinde EO, Anim JT, Oriowo MA, Mathew TC. Indications of the mechanisms involved in improved sperm parameters by zinc therapy. Med Princ Prac 2008;17(2):108–16. https://doi.org/10.1159/000112963.
35. Boonyarangkul A, Vinayanuvattikhun N, Chiamchanya C, Visutakul P. Comparative study of the effects of tamoxifen citrate and folate on semen quality of the infertile male with semen abnormality. J Med Assoc Thai 2015;98(11):1057–63.
36. Lipovac M, Bodner F, Imhof M, Chedraui P. Comparison of the effect of a combination of eight micronutrients versus a standard mono preparation on sperm parameters. Reprod Biol Endocrinol 2016;14(1):84. https://doi.org/10.1186/s12958-016-0219-0.
37. Williams EA, Parker M, Robinson A, Pitt S, Pacey AA. A randomized placebo- controlled trial to investigate the effect of lactolycopene on semen quality in healthy males. Eur J Nutr 2019;59(2):825–33. https://doi.org/10.1007/s00394-019-02091-5.
38. Jannatifar R, Parivar K, Roodbari NH, Nasr-Esfahani MH. Effects of N-acetyl-cysteine supplementation on sperm quality, chromatin integrity and level of oxidative stress in infertile men. Reprod Biol Endocrinol 2019;17(1):24. https://doi.org/10.1186/s12958-019-0468-9.
39. Gual-Frau J, Abad C, Amengual MJ, Hannaoui N, Checa MA, Ribas-Maynou J, et al. Oral antioxidant treatment partly improves integrity of human sperm DNA in infertile grade I varicocele patients. Human Fertil 2015;18(3):225–9. https://doi.org/10.3109/14647273.2015.1050462.
40. Oleszczuk K, Augustinsson L, Bayat N. Prevalence of high DNA fragmentation index in male partners of unexplained infertile couples. Andrology 2013;1(3):357–60. https://doi.org/10.1111/j.2047-2927.2012.00041.x.
41. Гамидов С.И., Р.И. Овчинников, А.Ю. Попова. Двойное слепое рандомизированное плацебо-контролируемое исследование эффективности и безопасности комплекса ацетил-L-карнитина, L-карнитина фумарата и альфа-липоевой кислоты (СпермАктин® Форте) в лечении мужского бесплодия. Урология 2017(1):35-43. [Gamidov S.I., R.I. Ovchinnikov, A.Y. Popova. Double-blind randomized placebo-controlled study of the efficacy and safety of acetyl-L-carnitine, L-carnitine fumarate and alpha-lipoic acid complex (SpermActin ® Forte) in the treatment of male infertility. Urologiya = Urology 2017(1):35-43. (In Russian)]. https://doi.org/https://dx.doi.org/10.18565/urology.2019.4.61-68
42. Gorelick JI, Goldstein M. Loss of fertility in men with varicocele. Fertil Steril 1993;59(3):613-6.
43. Practice Committee of the American Society for Reproduc-tive Medicine; Society for Male Reproduction and Urology. Report on varicocele and infertility: a committee opinion. Fertil Steril 2014;102(6):1556-60. https://doi.org/10.1016/j.fertnstert.2014.10.007.
44. Kim KH, Lee JY, Kang DH, Lee H, Seo JT, Cho KS. Impact of surgical varicocele repair on pregnancy rate in subfertile men with clinical varicocele and impaired semen quality: a meta-analysis of randomized clinical trials. Korean J Urol 2013;54(10):703-9. https://doi.org/10.4111/kju.2013.54.10.703.
45. Zini A, Dohle G. Are varicoceles associated with increased deoxyribonucleic acid fragmentation? Fertil Steril 2011;96(6):1283-7. https://doi.org/10.1016/j.fertnstert.2011.10.016.
46. Blumer CG, Fariello RM, Restelli AE, Spaine DM, Bertolla RP, Cedenho AP. Sperm nuclear DNA fragmentation and mitochondrial activity in men with varicocele. Fertil Steril 2008;90(5):1716-22. https://doi.org/10.1016/j.fertnstert.2007.09.007.
47. Tanaka T, Kobori Y, Terai K, Inoue Y, Osaka A, Yoshikawa N, et al. Seminal oxidation-reduction potential and sperm DNA fragmentation index increase among infer-tile men with varicocele. Hum Fertil (Camb) 2020;1-5. https://doi.org/10.1080/14647273.2020.1712747.
48. Dieamant F, Petersen CG, Mauri AL, Conmar V, Mattila M, Vagnini LD, et al. Semen parameters in men with varicocele: DNA fragmentation, chromatin packaging, mitochondrial membrane potential, and apoptosis. JBRA Assist Reprod 2017;21(4):295-301. https://doi.org/10.5935/1518-0557.20170053.
49. Moazzam A, Sharma R, Agarwal A. Relationship of spermatozoal DNA fragmentation with semen quality in varicocele-positive men. Andrologia 2015;47(8):935- 44. https://doi.org/10.1111/and.12360.
50. Bertolla RP, Cedenho AP, Hassun Filho PA, Lima SB, Ortiz V, et al. Sperm nuclear DNA fragmentation in adolescents with varicocele. Fertil Steril 2006;85(3):625-8. https://doi.org/10.1016/j.fertnstert.2005.08.032.
51. Vivas-Acevedo G, Lozano-Hernández R, Camejo MI. Varico-cele decreases epididymal neutral α-glucosidase and is associ-ated with alteration of nuclear DNA and plasma membrane in spermatozoa. BJU Int 2014;113(4):642-9. https://doi.org/10.1111/bju.12523.
52. Bahreinian M, Tavalaee M, Abbasi H, Kiani-Esfahani A, Shiravi AH, Nasr-Esfahani MH. DNA hypomethylation predisposes sperm to DNA damage in individuals with varicocele. Syst Biol Reprod Med 2015;61(4):179-86. https://doi.org/10.3109/19396368.2015.1020116.
53. Wang YJ, Zhang RQ, Lin YJ, Zhang RG, Zhang WL. Relation-ship between varicocele and sperm DNA damage and the effect of varicocele repair: a meta-analysis. Reprod Biomed Online 2012;25(3):307-14. https://doi.org/10.1016/j.rbmo.2012.05.002.
54. Roque M, Esteves SC. Effect of varicocele repair on sperm DNA fragmentation: a review. Int Urol Nephrol 2018;50(4):583-603. https://doi.org/10.1007/s11255-018-1839-4.
55. Smit M, Romijn JC, Wildhagen MF, Veldhoven JL, Weber RF, Dohle GR. Decreased sperm DNA fragmentation after surgical varicocelectomy is associated with increased pregnancy rate. J Urol 2013;189(1 Suppl):S146-50. https:/doi.org/10.1016/j.juro.2012.11.024.
56. Ni K, Steger K, Yang H, Wang H, Hu K, Zhang T, Chen B. A comprehensive investigation of sperm DNA damage and oxidative stress injury in infertile patients with subclinical, normozoospermic, and astheno/oligozoospermic clinical varicocoele. Andrology 2016;4(5):816–24. https://doi.org/10.1111/andr.12210.
57. García‐Peiró A, Ribas‐Maynou J, Oliver‐Bonet M, Navarro J, Checa MA, Nikolaou A, et al. 2014 Multiple determinations of sperm DNA fragmentation show that varicocelectomy is not indicated for infertile patients with subclinical varicocele. Biomed Res Int 2014;181396. https://doi.org/10.1155/2014/181396.
58. Pasqualotto FF, Sharma RK, Potts JM, Nelson DR, Thomas AJ, Agarwal A. Seminal oxidative stress in patients with chronic prostatitis. Urology 2000(55):881-5.
59. Aitken RJ, De Iuliis GN. Origins and consequences of DNA damage in male germ cells. Reprod Biomed Online 2007;14(6):727-33. https://doi.org/10.1016/s1472-6483(10)60676-1.
60. Gallegos G, Ramos B, Santiso R, Goyanes V, Gosálvez J, Fernández JL. Sperm DNA fragmentation in infertile men with genitourinary infection by Chlamydia trachomatis and Mycoplasma. Fertil Steril 2008;90(2):328-34. https://doi.org/10.1016/j.fertnstert.2007.06.035.
61. Moskovtsev SI, Lecker I, Mullen JB, Jarvi K, Willis J, White J, et al. Cause-specific treatment in patients with high sperm DNA damage resulted in significant DNA improvement. Syst Biol Reprod Med 2009;55(2):109-15. https://doi.org/10.1080/19396360902787944.
62. Colacurci N, De Leo V, Ruvolo G, Piomboni P, Caprio F, Pivonello R, et al. Recombinant FSH improves sperm DNA damage in male infertility: a phase II clinical trial. Front Endocrinol (Lausanne) 2018(9):383. https://doi.org/10.3389/fendo.2018.00383.
63. Aitken RJ. Impact of oxidative stress on male and female germ cells: implications for fertility. Reproduction 2020;159(4):R189–R201. https://doi.org/10.1530/REP-19-0452.
64. Zenzes MT, Puy LA, Bielecki R, Reed TE. Detection of benzo[a]pyrene diol epoxide‐DNA adducts in embryos from smoking couples: evidence for transmission by spermatozoa. Mol Hum Reprod 1999;5(2):125–31. https://doi.org/10.1093/molehr/5.2.125.
65. Champroux A, Torres‐Carreira J, Gharagozloo P, Drevet JR, Kocer A. Mammalian sperm nuclear organization: resiliencies and vulnerabilities. Basic Clin Androl 2016(26):17. https://doi.org/10.1186/s12610-016-0044-5.
66. Menezo Y, Clement P, Amar E. Evaluation of sperm DNA structure, fragmentation and decondensation: an essential tool in the assessment of male infertility. Transl Androl Urol 2017;6(Suppl 4):S553–S556. https://doi.org/10.21037/tau.2017.03.11.
67. Horta F, Catt S, Ramachandran P, Vollenhoven B, Temple‐Smith P. Female ageing affects the DNA repair capacity of oocytes in IVF using a controlled model of sperm DNA damage in mice. Hum Reprod 2020;35(3):529–44. https://doi.org/10.1093/humrep/dez308.
68. Zini A. Are sperm chromatin and DNA defects relevant in the clinic? Syst Biol Reprod Med 2011;57(1-2):78-85. https://doi.org/10.3109/19396368.2010.515704.
69. Li Z, Wang L, Cai J, Huang H. Correlation of sperm DNA damage with IVF and ICSI outcomes: a systematic review and meta-analysis. J Assist Reprod Genet 2006;23(9-10):367- 76. https://doi.org/10.1007/s10815-006-9066-9.
70. Zhao J, Zhang Q, Wang Y, Li Y. Whether sperm deoxyribo-nucleic acid fragmentation has an effect on pregnancy and miscarriage after in vitro fertilization/intracytoplasmic sperm injection: a systematic review and meta-analysis. Fertil Steril 2014;102(4):998-1005.e8. https://doi.org/10.1016/j.fertnstert.2014.06.033.
71. Simon L, Zini A, Dyachenko A, Ciampi A, Carrell DT. A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome. Asian J Androl 2017;19(1):80-90. https://doi.org/10.4103/1008-682X.182822.
72. Osman A, Alsomait H, Seshadri S, El-Toukhy T, Khalaf Y. The effect of sperm DNA fragmentation on live birth rate after IVF or ICSI: a systematic review and meta-analysis. Reprod Biomed Online 2015;30(2):120-7. https//doi.org/10.1016/j.rbmo.2014.10.018.
73. Zini A, Boman JM, Belzile E, Ciampi A. Sperm DNA damage is associated with an increased risk of pregnancy loss after IVF and ICSI: systematic review and meta-analysis. Hum Reprod 2008;23(12):2663-8. https://doi.org/10.1093/humrep/den321.
74. Lewis SEM. The place of sperm DNA fragmentation testing in current day fertility management. Middle East Fertil Soc J 2013(18):78-82. https://doi.org/10.1016/j.mefs.2013.01.010.
75. Moskovtsev SI, Jarvi K, Mullen JB, Cadesky KI, Hannam T, Lo KC. Testicular spermatozoa have statistically significantly lower DNA damage compared with ejaculated spermatozoa in patients with unsuccessful oral antioxidant treatment. Fertil Steril 2010;93(4):1142–6. https://doi.org/10.1016/j.fertnstert.2008.11.005.
76. Greco E, Scarselli F, Iacobelli M, Rienzi L, Ubaldi F, Ferrero S, et al. Efficient treat ment of infertility due to sperm DNA damage by ICSI with testicular spermatozoa. Hum Reprod 2005;20(1):226–30. https://doi.org/10.1093/humrep/deh590.
77. Arafa M, AlMalki A, AlBadr M, Burjaq H, Majzoub A, AlSaid S, et al. ICSI outcome in patients with high DNA fragmentation: testicular versus ejaculated spermatozoa. Andrologia 2018;50(1). https://doi.org/10.1111/and.12835.
78. Zhang J, Xue H, Qiu F, Zhong J, Su J. Testicular spermatozoon is superior to ejaculated spermatozoon for intracytoplasmic sperm injection to achieve pregnancy in infertile males with high sperm DNA damage. Andrologia 2019;51(2):e13175. http://doi.org/10.1111/and.13175.
79. Pabuccu EG, Caglar GS, Tangal S, Haliloglu AH, Pabuccu R. Testicular versus ejaculated spermatozoa in ICSI cycles of nor mozoospermic men with high sperm DNA fragmen tation and previous ART failures. Andrologia 2017;49(2). https://doi.org/10.1111/and.12609.
80. Hayden RP, Wright DL, Toth TL, Tanrikut C. Selective use of percutaneous testis biopsy to optimize IVF-ICSI outcomes: a case series. Fertil Res Pract 2016(2):7. https://doi.org/10.1186/s40738-016-0020-y.
81. Esteves SC, Sánchez-Martín F, Sánchez-Martín P, Schneider DT, Gosálvez J. Comparison of reproductive outcome in oligozoospermic men with high sperm DNA fragmentation undergoing intracytoplasmic sperm injection with ejaculated and testicular sperm. Fertil Steril 2015;104(6):1398–405. https://doi.org/10.1016/j.fertnstert.2015.08.028.
82. Mehta A, Bolyakov A, Schlegel PN, Paduch DA. Higher pregnancy rates using testicular sperm in men withsevere oligospermia. Fertil Steril 2015;104(6):1382–7. https://doi.org/10.1016/j.fertnstert.2015.08.008.
83. Esteves SC, Roque M, Bradley CK, Garrido N. Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis. Fertil Steril 2017;108(3):456–67.e1. https://doi.org/10.1016/j.fertnstert.2017.06.018.









Комментарии