С.В. Минаев1 , И.В. Павленко1 , П.И. Чумаков1 , А.Э. Мационис2
1 ФГБОУ ВО «Ставропольский государственный медицинский университет» МЗ РФ; Ставрополь, Россия
2 ГБУ РО «Патолого-анатомическое бюро»; Ростов-на-Дону, Россия
Автор для связи: Минаев Сергей Викторович
Тел.: +7 (962) 450-76-53; e-mail: sminaev@yandex.ru
Ведение
Аномалии мочевыделительной системы (АМВС) относятся к достаточно часто встречающейся врождённой патологии, так как их распространенность в популяции составляет в среднем 5–14% [1]. Также отмечается тенденция к прогрессирующему увеличению частоты рождаемости детей с подобными пороками развития [2, 3]. Кроме того, значимость патологии обусловлена её ассоциацией с выраженными отклонениями в развитии и нарушением у ребенка функции органов, что приводит к значительному снижению качества жизни.
Клиническую симптоматику АМВС существенным образом отягощают нередкие сопутствующие явные пороки развития других органов: репродуктивной системы, органов дыхания, желудочно-кишечного тракта и пр. [4, 5]. Несмотря на то что у значительной части пациентов с АМВС отсутствуют выраженные дефекты других органов, при этом повышается риск появления изменений строения соединительной ткани по типу её дисплазии (ДСТ), подразумевающей морфологическую дезорганизацию этой ткани с появлением функциональных нарушений органов или даже их малых аномалий [6].
С этих позиций проблема АМВС до настоящего времени остается мало изученной. Не проводились исследования, посвящённые изучению взаимосвязи АМВС при отсутствии пороков развития других органов, с одной стороны, и общего соединительнотканного статуса, с другой стороны [7]. Важно также и то, что лечение детей с АМВС включает хирургический этап коррекции порока, что предъявляет повышенные требования к компенсаторному потенциалу организма ребенка [8, 9, 10].
Цель исследования: определить влияние тяжести проявления ДСТ на тактику лечения детей с аномалиями мочевыделительной системы.
Материалы и методы
Работа основана на результатах обследования и лечения 143 больных детей в возрасте от 6 месяцев до 18 лет с диагнозом обструкция ПУС с гидронефрозом различной степени и дисплазией устьев мочеточников с ПМР I–V степени. Исследование проводилось с 2005 по 2015 гг. в урологическом отделении ГБУЗ СК «Городская клиническая больница скорой медицинской помощи» г. Ставрополя. Среди исследуемых больных не выявлено дифференцируемых форм ДСТ по типу синдрома Марфана, Элерса-Данлоса и др. Оценку выраженности проявлений ДСТ осуществляли по классификации Т.И. Кадуриной и В.Н. Горбуновой [11].
Всего обследованы 48 детей с гидронефрозом. В группу вошли 37 (77,1%) мальчиков и 11 (22,9%) девочек. В зависимости от степени гидронефроза пациенты распределились следующим образом: с гидронефрозом I степени — 9 (18,8%) человек; с гидронефрозом II степени — 12 (25,0%); с гидронефрозом IIIА степени — 27 (56,3%). Дети с гидронефрозом IIIБ степени в исследование не вошли.
В группу пациентов с ПМР вошли 95 детей в возрасте от 6 месяцев до 18 лет (средний возраст составил 4,7±1,8 года). Из них мальчиков было 13 (13,7%), девочек — 82 (86,3%). В зависимости от степени ПМР пациенты распределились следующим образом: с I степенью — 18 (18,9%) человек; со II степенью — 30 (31,6%); с III степенью — 27 (28,42%); с IV степенью — 12 (12,4%); с V степенью — 8 (8,4%).
Детям с ПМР I-III степени и фенотипическими проявлениями ДСТ легкой степени проводили эндоколлагенопластику. Пациентам с умеренной или выраженной степенями ДСТ и нарастании ПМР, а также при IV-V степенях ПМР проводили внутрипузырную пластику по методике П.И. Чумакова и А.П. Татаркина [12].
Пациентам при прогрессировании гидронефроза, начиная со второй его степени с фенотипическими проявлениями ДСТ легкой степени, проводили баллонную дилатацию мочеточника с последующим стентированием. В случае дальнейшего прогрессирования гидронефроза и при IIIА степени проводили оперативное лечение по методу Андерсона–Хайнса.
Морфологическое исследование проводилось на базе патологоанатомического отделения ГБУЗ СК «ГКБ СМП» г. Ставрополя (заведующая отделением Л.П. Гордеева) и лаборатории иммуноморфологии ГБУ Ростовской области «Патолого-анатомическое бюро» (заведующий лабораторией д.м.н. А.Э. Мационис). Пациентам, подвергшимся оперативному лечению, проводилось гистологическое исследование участка мочеточника и кожи, взятой из области операционного разреза. Выполнялась сравнительная оценка у детей, которые имели выраженные признаки ДСТ, и пациентов, не имевших признаков ДСТ.
Полученные срезы окрашивали гематоксилином и эозином для выявления ретикулиновых волокон использовался метод серебрения по Футу (набор Silver Impregnation производства Bio-Optika, Италия), трехцветное окрашивание по Массон с анилиновым синим (набор Masson Trichrome производства Bio-Optika, Италия) [13].
С помощью иммуногистохимического исследования определяли экспрессию белков Collagen I и Collagen IV с использованием первичных моно- и поликлональных антител и системы визуализации Dako EnVision System + Peroxidase (DAB) (antirabbit, antimouse), (Dako Denmark A/S)., Mouse/Rabbit PolyScan™ HRP/DAB Detection System (Cell Marque Corporation, США) , UltraVision LP Detection System HRP Polymer & DAB Plus Chromogen (Lab Vision Products Thermo Fisher Scientific, Великобритания) в соответствии с протоколами фирм-производителей. Использовали следующие первичные антитела: Collagen I Type, clone EP236, mouse, 1:200 (Epitomix, USA) и Collagen IV, клон CIV 22, разведение 2:100 (Dako Denmark A/S) [14].
Анализ достоверности различий в группах проводился методами вариационной статистики в лицензионной компьютерной программе «Statistica 10.0» (StatSoŌ , USA) русифицированная. Анализ данных включал стандартные методы описательной и аналитической статистики. Для сравнения средних значений выборок использовались t-тест для независимых выборок (тест Стьюдента), t-тест для зависимых выборок, однофакторный дисперсионный анализ (ANOVA). Кроме того, использовали непараметрические критерии различия двух выборок (χ², критерий Фишера). Различия между группами при р<0,05 расценивали как значимые, р<0,01 — очень значимые.
Результаты и обсуждение
Среди пациентов с первой степенью ПМР легкая степень тяжести ДСТ выявлена у 9 (50,0%) человек, умеренная степень тяжести — у 7 (38,9%), тяжелая степень — у 2 (11,1%) (табл. 1). В группе пациентов со II степенью ПМР легкая степень тяжести ДСТ выявлена у 17 (56,6%), умеренная степень тяжести — у 10 (33,4%), тяжелая степень — у 3 (10,0%). Среди пациентов с III степенью ПМР легкая степень тяжести ДСТ — у 6 (22,2%), умеренная степень тяжести — у 16 (59,3%), тяжелая степень тяжести — у 5 (18,5%). У пациентов с IV степенью ПМР легкая степень тяжести ДСТ не встречалась, умеренная степень тяжести – у 4 (37,4%), выраженная степень тяжести – у 7 (62,6%). В группе пациентов с V степенью ПМР легкая степень тяжести ДСТ не выявлена, встречалась умеренная степень тяжести — у 5 (55,6%) и выраженная степень тяжести ДСТ – у 4 (44,4%).
Таблица 1. Распределение степени выраженности ПМР у пациентов в зависимости от тяжести ДСТ
| Степень ДCT | Степень ПМР | Достоверность | ||||
| 1 степень | II степень | III степень | IV степень | V степень | ||
| Тяжелая | 2 | 3 | 5 | 7 | 4 | р = 0,001, Х2 = = 17,646 |
| Умеренная | 7 | 10 | 16 | 4 | 5 | р =0,195 Х2 = 6,059, |
| Легкая | 9 | 17 | 6 | * | р = 0,000, X2 =20,985 |
|
| Всего | 18 | 30 | 27 | 11 | 9 | |
При оценке степени ДСТ проявлений у пациентов с различной выраженностью гидронефроза выявлено: у пациентов с гидронефрозом I степени легкая ДСТ – 5 (62,5%), умеренная – 3 (37,5%), выраженная ДСТ в данной группе не встречалась (табл. 2). У пациентов с гидронефрозом II степени легкая ДСТ встречалась у 6 человек (40%), умеренная у 6 (40%), выраженная у 3 (20%). Среди пациентов с III степенью гидронефроза легкая степень ДСТ встречалась у 5 (20,8%), умеренная у 10 (41,6%), выраженная у 9 человек (41,6%).
Таблица 2. Распределение степени выраженности гидронефроза у пациентов в зависимости от тяжести ДСТ
| Степень ДСТ | Степень гидронефроза | Достоверность | ||
| I | II | IIIА | ||
| Выраженная | - | 3 | 9 | p = 0,091, χ2 = 4,792 |
| Умеренная | 3 | 6 | 10 | p = 0,978, χ2 = 0,045 |
| Легкая | 5 | 6 | 5 | p = 0,083, χ2 = 4,987 |
| Всего | 8 | 15 | 24 | |
Детям, которым проводилось оперативное лечение, выполняли гистологическое исследование участка мочеточника и кожи, взятой из области оперативного доступа. В результате проведенного исследования отмечался ряд отличий в структурных изменениях соединительной ткани у пациентов с ДСТ по сравнению с детьми, не имевшими ДСТ. Морфологические изменения, имевшие место в мочеточниках и коже, взятой из области оперативного доступа, показали наличие достоверных изменений (p=0,001, χ2 =17,7) со стороны структуры соединительной ткани у пациентов с тяжелой степенью ДСТ. Полученные данные сравнительного фенотипического анализа, проведённого у детей с АМВС, указывают на присутствие системного характера вовлеченности соединительной ткани всего организма в процесс её дезинтеграции даже при отсутствии больших пороков развития в других органах и тканях.
Главным признаком дисплазии соединительной ткани в мочеточниках являлось нарушение ориентации гладкомышечных волокон, которые в норме формируют два слоя ориентированных в перпендикулярном направлении по отношению друг к другу мышечных пучков. При этом при дисплазии такая стратификация была плохо различима: между мышечными волокнами отмечалось повышенное количество соединительной ткани и сглаживание сосочковых складок мочеточников (рис. 1). Соединительная ткань представлена коллагеновыми волокнами, венозные сосуды, как правило, паретически расширены. Эластические волокна становились более грубыми и плохо ориентированными. За счет этого изменялась способность мочеточника к расширению и перистальтическим сокращениям. В мышечном слое и адвентиции эластические волокна располагались хаотично и были неравномерно утолщены. Эластическая мембрана артерий практически не прослеживается.
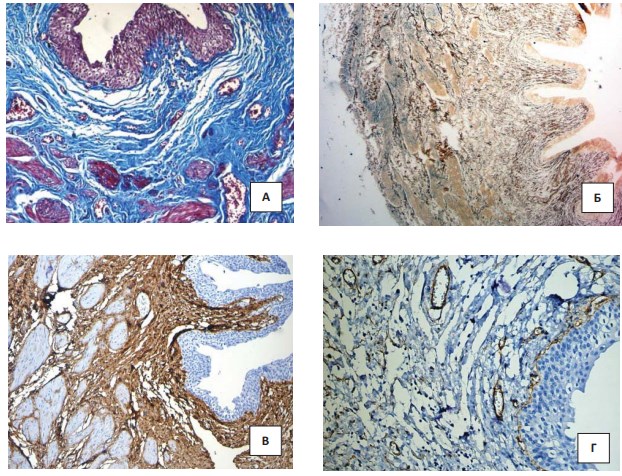
Рисунок 1. Гистологическое исследование мочеточника у ребенка с тяжёлой степенью ДСТ: А – трехцветное окрашивание по Массону. Увеличение х200; Б – окраска импрегнацией серебром по Футу. Увеличение х200; В – ИГХ против Collagen I. Увеличение х200; Г – ИГХ против Collagen IV. Увеличение х200
При иммуногистохимическом исследовании волокна коллагена I типа при ДСТ в стенке мочеточника были утолщены и распределены не равномерно. Вокруг сосудов артериального типа отмечалось повышенное содержание волокон коллагена I типа. При этом эластическая мембрана была неразличима. С другой стороны, в собственной пластинке уротелия слизистой мочеточника коллаген IV типа был различим в виде фрагментов и обнаруживался в стенках сосудов. Особенно обращала на себя внимание особенность отложения IV типа коллагена в крупных артериях. Последний приобретал патологический характер, поскольку волокна коллагена IV типа оплетали практически каждую гладкомышечную клетку стенки артерий.
В стенке стенозированного мочеточника при трехцветном окрашивании по Массону отмечалось развитие коллагеновых волокон. Коллагеновые волокна утолщены и хаотично расположены (рис. 2). Массивные отложения коллагена выявлялись и периваскулярно. В участках, где мышечные волокна еще сохранены, было видно, как грубые коллагеновые волокна прорастали в мышечные пучки с их деформацией. Значительным изменениям при формировании стриктур подвергался и эластический каркас мочеточника. При этом эластические волокна располагались хаотично и были неравномерно утолщены.
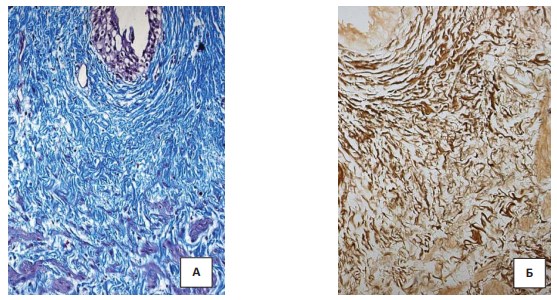
Рисунок 2. Гистологическое исследование стриктуры мочеточника у ребенка с тяжёлой степенью ДСТ: А – трехцветное окрашивание по Массону. Увеличение х400; Б - окраска импрегнацией серебром по Футу. Увеличение х400
Среди детей с легкой степенью тяжести ДСТ рецидивов и осложнений после оперативного лечения гидронефроза и ПМР не отмечали. Вместе с тем, использование баллонной дилатации катетером с последующим стентированием и учетом степени выраженности ДСТ позволило сократить количество отрицательных результатов (рестеноз ПУС, нарастание степени гидронефроза, ухудшение секреторно–выделительной функции, истончение почечной паренхимы) до 10,0%. Среди 28 детей с выраженными проявлениями ДСТ, оперированных по поводу гидронефроза (операцией Андерсона–Хайнса) отрицательных результатов не наблюдали.
Результаты лечения детей с ПМР, отягощённого ДСТ, также показали, что выздоровление (положительный результат) после эндоколлагенопластики и антирефлюксной пластики по Чумакову-Татаркину отмечали достоверно (p = 0,001, χ2 = 22,689) чаще после открытого оперативного вмешательства. После оперативного лечения 33 детей отмечался 1 рецидив рефлюкса после антирефлюксной пластики по Чумакову-Татаркину.
ДСТ связана с нарушением синтеза и функционирования белков коллагена и эластина. При этом ДСТ представляет собой полисистемную патологию, в основе которой лежат дефекты синтеза и/или катаболизма компонентов внеклеточного матрикса. В результате неблагоприятных воздействий на плод в период внутриутробного развития на фоне генетической предрасположенности к нарушению нормального эмбриогенеза возникают недифференцированные формы ДСТ у детей АМВС [2, 4, 8].
Таким образом, использование комплексного подхода у детей с АМВС, учитывающего выраженность ДСТ, позволяет не только уменьшить количество послеоперационных осложнений и рецидивов заболевания, но и наметить пути для дальнейшего развития подходов в лечении данной патологии в детском возрасте.
Выводы:
- У детей с врожденными АМВС имеется сильная прямая корреляция между степенью выраженности ДСТ и степенью тяжести заболевания. При этом для тяжелых пороков развития характерны симптомы выраженной дисплазии, а для пороков легкой степени – легкие и умеренные проявления синдрома ДСТ (p = 0,001, χ2 = 20,985).
- При морфологическом исследовании мочеточников с использованием иммуногистохимического анализа у больных с тяжелой степенью ПМР и гидронефроза на фоне выраженных проявлений ДСТ были обнаружены достоверные изменения строения волокон соединительной ткани по сравнению с пациентами контрольной группы. Вследствие значительной фрагментации и хаотичного расположения волокон коллагенов I и IV типов эластический каркас мочеточника подвергался значительным изменениям (p = 0,001, χ2 = 26,796).
- Всем пациентам, которым производится хирургическая коррекция АМВС, необходимо обязательное иммуногистохимическое исследование коллагенов I и IV типов.
Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Добросельский М.В., Чепурной Г.И., Коган М.И., Сизонов В.В. Современные подходы к лечению пузырно-мочеточникового рефлюкса у детей (обзор литературы). Медицинский вестник Юга России. 2014;(1):23-27.
- Минаев С.В., Тимофеев С.И., Мационис А.Э., Павленко И.В. Морфологическая диагностика проявлений недифференцированной дисплазии соединительной ткани в детской хирургической практике. Медицинский Вестник Северного Кавказа. 2016;11(2.2):334- 338. doi: 10.14300/mnnc.2016.11070
- Болотов Ю.Н., Минаев С.В., Шляхов П.И., Агапов И.В. Мета-анализ: вероятность атрофии яичка при острых заболеваниях гидатид яичка в детском возрасте. Вестник хирургии им. И.И. Грекова. 2013;172(3):64- 67.
- Capuano A, Bucciotti F, Farwell KD, Tippin DB, Mroske C, et al. Diagnostic Exome Sequencing Identifies a Novel Gene, EMILIN1, Associated with Autosomal-Dominant Hereditary Connective Tissue Disease. Human Mutation. 2016;37(1):84-97. doi:10.1002/humu.22920
- Пасечник Д. Г., Коган М. И., Митусова Е. В., Набока Ю. Л., Газаеви З. И. и др. Вызывают ли неклостридиальные анаэробные бактерии острый пиелонефрит при мочеточниковой обструкции? Медицинский Вестник Северного Кавказа. 2016;11(2):207-210. doi: 10.14300/ mnnc.2016.11038
- Ягода А. В. Малые аномалии сердца. Ставрополь: «СтГМА»;2005:248.
- Гетман Н.В., Минаев С.В., Сумкина О.Б., Романеева Н.М. Гистоструктура и гистометрия селезеночной вены в норме и при портальной гипертензии. Медицинский Вестник Северного Кавказа. 2014;9(1):58-62. doi: 10.14300/mnnc.2014.09017
- Craig JC, Simpson JM, Williams GJ. Prevention of Recurrent Urinary Tract Infection in Children with Vesicoureteric Refl ux and Normal Renal Tracts (PRIVENT) investi- gators. Antibiotic prophylaxis and recurrent urinary tract infection in children. Engl. J. Med. 2009;29(3):1748– 1759.
- Nagler EV, Williams G, Hodson EM, Craig JC. Interventions for primary vesicoureteric refl ux. Cochrane Database Syst Rev. 2011;15(6):CD001532. doi: 10.1002/14651858. CD001532.pub4
- Tasian GE, Casale P. The robotic-assisted laparoscopic pyeloplasty: gateway to advanced reconstruction. Urologic Clinics 2015;42(1):89–97 doi: 10.1016/j.ucl.2014.09.008
- Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани: руководство для врачей. - СПб.: Элби-СПб; 2009:704.
- Чумаков П.И. Внутрипузырная пластика устья мочеточника при ортотопическом уретероцеле у детей. Урология. 2005;3:52-54.
- Dabbs D. Diagnostic immunohistochemistry.3rd ed. Philadelphia; 2010:952.
- Minaev SV, Obozin VS, Barnash GM, Obedin AN. The infl uence of enzymes on adhesive processes in the abdominal cavity. Eur. J. Pediatr. Surg. 2009;19(6):380-383. doi: 10.1055/s-0029-1241847
Статья опубликована в журнале "Вестник урологии" №3 2017, стр. 22-29










Комментарии