М.Б. Чибичян
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Введение
Рак предстательной железы (РПЖ) — одно из наиболее распространенных онкологических заболеваний в мире. По современным эпидемиологическим данным, данное заболевание занимает второе место в структуре смертности от рака у мужчин. В 2015 г., по данным SEER (Surveillance, Epidemiology and End Results), статистической базы данных Национального института рака (США), в Северной Америке выявлено более 220 800 новых случаев РПЖ, 27540 мужчин умерли от этого заболевания (рис. 1). Доля локализованного РПЖ – 79 %, местно-распространенного – 12 %, метастатического – 5 %, и в 4 % был зарегистрирован РПЖ в неизвестной фазе. В 2014 г. в США насчитывалось приблизительно 3085209 мужчин с раком предстательной железы (h? ps://seer.cancer.gov/sta? acts/html/ prost.html). Так же было подсчитано, что ежегодная заболеваемость РПЖ в Соединенных Штатах возрастет с 192280 в 2009 г. до 384000 в 2025 г. и до 452000 в 2045 г.
По данным исследования МНИОИ им. П.А. Герцена, опубликованным в 2017 г., «грубый» показатель заболеваемости раком предстательной железы в Российской Федерации за последние 15 лет с 2001 по 2015 гг. увеличился 3,0 раза с 19,01 до 57,22 случаев на 100 тыс. населения. И в 2015 г. в России выявлены 38812 новых случаев РПЖ [1].
Общие положения в проблеме лечения локального рака предстательной железы
Радикальное хирургическое лечение рака предстательной железы – радикальная простатэктомия (РПЭ) – предполагает удаление простаты в промежутке между перепончатой уретрой и шейкой мочевого пузыря, обоих семенных пузырьков, а также двухстороннюю резекцию заднебоковых нервно-сосудистых пучков. Целью РПЭ должно быть искоренение болезни любым способом, сохраняя при этом континенцию и, по возможности, потенцию. Увеличение коморбидности значительно увеличивает риск смерти от причин, не связанных с раком простаты. Оценка ожидаемой продолжительности жизни имеет первостепенное значение при информировании пациента об операции. В настоящее время три крупных перспективных рандомизированных клинических исследования сообщили о пользе радикального лечения над выжидательной тактикой и активным наблюдением у мужчин с РПЖ с низким и средним риском.
Радикальная простатэктомия может выполняться открытым (позадилонная, промежностная), лапароскопическим или роботизированным подходами. Более низкие показатели положительных хирургических краев у опытных хирургов позволяют предположить, что опыт и тщательное внимание к хирургическим деталям, влияют на качество лечения рака [2].
РПЭ является одним из методов лечения локального РПЖ. К другим методам относятся активный мониторинг, наружная лучевая терапия, брахитерапия, гормональная терапия.
Решения по поводу лечения должны приниматься после того, как все виды оказания медицинской помощи обсуждались многопрофильным консилиумом (включая урологов, онкологов и радиологов), а также после сопоставления преимуществ и побочных эффектов каждого терапевтического метода вместе с пациентом.
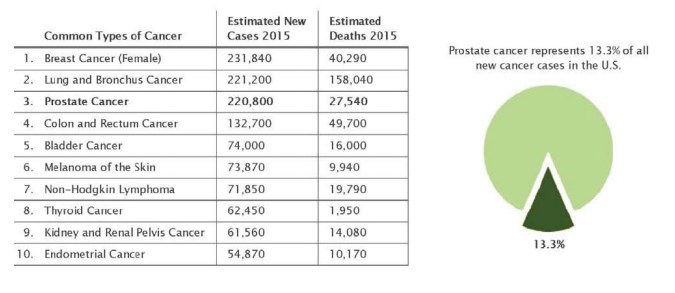
Рисунок 1. Распространенность и смертность РПЖ в США
В данной лекции будут рассмотрены аспекты позадилонной радикальной простатэктомии.
История
Впервые позадилонную методику для радикальной простатэктомии предложил английский уролог Millin в 1947 г. Впоследствии европейские и урологи США внесли спектр усовершенствований в оперативную технику [2-4]. Однако эта операция не нашла широкое применение ни в России, ни в мире вплоть до 80-х гг. прошлого столетия в силу ряда существенных причин: редкой диагностики органо-ограниченного рака простаты, отсутствия достоверных методов обнаружения метастазов, сложности техники выполнения самой операции и сопровождающих её жизнеопасных осложнений, таких как прежде всего массивных кровотечений. Восьмидесятые и девяностые годы ХХ века ознаменовались рядом новаторских анатомических разработок. Прогресс в изучении венозной анатомии малого таза, хирургической анатомии кавернозных нервов и наружного уретрального сфинктера позволил разработать технику, получившую название анатомической РПЭ. Методика операции, предложенной и впервые выполненной P.С. Walsh в 1982 г., позволила существенно снизить морбидность и улучшить функциональные послеоперационные исходы (снижение частоты послеоперационной инконтиненции и эректильной дисфункции), способствовав широкому принятию метода в качестве стандарта лечения локализованного РПЖ. Отдаленные результаты продемонстрировали высокую эффективность РПЭ в отношении онкологического контроля и качества жизни пациентов – в 2012 г. J.K. Mullins et al. опубликовали данные более чем 25-летнего послеоперационного наблюдения [5].
Тогда же была сформирована современная концепция диагностики и стадирования РПЖ, что способствовало развитию диагностического ажиотажа и переоценке эпидемиологических параметров рака предстательной железы. В 1990-е гг. стал очевидным тот факт, что рак простаты является самым частым опухолевым заболеванием у мужчин в США, а в развитых странах Европы занимает 2-е место после опухолевых поражений кожи. В РФ широкое распространение РПЭ началось со 2-й половины 1990-х гг.
Развитие диагностики и усовершенствование хирургических подходов к предстательной железе дали огромный толчок развитию радикальной хирургии РПЖ. А в ведущих странах мира РПЭ стала самым распространённым урологическим вмешательством [2, 3].
последние годы набирает популярность роботическая радикальная простатэктомия. Alemozaff ar M et al. сообщают, что если в начале 2000-х гг. позадилонная радикальная простатэктомия в США выполнялась в подавляющем большинстве случаев, то спустя 10 лет роботическая РПЭ имеет долю, превышающую 70 % в хирургии рака простаты [6] (рис. 2.).
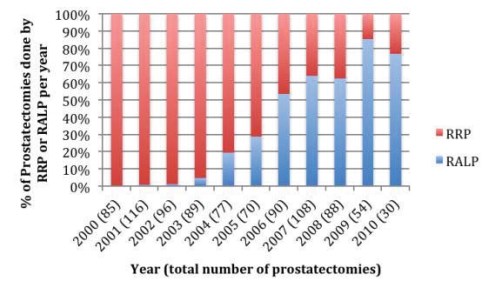
Рисунок 2. Распространенность и смертность РПЖ в США
Однако и по сегодняшний день во многих центрах позадилонная радикальная простатэктомия занимает значительную долю в хирургии РПЖ [7].
Отбор пациентов и показания к радикальной позадилонной простатэктомии
Радикальное хирургическое лечение РПЖ заключается в удалении ПЖ в промежутке между перепончатой уретрой и шейкой мочевого пузыря единым блоком с семенными пузырьками и парапростатической клетчаткой. РПЭ зачастую сочетается двусторонней тазовой лимфаденэктомией (ТЛАЭ). У мужчин с локализованным РПЖ и ожидаемой продолжительностью жизни ≥ 10 лет цель выполнения РПЭ независимо от доступа – удаление опухоли с сохранением механизма удержания мочи и, если это возможно, эректильной функции. Для РПЭ не существует ограничений по возрасту, и пациенту не следует отказывать в операции, основываясь только на этом параметре. Высокая морбидность по сопутствующей патологии сильно повышает риск смерти от неопухолевых причин. В настоящее время РПЭ – единственный метод лечения локализованного РПЖ, который даёт преимущество в канцер-специфической выживаемости по сравнению с выжидательной тактикой. Опыт хирурга позволяет снизить частоту осложнений РПЭ и улучшить показатели излечения от болезни [2, 3, 8].
РПЖ стадии T1a–T1b. Стадия опухоли T1a определяется как случайно выявленный при гистологическом исследовании рак, который занимает 5% или менее объема резецированной ткани (при ТУР ПЖ или открытой аденомэктомии). Стадия T1b устанавливается, если рак занимает > 5 % удаленной ткани. РПЖ стадии T1a–T1b выявляется инцидентально в 4–16 % случаев при хирургическом лечении ДГПЖ. Значимыми прогностическими факторами наличия резидуальной опухоли при РПЭ является уровень простатспецифического антигена (ПСА), определённый до и после операции по поводу гиперплазии ПЖ, а также индекс Глисона. Решение о выполнении РПЭ при инцидентальном РПЖ необходимо принимать с учетом вероятности прогрессии. Прогрессии нелеченного РПЖ T1a–T1b спустя 5 лет реализуется у 5 % мужчин, через 10 лет — у 50%. РПЭ следует предлагать пациентам с большой ожидаемой продолжительностью жизни и при низкодифференцированном РПЖ. Уровень ПСА может быть предиктором в принятии решения об активной тактике [2, 3, 8].
РПЖ стадии T1c и T2a. Опухоли, которые выявляются только при биопсии ПЖ, выполняемой в связи с повышенным уровнем ПСА (T1c), становятся наиболее часто встречающимся видом РПЖ. Опухоли стадии T1c всего лишь в 11-16 % клинически не значимые и могут подлежать активному мониторингу. В 30 % случаев при патоморфологическом исследовании после РПЭ диагностируется местно-распространенный РПЖ. Как распознать те опухоли, которые не требуют выполнения РПЭ. Если рак выявлен только в одном или нескольких биоптатах и процент поражения одного столбика незначим при низком индексе Глисона, то скорее всего такой РПЖ можно наблюдать. РПЭ показана пациентам с РПЖ стадии T2a и ожидаемой продолжительностью жизни не менее 10 лет, ввиду того, что в 35-55 % случаев наблюдается прогрессия рака в течение 5 лет при отсутствии лечения [2, 3, 8].
Пациентам с локальным РПЖ низкого риска выполнять расширенную ТЛАЭ не обязательно, т.к. вероятность поражения опухолью ЛУ не превышает 5 % [3].
Локализованный РПЖ промежуточного риска: стадия T2b–T2c, или индекс Глисона 7, или уровень ПСА 10–20 нг/мл РПЭ — один из рекомендованных стандартных методов лечения РПЖ промежуточного риска при ожидаемой продолжительности жизни пациента более 10 лет. При локализованном РПЖ по данным патоморфологического исследования РПЭ дает прекрасный прогноз. Некоторым пациентам с локализованным раком промежуточного риска предлагается активный мониторинг. Однако если опухоль пальпируется или визуализируется, но клинически остается в пределах ПЖ, у большинства пациентов при длительном наблюдении рак будет прогрессировать. Рак стадии T2b прогрессирует более чем у 70 % пациентов в течение 5 лет [2]. Пациентам с локализованным РПЖ промежуточного риска необходимо выполнять расширенную ТЛАЭ, если установленный риск поражения опухолью ЛУ превышает 5 % [2, 3, 8].
Локализованный РПЖ высокого риска: стадия T3a, или индекс Глисона 8–10, или уровень ПСА > 20 нг/мл.
В 20-35 % пациентов с впервые диагностированным РПЖ идентифицируется группа высокого риска на основании либо уровня ПСА > 20 нг/мл, индекса Глисона ≥ 8, либо выявляемого клинически местно-распространенной опухоли. У пациентов данной группы имеются повышенные риски опухолевой прогрессии, необходимость проведения адъювантной терапии, риски прогрессирования до фазы метастатической болезни и канцерспецифической смерти от РПЖ. Несмотря на вышесказанное часть пациентов группы высокого риска имеют шансы получить хороший результат от РПЭ. Нет консенсуса по хирургическому лечению пациентов с РПЖ высокого риска.
РПЭ возможный вариант первичного лечения для отобранных пациентов с небольшими опухолями. Пациентам с РПЖ высокого риска во всех случаях необходимо выполнять расширенную ТЛАЭ – установленный риск лимфогенного метастазирования составляет 15–40 % [2, 3, 8].
Показания к РПЭ – локализованный рак предстательной железы с низким и промежуточным риском у пациентов с ожидаемой продолжительность жизни более 10 лет; стадия Т1b - Т2 (Глисон 2-7 и ПСА<20).
Возможные показания к РПЭ – стадия Т1а с ожидаемой продолжительностью жизни более 15 лет или суммой Глисона 7; отобранные пациенты с локализованной формой РПЖ, малого объёма и высокого риска (стадия Т3а, или ПСА>20, или Глисон 8-10); тщательно отобранные пациенты с локализованной формой РПЖ, очень высокого риска (стадия Т3б-Т4, или любой ТN1) в формате мультимодальной терапии.
Предоперационная подготовка
Операцию выполняют через 6-8 недель после полифокальной биопсии простаты, т.е. по существу с момента установления диагноза карциномы. Сроки, выдерживаемые после биопсии необходимы для редукции гематом и воспалительных инфильтратов между простатой и окружающими тканями. Это создает лучшие условия для диссекции тканей при РПЭ, особенно нервно-сосудистых пучков, и предупреждения повреждений прямой кишки. В течение этого срока больным не рекомендуют принимать аспирин и нестероидные противовоспалительные средства, заготавливают 200-400 мл аутологичной крови. Перед принятием решения о выборе РПЭ в качестве основного метода лечения карциномы простаты каждый пациент получает объективную консультацию оперирующего уролога с предоставлением общей информации об операции, возможных осложнениях (кровотечение, недержание мочи, эректильная дисфункция и др.) и особенностях послеоперационного периода, в том числе его длительности. За сутки до операции назначают обезжиренную жидкую пищу. Вечером перед операцией или утром в день операции проводят очистительную клизму. За 30-60 мин до начала анестезии внутривенно вводят один грамм сульперазона.
Используемый специальный инструментарий:
- головной осветитель, позволяющий более ясно визуализировать позадилонное пространство, где дифференциация тканей обычно затруднительна;
- наголовные лупы с 2,5-4-кратным увеличением, улучшающие четкость при диссекции верхушки простаты, перепончатой уретры и нервно-сосудистых пучков;
- стандартный ретрактор Balfour или ретрактор Book Walter для РПЭ помещается в рану передней брюшной стенки. На этапе лимфаденэктомии используют гибкую широкую лопатку для отведения боковой стенки мочевого пузыря, а в ходе радикальной простатэктомии проксимальной лопаткой отводят назад и краниально мочевой пузырь, что позволяет выполнить операцию бригадой из двух хирургов;
- левые и правые прямоугольные диссекторы;
- уретральный буж.
Техника радикальной позадилонной простатэктомии
Позиционирование пациента и операционной бригады. Пациент находится на операционном столе в умеренно разогнутом в области таза положении (супинация) (рис.3.)
Рисунок 3. Позиционирование больного на операционном столе
На этапе диссекции верхушки простаты столу придается умеренная обратная позиция Тренделенбурга, после чего для облегчения визуализации и диссекции шейки мочевого пузыря стол переводили в умеренную позицию Тренделенбурга
Хирургический доступ.
Кожа обрабатывается и укрывается стандартным образом. Катетер Фолея № 20—22 проводится в мочевой пузырь, баллон заполняется 15-20 мл 0,9 % физиологического раствора, катетер соединяется с закрытым резервуаром для сбора мочи. Нижнесрединный внебрюшинный разрез живота производится от лона до пупка, длиной 10-15 см. Прямые мышцы разделяются по средней линии, а поперечная фасция рассекается, обнажая пространство Retzius. Передняя фасция рассекается остро вплоть до лона. Латерально от мочевого пузыря мобилизовывается брюшина до уровня бифуркации общих подвздошных артерий. Семявыносящие протоки не выделяются и не перевязываются. В рану устанавливается ретрактор Balfour, который фиксируется к операционному столу.
Тазовая лимфаденэктомия.
Показания:
- дооперационный уровень ПСА >10 нг/мл (независимо от стадии и индекса Глисона);
- индекс Глисона > 7 (независимо от ПСА и стадии опухоли);
- клиническая стадия > 2b (независимо от ПСА и индекса Глисона).
Тазовую лимфаденэктомию производят до радикальной простатэктомии. Немедленное интраоперационное морфологическое исследование лимфатических узлов рекомендовано при дооперационном индексе Глисона > 7 и их пальпаторном увеличении.
Техника. Тазовую лимфаденэктомию начинают со стороны, где определяется наибольшая опухоль в простате, путем рассечения фасциального футляра над наружной подвздошной веной. Иссечение жиролимфатического образца начинают внутрь от наружной подвздошной вены, позади нее, доходя до внутренней стенки таза и продвигаясь дистально к феморальному каналу до уровня устья поверхностной огибающей подвздошной вены. Здесь лимфатические сосуды лигируются. Затем диссекция продолжается в краниальном направлении до бифуркации общей подвздошной артерии. Удаляются лимфатические узлы в углу между наружной и внутренней подвздошными артериями и вперед от последней. Разделяемые ткани перевязываются лигатурой. Отделение тканевого комплекса от внутренней стенки таза вглубь приводит к визуализации запирательного нерва. Такая же лимфаденэктомия производится с контралатеральной стороны (рис.4).
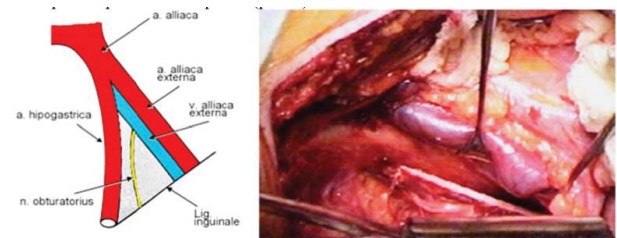
Рисунок 4. Границы ТЛАЭ
Жировые ткани, покрывающие переднюю полуокружность простаты удаляются путем их коагуляции с тем, чтобы обнажить перипростатическую фасцию и поверхностные ветви дорсальной вены.
Расширенная тазовая лимфаденэктомия включает удаление лимфоузлов по ходу наружной подвздошной артерии и вены, лифоузлов в запирательной ямке, расположенных краниально и каудально относительно запирательного нерва, и лимфоузлов, расположенных медиальнее и латеральнее внутренней подвздошной артерии. Удалению подлежат так же и общие подвздошные лимфоузлы до перекреста с мочеточниками. Это способствует удалению 75 % всех потенциальных лимфогенных метастазов. Для повышения качества морфологического исследования среднее количество удаленных лимфоузлов должно быть не менее 20 (рис. 5).
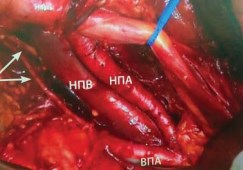
Рисунок 5. Операционное поле после расширенной ТЛАЭ: НПА — наружная подвздошная артерия, НПВ — наружная подвздошная вена, ВПА — внутренняя подвздошная артерия
Простатэктомия. Рассечение эндопельвикальной фасции. Эндопельвикальную фасцию освобождают мягким тупфером от жировых тканей, которые сдвигали к боковым стенкам таза. На границе перехода с внутренней стенки таза на простату вскрывали фасцию остроконечными ножницами. Ее разрез продлевали на 2-3 см в краниальном направлении и аккуратно в каудальном. Длина разреза фасции составляла около 4-5 см. Аналогичный разрез производили с контралатеральной стороны (рис.6, 7).
В своей работе чаще всего мы применяем способ R.P. Myers c использованием зажима Babcock, которымзахватывается вся порция дорсального венозного комплекса, тем самым уменьшая его в объёме; останавливается кровотечение, которое иногда может возникнуть при выполнении вышеописанных манипуляций (Myers R.P., 1987) [9] (рис. 8).
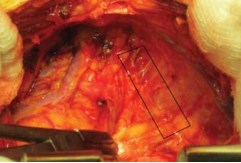
Рисунок 6. Доступ к фасции Endopelvica (отмечена зона вскрытия фасции)
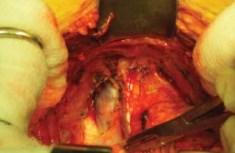
Рисунок 7. Рассечение фасции Endopelvica
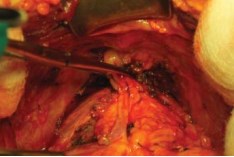
Рисунок 8. Выделение дорсального венозного комплекса по R.P. Myers
Прошивание комплекса производится лигатурой из полисорба 2.0 на атравматической игле в плоскости между перепончатой уретрой и венозным комплексом, но без прошивания верхушки предстательной железы и уретры и, не захватывая мышцы мочеполовой диафрагмы (рис. 9). Узел завязывается, и таким же образом накладывается вторая лигатура. Во избежание ретроградного кровотечения из проксимальных концов вен прошиваются и перевязываются латеральные венозные сплетения справа и слева у основания предстательной железы, после чего пересекается дорсальный венозный комплекс. Для этого предстательная железа тупфером максимально смещается краниально и вглубь таза, что позволяет хорошо идентифицировать ткани и пересечь венозное сплетение без повреждения капсулы предстательной железы и лигатур, наложенных на дорсальный венозный комплекс (рис. 9, 10). Средний объем кровопотери на данном этапе составлял до 100 мл.
Отсечение уретры. После разделения дорсального венозного комплекса визуализация простатоуретрального соединения позволяла определить место отсечения уретры от простаты. Отсечение уретры скальпелем начинают с поперечного рассечения передней стенки уретры от 3 до 9 ч, сразу дистальнее верхушки простаты (рис. 11). Обнаженный катетер Фолея извлекают частично через рану уретры, накладывая на него зажим и дистальнее зажима катетер пересекают полностью (рис. 12). Дистальный свободный фрагмент катетера удаляют из уретры.
Остроконечными ножницами заднюю стенку уретры поперечно пересекают. Обнажают заднюю часть поперечнополосатого уретрального сфинктера. Диссектор проводят справа налево под сфинктером посередине расстояния между верхушкой простаты (рис. 13).
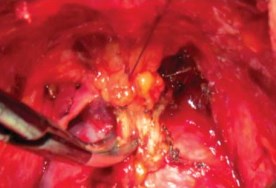
Рисунок 9. Прошивание ДВК
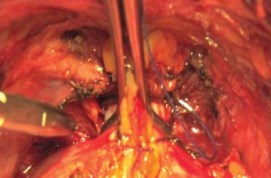
Рисунок 10. Пересечение ДВК
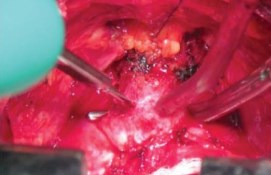
Рисунок 11. Пересечение уретры
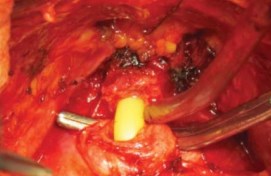
Рисунок 12. Катетер в уретре
Идентификация и сохранение нервно-сосудистых пучков. После рассечения задней составляющей уретрального сфинктера и визуализации передней стенки прямой кишки, пальцем, скользя по передней стенке прямой кишки в краниальном направлении, производят ход между простатой и прямой кишкой вплоть до уровня семенных пузырьков. После этого пальцевого маневра отделение нервно-сосудистых пучков может начаться от верхушки простаты. Подтягивая простату с помощью катетера вверх и краниально остроконечными ножницами, скользя по поверхности простаты, от верхушки рассекают тонкий и мягкий слой фиброзно-жировых тканей, что и приводит к отделению нервно-сосудистого пучка. Латеральные сосудисто-нервные пучки предстательной железы дробно и поочерёдно берут на зажимы и лигируют резорбируемым шовным материалом. Мобилизацию производят до основания предстательной железы (рис 14).
Пересечение шейки мочевого пузыря и диссекция семенных пузырьков. Скальпелем поперечно рассекают шейку мочевого пузыря по передней поверхности на границе с простатой со вскрытием слизистой. Сдутым катетером Фолея, оба конца которого находятся в одном зажиме, выполняют любые тракции простаты при манипуляциях с ней. Разрез шейки расширяют в обе стороны, концентрически. Сразу сзади от шейки на 5 и 7 часах определяются нижние мочепузырные сосудистые ножки, идущие к простате. После их разделения и перевязки обнажается пространство между задней стенкой мочевого пузыря и передней стенкой семенных пузырьков, после чего простата переворачивается задней поверхностью вперед. Скальпелем рассекают фасцию Denonvillier по длине 1,5-2 см на границе простаты и семенных пузырьков. Оба семявыносящих протока перевязываются и пересекаются. Острым путем выделяют задние и боковые поверхности семенных пузырьков. Затем выделяют переднюю их поверхность, опасаясь повреждения треугольника Льето вблизи устьев мочеточников. Органокомплекс — простата и семенные пузырьки — удаляется (рис. 15.). Малый таз подвергается тщательной ревизии на предмет гемостаза.
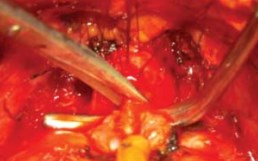
Рисунок 13. Пересечение задней полуокружности уретры
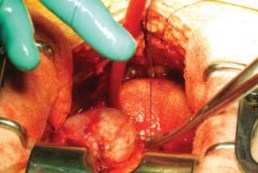
Рисунок 14. Завершена мобилизация до основания простаты
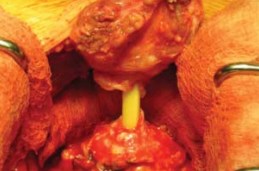
Рисунок 15. Пересечение шейки мочевого пузыря
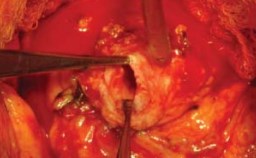
Рисунок 16. Шейка мочевого пузыря после удаления простаты
Формирование уретроцистоанастомоза. Диаметр шейки мочевого пузыря должен равняться 7-8 мм, т.е. соответствовать уретральному катетеру 22 Сh. Наложением швов на шейку мочевого пузыря через все слои с помощью полисорба 3-0 формируют необходимый диаметр шейки, который должен соответствовать диаметру мембранозной уретры. Целесообразно осуществлять марсупиализацию слизистой, выполняемую полисорбом 4-0 в 6-8 точках по диаметру шейки так, чтобы стыковочный край шейки с уретрой был укрыт слизистой, после чего шейка пузыря адаптируется к анастомозу (рис. 16, 17).
Наложение швов вначале производится на мембранозную уретру, в которую вводится металлический буж Гюйона или уретральный катетер. Они визуализируют просвет уретры перед её прошиванием (рис. 18.). Швы накладываются снаружи внутрь, причем локализация первого шва выбиралась наиболее удобным местом для первого вкола иглы.
В качестве шовного материала используют биосин или монокрил 3-0. Достаточно наложения 5-6 нитей равномерно по всей окружности. В швы берется в зоне 5-7 часов задняя порция поперечнополосатого уретрального сфинктера, и нить проходит через все слои уретры в 2-2,5 мм от ее края. В зоне 12 часов в шов берется вместе со всей уретрой и дорсальный венозный комплекс. Таким образом, швы накладывали на 12, 3, 5, 7 и 9 часах (5 нитей) или на 12, 2, 4, 6, 8, 10 часах (6 нитей) условного циферблата (рис. 19). перед созданием цистоуретроанастомоза
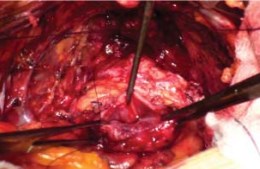
Рисунок 17. Шейка мочевого пузыря перед созданием анастомоза
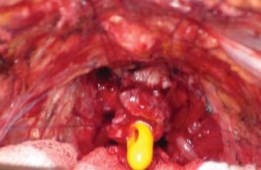
Рисунок 18. Вид уретры перед завязыванием лигатур
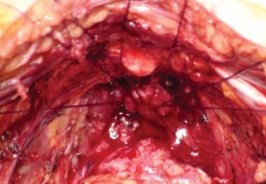
Рисунок 19. Окончательный вид уретры
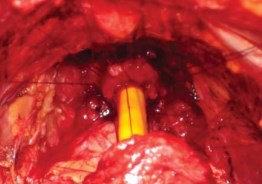
Рисунок 20. Натяжение лигатур
Далее, нити, проведенные через уретру, накладывают на соответствующие зоны шейки мочевого пузыря изнутри наружу последовательно, начиная с задних нитей (рис. 20). После проведения 3 задних нитей через шейку по уретре в мочевой пузырь устанавливают катетер Фолея 20-22 Ch, наполнив баллон до 10 мл. Затем проводят остальные нити. После декомпрессии раны живота (удаление ретрактора), подтягивают все нити и последовательно завязывают их, начиная с задних, заканчивая формирование уретроцистоанастомоза (рис. 21, 22).
Мочевой пузырь отмывают от мелких сгустков крови. Полость таза орошают антисептиком. Полость таза дренируют силиконовыми трубками. Однорядно непрерывно ушивают апоневроз не рассасывающимся шовным материалом. На кожу — клипсы или отдельные швы.
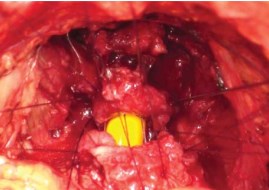
Рисунок 21. Сопоставление слизистой уретры и шейки пузыря
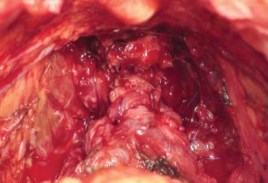
Рисунок 22. Анастомоз
Осложнения радикальной позадилонной простатэктомии
Частота тяжёлых осложнений после РПЭ в последнее время значительно снизилась и это связано с соблюдением анатомичности и накоплением хирургического опыта в выполнении операции.
Одним из частых и серьёзных интраоперационных осложнений является кровотечение из венозных коллекторов простаты. Повреждение вен Санториниева сплетения обычно происходит при рассечении внутритазовой фасции и при перевязке дорсального венозного комплекса. Остановить кровотечение позволяет ушивание дорсального венозного комплекса, но только после его полного пересечения, иначе тракции за простату при неполном пересечении дорсального венозного комплекса только усилят кровотечение за счет расширения отрытого просвета сосудов. Удовлетворительная визуализация операционного поля для выполнения последующих шагов, в частности пересечения уретры, возможно только после достижения полного гемостаза в венозном комплексе. При правильности выполнения и соблюдения анатомичности простатэктомии объём кровопотери, как правило, не превышает 500 мл.
Реже при РПЭ повреждается прямая кишка (до 3 %) и мочеточники (0,2 %). При обнаружении дефекта прямой кишки интраоперационно края прямокишечной раны освежаются и ушиваются двухрядным швом. Производят девульсию анального сфинктера. Между прямой кишкой и уретро-везикальным анастомозом целесообразно сделать прослойку путем использования пряди большого сальника. Эта тактика позволяет избежать развития раневой инфекции, абсцесса таза и ректоуретрального свища. В случае плохой коморбидности пациента полезно выполненные процедуры сопровождать наложением колостомы. Повреждение мочеточников происходит как правило в предпузырном отделе и требует их реимплантации в мочевой пузырь [2, 3, 8].
Ранние послеоперационные осложнения. Смертность в течение 30 дней после операции колеблется от 0 до 1,2 % и связана в основном тромбоэмболическими осложнениями магистральных сосудов сердечно-легочной системы, которые встречаются у 0,6-1,7 % больных. Профилактика этих осложнений должна быть направлена на соблюдение стандартных мероприятий, предусматривающих использование компрессии нижних конечностей и низкомолекулярных гепаринов.
Частота других тяжёлых послеоперационных осложнений невысока: инфаркт миокарда — до 0,7 %, сепсис – 0,3 %, нагноение послеоперационной раны так же в 0,3% случаев. Отсроченные кровотечения описаны в 0,5 % случаев и, как правило, курируются консервативно. Массивные тазовые кровотечения с нарушением системной гемодинамики требуют ревизии малого таза и остановки кровотечения с удалением образовавшейся внутритазовой гематомы [2, 3, 8].
Поздние осложнения радикальной позадилонной простатэктомии. Способность пациента к удержанию мочи после перенесенной РПЭ является одним из важнейших аспектов качества выполненного оперативного лечения. Недержание мочи — важнейшая социальная проблема, способная значительно ухудшить качество жизни пациента и снизить удовлетворённость проведённым лечением.
При выполнении РПЭ удержание мочи может быть сохранено, если часть рабдосфинктера, лежащая между верхушкой ПЖ и бульбозной уретрой, остаётся без повреждений. Континентность обеспечивается оставшейся частью сфинктера [2, 6].
Эректильная функция
Восстановление эректильной функции (ЭФ) после применения современных технологий РПЭ с максимальным сохранением кавернозных нервов и добавочных артерий значительно варьирует. Необходимо информировать пациента перед операцией о показателях эректильной функции, достигаемых хирургом, и возможности того, что для обеспечения радикальности лечения нужно будет удалять нервы, несмотря на планирование нервсберегающей (НС) операции. Поэтому, отбор пациентов к РПЭ с сохранением нервно-сосудистых пучков должен осуществляться строго по показаниям. При стадии T3, T2c, суммой баллов по Глисону при биопсии >7 или наличием более одного положительного биопсийного столбика из ипсилатерального участка с ИГ >6 нервсберегающая операция не выполняется. Как указано в ICSM первое положение в формате профилактики ЭД после РПЭ является то, что задолго до РПЭ, пациент и, когда это возможно, и его партнер, имеют право высказать пожелания о своей послеоперационной эректильной и сексуальной функции. Это может помочь врачу в понимании необходимости выполнения нервсберегающих процедур при операции и последующего восстановления ЭФ, а пациенту избежать ожиданий, которые в конечном счете могут не оправдаться. Dubbelman et al. оценивали сексуальные функции в зависимости от таких факторов как возраст пациента, тип операции, стадия болезни и воздержание. Данные о предоперационной и послеоперационной сексуальной активности и спонтанных эрекциях были доступны у 596 и 698 мужчин соответственно. Перед операцией, сексуальный интерес, сексуальная активность, спонтанные эрекции и оргазмбыли в норме у 99 %, 82,1 %, 90,0 % и 90 % мужчин соответственно. После РПЭ эти показатели снизились до 97,2 %, 67,3 %, 29,4 % и 66,8 % соответственно. Сексуальные функции сохранились у 141 из 192 мужчин (73,4 %) после 2-НС РПЭ, у 90 из 127 мужчин (70,9%) после 1-НС РПЭ и у 75 из 139 мужчин (54,0 %), после РПЭ без НС. В послеоперационномпериоде оргазм присутствовал у 123 (77,4 %) мужчин в возрасте моложе 60 лет и у 183 (61,2 %) мужчин в возрасте 60 лет и старше. Сексуальные функции зависели от возраста >= 60 лет, операции без НС и недержания мочи (более двух прокладок/день). После РПЭ, оргазмическая функция присутствует у большинства мужчин. Операция без сохранения нервов, возраст и выраженное недержания мочи являются факторами риска для сексуальной дисфункции после РПЭ [10].
Онкологические результаты позадилонной радикальной простатэктомии
Анализ первых результатов 15-летнего наблюдения за больными, подвергнутыми РПЭ показали удовлетворительный уровень онкологической безопасности. Так, в своей работе M. Han et al. показали, что 5-, 10- и 15-летняя безрецидивная выживаемость (БРВ) составила 84, 74 и 66 %, а 5-, 10- и 15-летняя раково специфическая выживаемость (РСВ) — 99, 96 и 90 % соответственно. Пациенты, включенные в исследование, были оперированы в период c 1982 по 1999 гг., и заболевание у части больных диагностировано до наступления «эры ПСА» и, следовательно, можно предположить, что РПЭ выполнялась при клиническом РПЖ, имеющем распространенный характер [11]. В другом крупном исследовании c медианой наблюдения 65 месяцев K.A. Roehl et al. показали 10-летнюю БРВ, РСВ и общую выживаемость (ОВ) - 68, 97 и 83 % соответственно [12].
Заключение
Позадилонная РПЭ демонстрирует удовлетворительные параметры отдаленного онкологического контроля на большой когорте пациентов c РПЖ. Тщательная оценка соматического статуса необходима при отборе пациентов c РПЖ, особенно группы низкого риска, для РПЭ. В связи с этим необходимы дальнейшие исследования c целью верификации групп пациентов, которые могли бы претендовать на благоприятные показатели своей онкологической безопасности, ожидаемые от оперативного вмешательства.
ЛИТЕРАТУРА
- Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава России; 2017.
- Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хирургия рака предстательной железы. М.: ГЭОТАРМедиа; 2006.
- Клиническая онкоурология. Под ред. Матвеева Б.П. М.; 2011.
- Walsh PC, Lepor H, Eggleston JC. Radical prostatectomy with preservation of sexual funcƟ on: Anatomical and pathological consideraƟ ons. Prostate. 1983;4(5):473-85.
- Mullins JK, Feng Z, Trock BJ, Epstein JI, Walsh PC, Loeb S. The impact of anatomical radical retropubic prostatectomy on cancer control: the 30-year anniversary. J Urol. 2012;188(6):2219-24. doi: 10.1016/j.juro.2012.08.028
- Alemozaff ar M, Sanda M, Yecies D, Mucci LA, Stampfer MJ, Kenfi eld SA. Benchmarks for operative outcomes of roboti c and open radical prostatectomy: results from the Health Professionals Follow-up Study. Eur Urol. 2015;67(3):432-8. doi: 10.1016/j.eururo.2014.01.039
- Hu JC, Gandaglia G, Karakiewicz PI, Nguyen PL, Trinh QD, Shih YC, Abdollah F, Chamie K, Wright JL, Ganz PA, Sun M. Comparatie effectiveness of robot-assisted versus open radical prostatectomy cancer control. Eur Urol. 2014;66(4):666-72. doi: 10.1016/j.eururo.2014.02.015
- Клинические рекомендации Европейской ассоциации урологов, 2016. М.; 2016.
- Myers RP, Goellner JR, Cahill DR. Prostate shape, external striated urethral sphincter and radical prostatectomy: the apical dissecƟ on. J Urol. 1987;138(3):543-50.
- Dubbelman Y, Wildhagen M, Schröder F, Bangma C, Dohle G. Orgasmic dysfuncƟ on after open radical prostatectomy: clinical correlates and prognosƟ c factors. J Sex Med. 2010;7(3):1216-23. doi: 10.1111/j.1743- 6109.2009.01567.x
- Han M, ParƟ n AW, Pound CR, Epstein JI, Walsh PC. Longterm biochemical disease-free and cancer-specifi c survival following anatomic radical retropubic prostatectomy. The 15-year Johns Hopkins experience. Urol Clin North Am. 2001;28(3):555-65.
- Roehl KA, Han M, Ramos CG, Antenor JA, Catalona WJ. Cancer progression and survival rates following anatomical radical retropubic prostatectomy in 3,478 consecuƟ ve paƟ ents:long-term results. J Urol. 2004;172(3):910- 4. doi: 10.1097/01.ju.0000134888.22332.bb
Статья опубликована в журнале "Вестник урологии" №1 2018, стр. 81-93










Комментарии