С.В. Шкодкин1,2, Ю.Б. Идашкин1 , В.В. Фентисов2 , А.В. Любушкин2 , А.А. Невский2
1 ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа»; Белгород, Россия
2 ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»; Белгород, Россия
Введение
В урологической практике с целью восстановления пассажа мочи из верхних мочевых путей рутинно используются наружное долговременное (нефростомия, пиелостомия) и внутреннее (установка в мочеточник самоудерживающегося катетера-стента) дренирование [1-4]. В настоящее время отсутствуют общепризнанные показания для выбора методики дренирования верхних мочевых путей при обструктивной уропатии [1, 5]. Как наружное, так и внутреннее дренирования сопряжены с рядом недостатков, влияющих на качество жизни пациента [1, 3, 4]. Как правило, выбор способа восстановления пассажа мочи остается на усмотрение врача [1]. Внутреннее дренирование в виду меньшей инвазивности процедуры гораздо чаще используется практикующими урологами [5-7].
К числу достоинств последнего можно отнести относительную простоту установки и удаления внутреннего стента (как эндоскопически, так и интраоперационно), необязательность рентгенологического или ультразвукового контроля, отсутствие наружного дренажа. Это улучшает качество жизни и снижает риск дренажной нозокомиальной инфекции. Поэтому внутреннее дренирование используется более широко и рекомендуется многими экспертами после эндоурологических манипуляций (нефро- и уретеролитотрипсия, эндоуретеро- и пиелотомия) на верхних мочевых путях при выполнении реконструктивно-пластических операций на мочеточнике и лоханочно-мочеточниковом сегменте, радикальной хирургии мышечно-инвазивного рака мочевого пузыря [1, 3, 5, 8-9]. В то же время имеются и слабые стороны данного способа восстановления пассажа мочи, а именно невозможность эндоскопической установки и удаления стентов в ряде случаев обструкции уретры и патологии пузырно-уретрального сегмента (стриктуры, опухоли и камни уретры, доброкачественная гиперплазия и рак простаты, склероз и рак шейки мочевого пузыря), миграция стента и неадекватное его позиционирование при установке без рентгенологического контроля, обструкция стента воспалительным детритом, солями, сгустками крови вследствие анатомических ограничений по используемому диаметру и больших соотношений длина/диаметр, ограниченность сроков внутреннего дренирования, что требует удаления или замены стента, формирование пузырно-мочеточникового рефлюкса с развитием рефлюкс-нефропатии и восходящей инфекции, нарушения моторики и микроциркуляции в стентированном мочеточнике, ведущие к склеротическим изменениям в его стенке даже на фоне непродолжительного дренирования [10-13].
Напротив, к недостаткам пункционной нефростомии, кроме самого наружного дренажа, следует отнести риск кровотечения во время создания доступа к почке, необходимость использования ультразвукового и/или рентгенологического контроля, повышенные риски контаминации нозокомиальной микрофлорой [9, 14].
Несомненными достоинствами данного способа являются короткий дренажный канал, возможность установки дренажа адекватного диаметра, проведение процедуры вне зависимости от уровня и причины суправезикальной обструкции или нарушений проходимости пузырно-уретрального сегмента [2, 7].
Цель исследования. Оценить эффективность внутреннего стентирования (ВС) и пункционной нефростомии (ПН) как способов временного дренирования верхних мочевых путей при остром обструктивном пиелонефрите.
Материалы и методы
В течение 2012-2017 гг. нами наблюдались 156 пациентов обоего пола в возрасте от 25 до 74 лет с клиникой острого обструктивного пиелонефрита на фоне мочекаменной болезни, на предоперационном этапе у которых не выявлено гнойно-деструктивного поражения почки, и с целью восстановления пассажа мочи выполнены ВС либо ПН. В первую группу исследования включены 125 пациентов, которым выполнена ПН, во вторую соответственно вошел 31 пациент, которым произведено ВС мочеточниковым jjстентом. Обе группы были сопоставимы по полу, возрасту и времени нахождения в стационаре до дренирования почки, сторона поражения не влияла на выбор методики деривации мочи (табл. 1).
Таблица 1. Характеристика групп наблюдения
| Группа наблюдения | Возраст, годы | Пол, муж/жен | Сторона поражения, права/левая | Предоперационный период, час |
| Первая группа, Group I (n=125) | 50,6±13,8 | 56/44 | 44/56 | 2,1±1,3 |
| Вторая группа, Group II (n=31) | 43,2±18,3 | 53,8/45,2 | 48,4/51,6 | 3,6±1,4 |
В первой группе достоверно больше был предоперационный лихорадочный период и лейкоцитоз: 5,5±1,3 суток и 18,1±2,8х109/л, тогда как во второй аналогичные показатели составили 2,1±1,4 суток и 9,5±3,1х109/л соответственно (р<0,05), объем почки и толщина паренхимы на стороне поражения при этом статистически не отличались в обеих группах наблюдения (рис. 1). ПН выполняли под местной инфильтрационной анестезией с комбинированным ультразвуковым и рентгенологическим контролем, ВС — с инстилляцией люмбриканта в уретру и рентгенологическим контролем. В обеих группах за полчаса до начала процедуры дренирования осуществляли атаралгезию (промедол 2%-1,0 и реланиум 0,5%- 2,0 внутримышечно). В послеоперационном периоде наряду с оценкой клинических проявлений на 1-е, 5-е и 10-е сутки проводили лабораторный, бактериологический и ультразвуковой контроль.
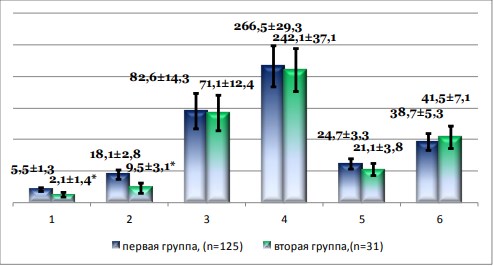
Рисунок 1. Исходные клинико-лабораторные данные. 1 – лихорадочный период, сутки; 2 – лейкоцитоз, 109/л; 3 – относительный нейтрофилез, %; 4 – объем почки, см3 ; 5 – толщина паренхимы, мм; 6 – передне-задний размер лоханки, мм.
* - различия статистически достоверны, р<0,05.
Полученные в результате исследования данные обработаны с помощью программного обеспечения Statistica 6.0 на операционной платформе Windows XP. При анализе данных совокупности рассчитаны средние показатели (средняя арифметическая (хср); медиана (Ме); мода (Мо)), абсолютные показатели вариации (размах вариации (R); среднее линейное отклонение (dср); дисперсия (σ2); среднее квадратичное отклонение (σ). Исследуемые показатели, имеющие нормальное распределение, приведены в их среднем значении со средней квадратичной ошибкой: М±σ. Для установления статистической достоверности различий в показателях основной и контрольной групп рассчитана вероятность по распределению Стьюдента. При вероятности меньшей 0,05 различия считалась статистически достоверными.
Результаты
Причин отказа от проведения ПН, а также травматических осложнений со стороны дренируемой почки в первой группе отмечено не было. Умеренная макрогематурия по дренажу, не требовавшая гемотрансфузии и трансфузии плазмы, имела место у 47 (37,6%) больных и была купирована консервативной гемостатической терапией на 2,2±0,5 сутки. В первую группу включены 4 (16%) пациента с конкрементами юкставезикального отдела мочеточника, которым не удалось провести ВС. Диаметр устанавливаемого дренажа определялся клинической ситуацией и размерами полостной системы почки. Были использованы j-нефростомы 12 и 14 Ch, а при наличии гнойной мочи с детритом катетеры Нелатона 16-22 Ch, средний диаметр установленной нефростомы составил 17,4±3,2 Ch. На следующие сутки на фоне нарастающей интоксикации оперирован 1 (0,8%) пациент первой группы. При ревизии почки были выявлены множественные апостемы и карбункулы, учитывая тяжесть синдрома системной воспалительной реакции, возраст пациента 74 года и сохранность конралатеральной почки, выполнена нефрэктомия.
Как уже упоминалось выше, во вторую группу не были включены 4 пациента, которым не удалось выполнить ВС. Для дренирования использованы jj-стенты 6 и 8 Сh, что в среднем составило 6,26±0,68 Ch. Макрогематурия, обусловленная пузырным концом стента, в этой группе отмечена на 2,7±1,8 сутки после стентирования у 13 (41,9%) пациентов и зачастую имела место на протяжении всего периода наблюдения, что составило 6,8±2,5 суток. Данное осложнение потребовало проведения гемостатической и аналгетической терапии, а также назначения альфа-адреноблокаторов, что, однако, не сопровождалось значимым клиническим эффектом. Макрогематурия и отрицательная клинико-лабораторная динамика, проявившаяся в прогрессировании пиелонефрита, стали причиной открытой ревизии почки у 5 (16,1%) пациентов. Кроме того, неадекватная работа стента (ретенционные изменения чашечно-лоханочной системы при пустом мочевом пузыре по УЗИ), послужила причиной перехода на ПН еще у 6 (19,4%) пациентов. Таким образом, 10 дневный период дренирования прослежен у 124 (99,2%) пациентов первой и 20 (64,5%) пациентов второй групп (табл. 2).
Таблица 2. Осложнения способов дренирования почки
| Группа наблюдения | Первая группа | Вторая группа |
| Число пациентов, включенных в исследование | 125 | 31 |
| Невозможность проведения дренирующей процедуры, абс./% | 0 / 0 | 4 / 11,4* |
| Прогрессия пиелонефрита, абс./% | 1 / 0,8 | 11 / 35,5* |
| Необходимость открытой ревизии почки, абс./% | 1 / 0,8 | 5 / 16,1* |
| Частота макрогематурии, абс./% | 47 / 37,6 | 13 / 41,9 |
| Длительность макрогематурии, сутки | 2,2±0,5 | 6,8±2,5* |
| Ирритативная симптоматика, абс./% | 0 / 0 | 18 / 58,1* |
| Клиника ПМР, абс./% | 0 / 0 | 9 / 29,0* |
| Длительность лихорадки, сутки | 1,8±0,5 | 5,5±2,8* |
| Число пациентов, оставшихся в исследовании, абс./% | 124 / 99,2 | 20 / 64,5* |
Примечания: * – различия статистически достоверны, р<0,05
Comments: * – the differences are statistically significant, p <0.05
В наших наблюдениях не отмечено случаев миграции нефростомических дренажей и внутренних стентов. Адекватность их дренажной функции оценена на основании УЗИ, а при необходимости контроля позиционирования выполняли обзорную урографию.
Клинически лихорадка в I группе купирована на 1,8±0,5 сутки, а во II группе данный показатель составил 5,5±2,8 (р<0,05) (табл. 2). Во второй группе наблюдения 18 (58,1%) пациентов предъявляли жалобы на ирритативную симптоматику различной степени выраженности. У 9 (29,0%) больных отмечен болевой синдром в пояснице, связанный с микцией. Подобных осложнений в первой группе наблюдения отмечено не было.
Таблица 3. Микробиологический спектр возбудителей острого обструктивного пиелонефрита
| Группа наблюдения | Первая группа, Group I (n=124) |
Вторая группа, Group II (n=20) |
||
| Количество посевов | 372 | 60 | ||
| Количество штаммов | 417 | 73 | ||
| абс. | % | абс. | % | |
| Бактериальные ассоциации | 45 | 12,1 | 10 | 16,7 |
| Полирезистентность | 286 | 68,5 | 53 | 72,6 |
| Escherichia coli | 145 | 34,8 | 24 | 32,9 |
| Klebsiella spp. | 79 | 18,9 | 12 | 16,4 |
| Enterococcus faecalis | 71 | 17 | 15 | 20,5 |
| Pseudomonas spp | 37 | 8,9 | 9 | 12,3 |
| Proteus spp. | 51 | 12,2 | 6 | 8,2 |
| S. aureus | 21 | 5 | 3 | 4,1 |
| Enterobacter spp. | 8 | 1,9 | 2 | 2,7 |
| Прочие / Other | 5 | 1,2 | 2 | 2,7 |
Лабораторный контроль в I группе наблюдения выявил достоверное снижение нейтрофильного лейкоцитоза палочко-ядерного сдвига с пятых суток наблюдения относительно исходных показателей (рис. 2).
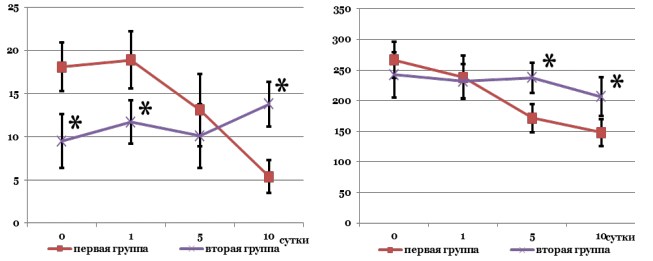
Рисунок 2. Лабораторно-инструментальная динамика острого обструктивного пиелонефрита: а – динамика лейкоцитоза; b – динамика объема почки
Во II группе больных подобной тенденции не отмечено, зарегистрирован статистически незначимый рост лейкоцитоза на пятые и десятые сутки. К концу периода наблюдения уровень лейкоцитов в крови больных первой группы был достоверно ниже группы сравнения (р<0,05). Показатели лабораторного исследования мочи не имели статистически достоверных различий в группах на данном сроке наблюдения.
Ультразвуковой мониторинг I группы выявил статистически достоверную динамику снижения объема почки относительно исходных значений, при этом объем почки в группе сравнения статистически не изменился (рис. 2), что привело к достоверным различиям по этому показателю к концу периода наблюдения (р0,05). Во II группе отмечены ультразвуковые признаки пузырно-мочеточникового рефлюкса: передне-задний размер лоханки при наполненном мочевом пузыре составил 37,1±5,8 мм (р<0,05).
Обсуждение
При соблюдении адекватной техники пункции почки и использовании комбинированного (ультразвукового и рентгенологического) контроля проведение ПН является безопасным способом дренирования почки при остром обструктивном пиелонефрите, обеспечивающем постановку дренажа адекватного диаметра, что позволяет получить лучшие результаты по купированию пиелонефрита в сравнении с группой ВС. Внутренний стент не обеспечил адекватного дренажа у 11 (32,4%) пациентов второй группы, которым пришлось прибегнуть к дополнительным хирургическим пособиям. Но и в оставшейся когорте пациентов отмечены ультразвуковые признали уростаза, связанные как с малым диаметром дренажа, так и с пузырно-мочеточниковым рефлюксом. Это и послужило причиной длительной персистенции воспалительных изменений, проявившихся системным лейкоцитозом и длительным сохранением увеличения объема пораженной почки в этой группе наблюдения. В первой группе наблюдения не отмечено ирритативной симптоматики и торпидной гематурии, что обеспечило лучшую переносимость пациентами наружного дренажа.
Обращает на себя внимание высокая степень бактериальной обсемененности и частота выявления антибиотикорезистентной микрофлоры. Последнее связано с тем, что в исследовании участвовало 53,6% пациентов уже ранее оперированных на мочевых путях и полученные нами результаты не противоречат литературным данным. Высокая степень бактериурии, полученная в первой группе, обусловлена как исходными лабораторно подтверждёнными более выраженными воспалительными изменениями, так и с направляемым на исследование материалом. Т.е., при ПН на бактериологическое исследование отправлялась моча, полученная при пункции полостной системы пораженного органа, тогда как после ВС забирался смыв из мочевого пузыря, где содержалась, в том числе моча, из контралатеральной почки и остатки ирригационной жидкости. Увеличение числа резистентной флоры за короткий временной интервал обусловлено селекцией штаммов с уже имеющейся антибиотикорезистентностью. Наличие инфицированных конкрементов и дренажей, скорее всего, послужило причиной персистенции бактериурии даже при отсутствии клинических проявлений пиелонефрита.
Выводы
- Пункционная нефростомия обеспечивает более эффективное и безопасное дренирование почки у пациентов с острым обструктивным пиелонефритом.
- Временное использование наружного дренажа ассоциируется с лучшими показателями качества жизни по сравнению с внутренним стентом.
- Применение внутреннего стента при остром обструктивном пиелонефрите пролонгирует воспалительные изменения в почке и в 32,4% случаев потребует дополнительных вмешательств в сравнении с пункционной нефростомией.
- Несмотря на проведение антибактериальной терапии оба способа дренирования не способствует элиминации возбудителей в течение 10 суток острого обструктивного пиелонефрита.
Литература
- Дорончук Д.Н., Трапезникова М.Ф., Дутов В.В. Выбор метода дренирования верхних мочевых путей при мочекаменной болезни. Урология. 2010;3:7-10.
- Auge BK, Sarvis JA, L’Esperance JO, Preminger G. Practice patterns of ureteral stenting after routine ureteroscopic stone surgery: A survey of practicing urologists. J. Endourol. 2007;21(11):1287-1291. doi: 10.1089/ end.2007.0038
- Preminger GM, Tiselius HG, Assimos DG et al. EAU/AUA Nephrolithiasis Guideline Panel. 2007.
- Аляев Ю.Г., Рапопорт Л.М., Цариченко Д.Г., Стойлов С.В., Бушуев В.О. Стентирование почек при уретерогидронефрозе у больных гиперплазией простаты больших размеров. Андрол. и генитал. хир. 2008;3:43-44.
- Трапезникова М.Ф., Дутов В.В., Базаев В.В., Дорончук Д.Н. К вопросу о необходимости стентирования верхних мочевых путей после неосложненной контактной уретеролитотрипсии. Материалы Первого Российского конгресса по эндоурологии (Москва, 4-6 июня 2008). М., 2008:257-258.
- Аляев Ю.Г., Руденко В.И., Газимиев М.А. и др. Виды стентирования мочеточника после контактной уретеролитотрипсии. Материалы Первого Российского конгресса по эндоурологии (Москва, 4-6 июня 2008). М., 2008:126-127.
- Chew BH, Knudsen BE, NottL, Pautler SE, Razvi H, Amann J, Denstedt JD. Pilot study of ureteral movement in stented patients: First step in understanding dynamic ureteral anatomy to improve stent discomfort. J. Endourol. 2007;21(9):1069-1075. doi: 10.1089/end.2006.0252
- Гулиев Б.Г. Реконструктивные операции при органической обструкции верхних мочевыводящих путей: Дис.... д-ра мед. наук. - СПб., 2008.
- Коган М. И., Шкодкин С. В., Идашкин Ю.Б., Любушкин А. В., Мирошниченко О. В. Оценка эффективности различных способов дренирования почки. Медицинский Вестник Башкортостана. 2013;2:82-85.
- Новикова Е.Г., Теплов А.А., Смирнова С.В., Онопко В.Ф., Русаков И.Г. Стриктуры мочеточников у больных раком шейки матки. Российский онкологический журнал. 2009;3:28-34.
- Мудрая И.С. Функциональные состояния верхних мочевых путей при урологических заболеваниях: Дис.... д-ра мед. наук. -М., 2002.
- Чепуров А.К., Зенков С.С., Мамаев И.Э., Пронкин Е.А. Влияние длительного дренирования верхних мочевых путей мочеточниковыми стентами на функциональные способности почки. Андрология и генитальная хирургия. 2009;172-1721.
- Дорончук Д.Н., Трапезникова М.Ф., Дутов В.В. Оценка качества жизни больных мочекаменной болезнью в зависимости от метода дренирования верхних мочевыводящих путей. Урология. 2010;2:14.
- Чепуров А.К., Зенков С.С., Мамаев И.Э., Пронкин Е.А. Роль инфицирования верхних мочевых путей у больных с длительным дренированием мочеточниковыми стентами. Андрология и генитальная хирургия. 2009;173-173.
Статья опубликована в журнале "Вестник урологии" №1 2018, стр. 27-34












Комментарии