А.О. Монакова, Г.Д. Сагарадзе, А.Ю. Ефименко
Институт регенеративной медицины Медицинского научно-образовательного центра МГУ им. М.В. Ломоносова, Москва
Проблема поиска эффективных подходов при реконструктивной пластике органов мочеполовой системы и лечении таких серьезных заболеваний, как идиопатические формы мужского бесплодия, по-прежнему остается актуальной, несмотря на существующие оперативные и лекарственные методы лечения. Все эти нарушения в значительной степени связаны с нарушениями процессов репарации и регенерации тканей после повреждения. Поэтому новые перспективные решения таких клинических задач может предложить регенеративная медицина, методы которой в последних исследованиях продемонстрировали свою эффективность и безопасность на экспериментальных моделях. В статье рассмотрена возможность применения клеточной и бесклеточной терапии на основе мезенхимных стромальных клеток для восстановления сперматогенеза и создания тканеинженерных конструкций для реконструктивной хирургии в урологии.
Введение
Регенеративная биомедицина представляет собой принципиально новую область медицины, целью которой является выращивание утраченных, поврежденных или несформировавшихся органов и тканей. Разрабатываются и уже внедряются в клиническую практику подходы, основанные на трансплантации отдельных клеток или созданных вне организма конструкций, способных замещать поврежденные ткани. Одним из наиболее эффективных и физиологичных способов восстановления структуры и функции органов и тканей является активация эндогенных механизмов регенерации. Методы регенеративной медицины продемонстрировали свою эффективность и безопасность во многих клинических задачах, поэтому спектр их применения интенсивно расширяется.
В урологии регенеративная медицина находит широкое применение, однако противоречивые результаты клинических исследований свидетельствуют о наличии нерешенных методических и клинических задач. Например, для реконструктивной хирургии в урологии показано успешное применение тканеинженерных конструкций, замещающих дефекты стенки мочевыводящих путей, в частности мочевого пузыря (МП), созданных на основе коллагена и полигликолевой кислоты и заселенных аутологичными уротелиальными и мышечными клетками. Однако попытки развить данный подход посредством использования других типов клеток или матриксов продемонстрировали низкую эффективность, а также серьезные побочные эффекты [1].
С другой стороны, в андрологии, например для лечения пациентов с таким актуальным заболеванием, как идиопатическое мужское бесплодие, также активно используют подходы регенеративной медицины. В частности, активно ведутся работы по получению клеток сперматогенного эпителия из индуцированных плюрипотентных стволовых клеток, применяются технологии редактирования генома для коррекции генетических нарушений, препятствующих оплодотворению, развиваются методы культивирования и аутотрансплантации половых клеток. Однако перечисленные подходы в настоящее время не могут быть применены в клинике ввиду этических ограничений, а также различных рисков, связанных с введением в организм культур низкодифференцированных стволовых клеток [2].
В связи с этим внимание исследователей смещается в сторону более этически и клинически приемлемых инструментов, включая использование мультипотентных стволовых клеток взрослого организма, среди которых одними из наиболее изученных являются мезенхимные стромальные клетки (МСК), а также развитие подходов «клеточной терапии без клеток», основанных на применении компонентов, секретируемых стволовыми клетками и опосредующих их эффекты вместо самих клеток. В данной статье будут рассмотрены последние достижения регенеративной медицины в области разработки новых подходов к терапии больных идиопатическим мужским бесплодием и реконструктивной хирургии в урологии на основе использования МСК и «клеточной терапии без клеток».
Применение подходов регенеративной медицины для лечения больных идиопатическим мужским бесплодием
Мужское бесплодие является распространенной проблемой. Согласно статистике ВОЗ, 17% семейных пар бесплодны. Около 50% всех случаев бесплодия пар связаны с мужским бесплодием, ко торое зачастую является идиопатическим и для лечения которого наиболее часто используют эмпирическую фармакотерапию или оперативные методы. Однако эти методы малоэффективны и могут сопровождаться серьезными побочными эффектами. Среди активно исследуемых в настоящее время подходов к лечению пациентов с мужским бесплодием с помощью регенеративной медицины стоит отметить клеточную терапию. В различных животных моделях были рассмотрены варианты аутогенной трансплантации сперматогониальных стволовых клеток (ССК). У людей криоконсервация и последующее введение спермы рассматривается как возможная терапия для взрослых онкологических больных, которые планируют проходить лечение, влияющее на фертильность [3]. Однако данная терапия может быть неэффективна, поскольку для адекватного функционирования ССК необходимо специфическое микроокружение, состоящее из поддерживающих клеток (клеток Лейдига, клеток Сертоли, макрофагов и миоидных перитубулярных клеток) и комплекса взаимодействий между ними, называемое нишей [4]. При повреждении компонентов ниши нарушается функционирование ССК и промежуточных дифферонов, что приводит к нарушению сперматогенеза в целом. Поэтому трансплантация ССК, скорее всего, будет иметь ограниченное применение в клинической практике. Следовательно, может быть целесообразно рассмотреть подходы, комплексно влияющие на нишу ССК.
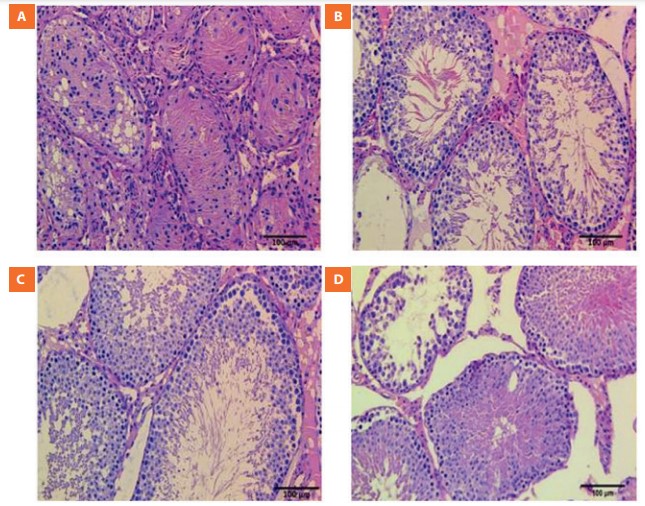
Рис. 1. Гистологическая картина срезов семенников крыс, у которых были смоделированы нарушения сперматогенеза с помощью двустороннего абдоминального крипторхизма
А – группа без терапии, B – группа с терапией секретомом МСК, С – интактная группа, D – группа с терапией МСК. Окрашивание гематоксилином-эозином. Видно, что локальное введение секретома МСК снижает число атрофичных семенных канальцев, способствует восстановлению морфологии канальцев и сперматогенного эпителия.
Перспективным инструментом для восстановления микроокружения стволовых клеток, включая ССК, могут являться МСК. Так, эффекты МСК могут являться ключевыми для поддержания функций ниши стволовых клеток. Предположительно большинство эффектов МСК реализуется за счет паракринной функции: секреции, по крайней мере, специфических факторов роста, цитокинов и внеклеточных везикул, переносящих биоактивные белки, липиды, кодирующие и регуляторные РНК. В частности, в наших работах, которые были проведены на базе Медицинского научно-образовательного центра (рук. – акад. А.А. Камалов) и факультета фундаментальной медицины (рук. – акад. В.А. Ткачук) МГУ им. М.В. Ломоносова, было показано, что локальное введение как самих МСК, так и компонентов их секретома способствует восстановлению сперматогенеза на модели двухстороннего абдоминального крипторхизма у крыс, используемого как модель идиопатического мужского бесплодия (рис. 1). Более того, фертильность крыс-самцов также восстанавливалась в данной модели, что подтверждалось увеличением числа беременных самок по сравнению с контрольной группой (рис. 2) [5, 6].
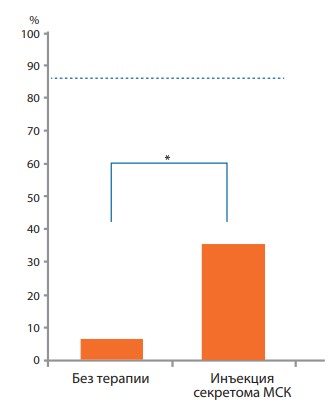
Рис. 2. Доля (%) беременных самок после ссаживания с самцами, у которых были смоделированы нарушения сперматогенеза с помощью двустороннего абдоминального крипторхизма
На рисунке представлены результаты эксперимента с включением группы нелеченых животных (16 крыс), группы, в которой самцам проводили инъекцию секретома МСК (17 крыс), и группа интактных животных (14 крыс), показанная пунктирной линией
Применение подходов регенеративной медицины для реконструктивной пластики в урологии
Восстановление функции мочевыводящих путей, в частности МП, при серьезных повреждениях, хирургических операциях или в случае нарушения развития этих органов является актуальной проблемой в области урологии. Так, обширная резекция МП при его злокачественных заболеваниях, высокое внутрипузырное давление при нейрогенном МП, миелодисплазия, интерстициальный цистит могут приводить к потере способности МП к адекватному растяжению и нарушению его эластичности. В настоящее время для решения данной проблемы используется расширяющая цистопластика, при которой для увеличения емкости используются различные отделы желудочно-кишечного тракта. Однако такие операции очень травматичны и имеют высокий риск развития различных осложнений [7].
Использование методов регенеративной медицины позволяет предложить новые эффективные способы решения этих проблем. Так, активно исследуется применение биологических, децеллюляризированных или синтетических каркасов для ремоделирования МП. В связи с тем, что стенка МП подвергается постоянному растяжению, слабая механическая прочность материалов может препятствовать их клиническому применению. Поэтому среди испытуемых биологических материалов оказались такие, как коллаген, эластин, фибрин, хитозан и желатин. При этом эффективность в исследованиях in vivo показали насыщенные коллагеном децеллюляризованные каркасы, а также сам коллаген, выделенный из тканей животных [7]. В настоящее время коллаген считается одним из наиболее перспективных материалов временного направляющего каркаса для регенерации за счет постепенного замещения собственными тканями организма в отличие от синтетических полимерных материалов, используемых в реконструктивной хирургии [8]. Среди достоинств коллагена следует также отметить низкую иммуногенность, высокую механическую прочность, устойчивость к тканевым ферментам, регулируемую скорость лизиса в организме, способность образовывать комплексы с биологически активными веществами и стимуляцию регенерации собственных тканей организма.
Однако возможность использования пустого биополимерного или синтетического каркаса определяется площадью повреждения. Так, при ремоделировании небольшой площади введение бесклеточного каркаса приводит к миграции клеток из неповрежденной области с последующим восстановлением целостности ткани. Однако при необходимости обширной реконструктивной операции более эффективным может быть применение тканеинженерных конструкций, заселенных клетками. В связи с этим активно исследуют как использование клеток мочевого пузыря, так и создание их пула из других типов клеток. В частности, in vitro было показано, что при сокультивации клеток уротелия с фетальными, амниотическими или плюрипотентными стволовыми клетками возрастает экспрессия уроплакина, являющегося маркером дифференцировки в уротелиальные клетки. In vivo на собаках при трансплантации засеянного клетками каркаса наблюдали улучшение регенерации уротелия и мышечного слоя МП по сравнению с бесклеточным каркасом [7]. Однако на данный момент существуют ограничения для применения плюрипотентных клеток в клинической практике по причине высокого риска их перерождения в раковые клетки.
Недостатки, характерные для клеточной терапии, отсутствуют у подходов регенеративной медицины, основанных на использовании продуктов секреции клеток. В частности, в наших работах была исследована возможность применения для замещения дефекта стенки МП у кроликов конструкции на основе коллагена 1 типа, комбинированного с секретомом МСК. Для оценки эффективности данной конструкции животным выполняли цистопластику с использованием мембраны из коллагена, мембраны из коллагена с секретомом МСК или ушивали дефект без цистопластики. Функциональные исследования показали, что только в группе, в которой использовали коллагеновую мембрану, содержающую компоненты секретома МСК, емкость МП приближалась к норме, в то время как в остальных группах емкость оставалась сниженной. Аналогично, цистопластика с помощью мембраны с секретомом МСК приводила к более интенсивной васкуляризации зоны трансплантации по сравнению с другими группами [9]. Другие исследования показали эффективность обработки бесклеточного каркаса МП отдельными факторами роста (например, фактором роста эндотелия сосудов – VEGF, и фактором роста, полученным из тромбоцитов – PDGF), что дополнительно подтверждает возможность использования «клеточной терапии без клеток» [7].
Заключение
Таким образом, применение методов регенеративной медицины в урологии и андрологии активно развивается. Внимание исследователей сдвигается в сторону более этически приемлемых, безопасных и масштабируемых подходов, направленных на активацию процессов эндогенной регенерации в тканях после повреждения. В частности, активно развивается не только клеточная терапия, но и бесклеточная терапия с использованием секретома клеток, а также включение его в состав тканеинженерных конструкций для реконструктивной пластики в урологии. Учитывая продемонстрированную в доклинических исследованиях безопасность и эффективность применения отдельных методов регенеративной медицины, в ближайшем будущем ожидается выход экспериментальных терапевтических подходов в клинические исследования.
ЛИТЕРАТУРА
- Harris K., Bivalacqua T.J. Regenerative medicine in urology: the future of urinary reconstruction. Trends Urol. Men’s Heal. 2020;11(2):9–12.
- Agarwal A., Baskaran S., Parekh N., et al. Male infertility. Lancet. Elsevier Ltd. 2021;397(10271):319–33.
- De Michele F., Vermeulen M., Wyns C. Fertility restoration with spermatogonial stem cells. Curr. Opin. Endocrinol. Diab. Obes. 2017;24(6):424–31.
- De Rooij D.G. The spermatogonial stem cell niche. Microsc. Res. Tech. United States. 2009;72(8):580–5.
- Sagaradze G.D., Basalova N., Kirpatovsky V., et al. A magic kick for regeneration: Role of mesenchymal stromal cell secretome in spermatogonial stem cell niche recovery. Stem. Cell Res. Ther. 2019;10(1):1–10.
- Sagaradze G.D., Basalova N.A., Kirpatovsky V.I., et al. Application of rat cryptorchidism model for the evaluation of mesenchymal stromal cell secretome regenerative potential. Biomed. Pharmacother. 2019;109:1428–36.
- Chan Y.Y., Sandlin S.K., Kurzrock E.A., et al. The current use of stem cells in bladder tissue regeneration and bioengineering. Biomed. 2017;5(1):1–13.
- Кирпатовский В.И., Ефименко А.Ю., Сысоева В.Ю. и др. Использование мембраны из коллагена 1-го типа для замещения стенки мочевого пузыря. Бюллетень экспериментальной биологии и медицины. 2016;7:117–22.
- Кирпатовcкий В.И., Камалов Д.М., Ефименко А.Ю. и др. Заместительная пластика мочевого пузыря с использованием комбинированной мембраны на основе продуктов секреции мезенхимных стволовых клеток человека и коллагена I типа. Урология. 2016;6:34–42.














Комментарии