Комяков Б.К., Гулиев Б.Г.
Северо-Западный государственный медицинский университет имени И.И. Мечникова
191015, Россия, г. Санкт-Петербург, ул. Кирочная, д.41, тел: (812)3035000
Эл.почта: komyakovbk@mail.ru, gulievbg@mail.ru
Введение. Замещение мочеточника сегментом тонкой кишки остается сложным и редким хирургическим вмешательством. Показаниями к данной операции являются протяженные послеоперационные, туберкулезные и постлучевые стриктуры верхних мочевых путей (ВМП), опухоли мочеточника, последствия его повреждений при эндоскопических операциях и болезнь Ормонда [1 – 6]. Широкое внедрение малоинвазивной хирургии позволило использовать лапароскопический доступ при кишечной пластике мочеточника. В 2000 году Gill I. et al. [7] сообщили о первой произведенной ими лапароскопической илеоуретеропластике. Однако количество подобных операций, выполненных за последние полтора десятилетия, остается невысоким, и лишь некоторые авторы приводят результаты нескольких оперированных таким образом больных [8 – 12]. В литературе также появились единичные сообщения о роботассистированном тонкокишечном замещении мочеточника [9, 13, 14]. Лапароскопическая кишечная пластика мочеточника требует от уролога достаточного опыта в эндовидеохирургии, позволяющем произвести сложную реконструктивную операцию на ВМП. В настоящее время мы располагаем опытом 7 таких операций.
Материалы и методы. С 2001 года в нашей клинике тонкокишечная пластика мочеточника выполнена 77 больным [15]. В исследование были включены результаты кишечной пластики мочеточника у 17 больных. Из них 10 были оперированы открытым и 7 лапароскопическим доступом. В таблицах 1 и 2 приведены сведения о больных, показания к операции, их результаты, состояние функции почки и метаболические изменения до и после кишечной уретеропластики.
Таблица 1 Сведения о больных, которым выполнена лапароскопическая кишечная пластика мочеточника
| № - пол - возраст | Предыдущие операции и заболевания, приведшие к стриктуре | Сторона операции | Пре- и послеоперационные изменения уровня креатинина, бикарбонатов и Сl | ||
| Креатинин (мкмоль/л) | Бикарбонаты (ммоль/л) | Хлориды (ммоль/л) | |||
| 1. – М – 66 | Рак предстательной железы. Интраоперационное повреждение мочеточника. ЧПНС слева | слева | 105 / 110 | 26 / 28 | 99 / 100 |
| 2. – Ж – 69 | Аномалия развития МВС. Полное удвоение левой почки. Обструктивный мегауретер удвоенных мочеточников | слева | 96 /100 | 21 / 22 | 111 / 107 |
| 3. – Ж – 45 | Стриктура тазового отдела мочеточника после неоднократных уретеролитотрипсий | слева | 78 / 85 | 28 / 26 | 100 / 108 |
| 4. – Ж – 57 | Лап. гистерэктомия. Ятрогенная травма мочеточника, мочеточникововлагалищный свищ | справа | 68 / 76 | 24 / 22 | 105 / 106 |
| 5. – М – 59 | Послеоперационная рецидивная стриктура тазового отдела левого мочеточника. Открытая уретеролитотомия. Операция Боари. ЧПНС. Мочеточниково-кожный свищ. | слева | 88 / 85 | 28 / 25 | 109 / 106 |
| 6. – М – 47 | Протяженная рецидивная стриктура правого мочеточника. Открытая уретеролитотомия. Прямой УЦА справа. Операция Боари.ЧПНС. | справа | 120 / 110 | 31 / 26 | 107 / 107 |
| 7. – М – 45 | Нейромышечная дисплазия правого мочеточника. Пузырно-лоханочный рефлюкс. | справа | 80 / 82 | 25 / 23 | 103 / 100 |
Все этапы операции лапароскопической илеоуретеропластики были выполнены интракорпорально. В начале пациента укладывали в положение на боку для операций на верхних отделах мочевых путей, а затем – в положение на спине для формирования кишечно-пузырного анастомоза. Репозиция больного не требуется в тех случаях, когда диссекция мочевого пузыря (МП) и анастомозирование с ним кишки осуществимы в положении на боку. Особенности операции зависят от протяженности дефекта мочеточника. При высоких стриктурах мочеточника и его полном отрыве приходится выполнять анастомоз кишечного сегмента с лоханкой, а в остальных случаях с центральным концом мочеточника. После установки портов мобилизовали толстую кишку и отводили ее медиально, выделяли здоровый проксимальный участок мочеточника или лоханку. Далее резецировали необходимой длины сегмент тонкой кишки, межкишечный анастомоз выполняли с использованием лапароскопического сшивающего аппарата Eshelon 60. Обычно для этого использовали две кассеты 60 мм. Первой из них продольно прошивали сложенные вместе концы приводящей и отводящей кишок, а второй - заглушали их концы. Затем резецированный сегмент кишки располагали изоперистальтически, что было не сложно при пластике слева. При операции справа для изоперистальтического расположения илеотрансплантата его следует располагать выше межкишечного анастомоза, а затем повернуть на 1800 слева направо.
Таблица 2. Сведения о больных, которым выполнена открытая кишечная пластика мочеточника
| № - пол - возраст | Предыдущие операции и заболевания, приведшие к стриктуре | Сторона операции | Пре- и послеоперационные изменения уровня креатинина, бикарбонатов и Сl | ||
| Креатинин (мкмоль/л) | Бикарбонаты (ммоль/л) | Хлориды (ммоль/л) | |||
| 1. – М. – 64. | Стриктура после эндоскопических операций на мочеточнике | Справа | 96 /100 | 21 / 22 | 111 / 107 |
| 2. – М. – 45. | Стриктура после эндоскопических операций на мочеточнике | Слева | 80 / 85 | 28 / 26 | 100 / 108 |
| 3. – Ж – 60. | Постлучевая стриктура | Слева | 80 / 76 | 24 / 22 | 105 / 106 |
| 4. – М – 67. | Отрыв мочеточника при уретеролитотрипсии | Справа | 90 / 95 | 28 / 25 | 109 / 106 |
| 5. – Ж - 68 | Ятрогенная травма мочеточника после экстирпации прямой кишки | Слева | 110 / 118 | 31 / 26 | 107 / 107 |
| 6. – Ж – 63. | Ятрогенная травма мочеточника после экстирпации прямой кишки | Слева | 96 / 104 | 26 / 28 | 99 / 100 |
| 7. – Ж – 40. | Ятрогенная травма мочеточника после лапароскопической экстирпации матки | Слева | 86 / 82 | 25 / 23 | 103 / 100 |
| 8. – Ж – 73. | Ятрогенная травма мочеточника после удаления левых придатков матки | Слева | 160 / 210 | 20 / 18 | 108 / 116 |
| 9. – М – 53. | Стриктура после неоднократных эндоскопических операций на мочеточнике | Справа | 98 / 105 | 26 / 28 | 99 / 100 |
| 10. – Ж – 61. | Постлучевая стриктура | Справа | 76 / 78 | 28 / 26 | 100 / 108 |
Далее приступали к выполнению уретероилеального анастомоза. Через небольшое окно в брыжейке толстой кишки центральный конец мочеточника выводили в брюшную полость, используя викрил 3/0, формировали заднюю полуокружность анастомоза. В полостную систему почки устанавливали стент, а его дистальный конец проводили в полость кишки и ушивали переднюю полуокружность анастомоза. Перед выполнением кишечно-пузырного соустья МП заполняли стерильным раствором, определяли участок для анастомоза на его задней стенке. Далее вскрывали полость МП на протяжении 3 – 4 см, непрерывным швом формировали заднюю полуокружность анастомоза, а другой ниткой – переднюю его часть. Для проверки герметичности обоих анастомозов вновь заполняли МП стерильным раствором. При необходимости накладывали дополнительные узловые швы. Устанавливали два дренажа: один в зону уретероилеального анастомоза, а другой – в Дугласово пространство. Их удаляли на 2 – 3 сутки после операции, а на 6 – 8 сутки выписывали больных на амбулаторное лечение.
Открытую кишечную пластику мочеточника выполняли в положении больного на спине. После срединной лапаротомии проводили диссекцию проксимального участка мочеточника и резекцию сегмента тонкой кишки. Межкишечный анастомоз тоже формировали аппаратным швом. Уретеро-кишечный анастомоз также выполняли медиальнее толстой кишки после выведения центрального конца мочеточника через окно в брыжейке толстой кишки. Затем производили широкий кишечно-пузырный анастомоз.
Послеоперационное обследование включало лабораторные анализы, ультразвуковое исследование почек и малого таза, МСКТ с внутривенным контрастированием и динамическую сцинтиграфию. Статистический анализ полученных результатов проводили на персональном компьютере с использованием пакета программы Statistica 6.0. Достоверность различий средних значений показателей оценивали с помощью критерия Манна-Уитни.
Результаты и обсуждение. Конверсий при лапароскопической кишечной пластике мочеточника не было. Результаты операций были успешными у всех пациентов. Сравнительные данные результатов кишечной пластики мочеточников, выполненных лапароскопическим и открытым доступами, представлены в таблице 3.
Время операции было на 70 минут продолжительнее в лапароскопической группе, но разница не была статистически достоверной (р > 0,05). Наркотические анальгетики в лапароскопической группе применяли реже по сравнению с открытой (40,0 мг / 240 мг, р < 0,05). Время госпитализации было достоверно короче в лапароскопической группе по сравнению с открытой (6 против 9 дней, р < 0,05). До и послеоперационный уровни креатинина, бикарбонатов и хлорида не были изменены в обеих группах. Невыраженный гиперхлоремический метаболический ацидоз развился у одного пациента после открытой операции (дооперационный уровень креатинина 160 мкмоль/л, после операции – 210 мкмоль/л) с уровнем бикарбоната от 18 ммоль/l и хлоридов 107 ммоль/l. Время выздоровления при лапароскопической пластике было достоверно короче (в среднем 4 против 5,5 недель, р < 0,05).
Таблица 3. Сравнительный анализ результатов лапароскопической и открытой кишечной пластики мочеточника
| Изучаемые параметры | Лапароскопическая пластика (п – 7) | Открытая пластика (п – 10) |
| Возраст больных, лет | 52,4 (45 – 69) | 55,6 (40 – 73) |
| Мужчины / женщины | 4 / 3 | 4 / 6 |
| ИМТ, кг / кв. м. | 26,2 (24 – 30,2) | 26,7 (23,8 – 34,2) |
| Время операции, мин | 260 (220 – 380) | 190 (160 – 290) |
| Объем кровопотери, мл | 275 (150 – 450) | 450 (200 – 850) |
| Время госпитализации, дни | 6 (5 – 9) * | 9 (7 – 12) |
| Наркотические анальгетики, мг | 40 (0 – 240) * | 240 (102 – 380) |
| Осложнения, п | 1 (пиелонефрит) | 2 (пиелонефрит) |
| Период наблюдения, мес | 8 (4 – 19) * | 26 (10 – 76) |
| Период реабилитации больных, нед | 4 * | 5,5 |
* р < 0,05
Приводим клиническое наблюдение успешной лапароскопической кишечной пластики левого мочеточника.
Больной 59 лет, госпитализирован с жалобами на наличие нефростомического дренажа слева. Из анамнеза известно, что в стационаре по месту жительства произведена уретеролитотомия по поводу камня нижней трети мочеточника. Впоследствии образовалась стриктура в зоне операции, поэтому был выполнен уретероцистанастомоз слева по Боари. Однако после удаления стента проходимость мочеточника не восстановилась, образовался мочеточниковокожный свищ. На антеградной пиелоуретерограмме визуализируется облитерация тазового отдела левого мочеточника (рис.1).
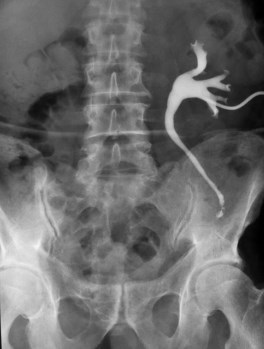
Рис. 1. Антеградная пиелоуретерограммма слева больного после уретеролитотрипсии и операции Боари. Протяженный дефект нижней половины левого мочеточника
Учитывая неэффективность предыдущих операций и протяженный дефект левого мочеточника решено выполнить его кишечную пластику. Лапароскопическим доступом по вышеописанной методике выделена проксимальная часть мочеточника, после резекции сегмента тонкой кишки выполнены уретероилеальный и кишечно-пузырный анастомозы. Осложнений после операции не было, на 7-е сутки выписан на амбулаторное лечение. Через месяц стент удален, на антеградной пиелоуретерограмме хорошая проходимость мочеточника и кишечного сегмента слева (рис. 2).
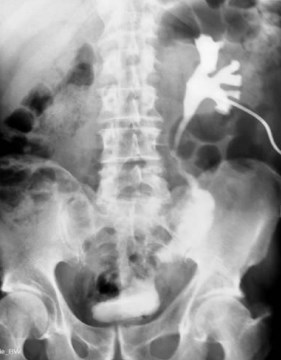
Рис. 2. Антеградная пиелоуретерограмма слева того же больного после лапароскопической кишечной пластики левого мочеточника. Адекватная проходимость ВМП слева
Нефростома была удалена. На МСКТ почек и мочевых путей через 9 месяцев функция обеих почек своевременная, проходимость ВМП удовлетворительная (рис. 3).
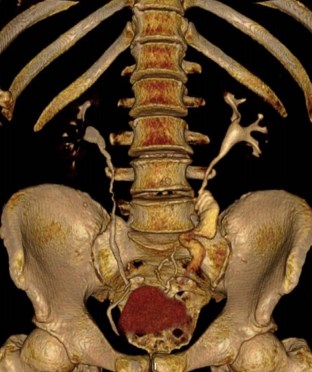
Рис. 3. КТ с внутривенным контрастированием после лапароскопической кишечной пластики левого мочеточника. Уродинамика ВМП не нарушена
В данном клиническом случае отсутствие операций и спаек в брюшной полости позволило лапароскопическим трансперитонеальным доступом выполнить кишечную пластику левого мочеточника и в кратчайшие сроки реабилитировать больного.
Протяженные стриктуры мочеточника различной этиологии при невозможности пластики собственными тканями мочевых путей, являются показанием к выполнению тонкокишечной илеоуретеропластики. За последние десятилетия в клиническую практику внедрена пластика мочеточника эндовидеохирургическим доступом. Несмотря на недостаточный опыт выполнения этих операций, такая техника позволяет значительно снизить время выздоровления пациентов без ухудшения отдаленных функциональных результатов. Статистически достоверные различия нами были получены в сроках госпитализации и выздоровления больных, и количестве использованных наркотических анальгетиков в лапароскопической группе. Время кишечной пластики в среднем было на 70 минут продолжительнее в лапароскопической группе, но разница не была статистически достоверной. Также не получено достоверных изменений функции почки и метаболических показателей до и после операций в обеих группах. Только у одного пациента в открытой группе со средним предоперационным нарушением функции почки (креатинин – 160 мкмоль/л) наблюдался умеренный гиперхлоремический метаболический ацидоз.
Первая лапарокопическая кишечная пластика была выполнена в 2000 году [7]. В 2006 году Kamat N. и Khandelwal P. [16] сообщали о лапароскопической кишечной пластике мочеточника у 2 больных с множественными туберкулезными стриктурами с использованием техники Yang-Monti. В 2008 году Castillo О. et al. [17] данную операцию выполнили двум больным со стриктурами мочеточника после неоднократных эндоскопических вмешательств по поводу уретеролитиаза. Wagner J.R. et al. [14] описали первый случай роботассистированной кишечной уретеропластики.
Наибольшее количество больных, которым выполнялась лапароскопическая кишечная пластика мочеточника, приводят Stein R.J. et al. [8] и Sim A. et al. [9]. Первые выполнили 7 подобных операций. Показанием к лапароскопической илеоуретеропластике в основном были протяженные дефекты мочеточника после его резекции по поводу уротелиального рака. Одному пациенту потребовалась лапаротомия из-за несостоятельности межкишечного анастомоза. В дальнейшем авторы стали выполнять резекцию кишки и межкишечный анастомоз экстракорпорально через небольшой разрез в низу живота. Даже в этих случаях у 2 из 3 последних пациентов наркотические анальгетики не потребовались. Два небольшие (пневмония, подтекание мочи, требующее установки дополнительного дренажа) и одно значимое осложнения наблюдались у трех больных в лапароскопической группе. Серьезное осложнение было у второго пациента, у которого мочеточник поврежден во время лапароскопической парциальной нефрэктомии при опухоли единственной почки. Травма диагностирована интраоперационно и сразу же выполнена интракорпоральная кишечная пластика. На 2-й день после операции у больного развилась картина перитонита. При открытой ревизии брюшной полости выявлена несостоятельность межкишечного анастомоза. Выполнено реанастомозирование кишки и дренирование брюшной полости.
Sim A. et al. [9, 10] произвели эндовидеохирургическую кишечную пластику у 5 больных: у 4 из них лапароскопическим и у одного роботассистированным доступом. По их данным продолжительность роботассистированной илеоуретеропластики составило более 7 часов, что было значительно больше, чем при обычной лапароскопии. Brandao L.F et al. [11] выполнили робот-ассистированную кишечную пластику у одного больного с протяженной стриктурой мочеточника единственной левой почки, развывшейся после неоднократных эндоскопических операций по поводу уретеролитиаза. Несмотря на справедливые утверждения авторов о преимуществах робототехники перед традиционной лапароскопией продолжительность операции составила около 9 часов. Этот факт Sim A. et al. [9] и Brandao L.F et al. [13] объясняют репозицией инструментов во время различных этапов кишечной пластики мочеточника.
Лапароскопическая илеоуретеропластика несомненно имеет определенные преимущества перед традиционной открытой хирургией. Однако выполнение данной операции у больных, которые перенесли неоднократные хирургические вмешательства в брюшной полости, в особенности на самом кишечнике, является сложным, а порой технически невыполнимым из-за выраженного рубцово-спаечного процесса. В этих случаях даже при открытом доступе встречаются технические сложности по выделению кишечника из спаек, его резекции и формированию анастомозов. Показанием к лапароскопической илеоуретеропластике в большинстве случаев были травмы мочеточников во время эндоскопических и гинекологических вмешательств, постлучевые и туберкулезной этиологии стриктуры мочеточника, его дефект после резекции по поводу опухоли [8 – 12, 15 – 18]. У этих больных ввиду отсутствия спаечной болезни целесообразно выполнить кишечную пластику лапароскопическим доступом.
Заключение. Кишечное замещение мочеточника является технически сложной операцией и традиционно выполняется открытым лапаротомным доступом. При отсутствии спаечного процесса в брюшной полости и выраженном пединкулите со склерозирующим паранефритом данную операцию можно выполнить лапароскопическим доступом, который значительно снижает травматичность хирургического вмешательства, укорачивает время госпитализации и реабилитации больных.
Литература
- Комяков, Б.К., Гулиев Б.Г. Хирургия протяженных сужений мочеточников. // Б.К. Комяков, Б.Г. Гулиев. – СПб., Диалект, 2005. – 256 с.
- Chung, B.I. The use of bowel for ureteral replacement for complex ureteral reconstruction: long-term results. / Chung B.I., Hamawy K.J., Zinman L.N. et al. // J. Urol. – 2006. – Vol. 175. – P. 179 – 183.
- Armatys, S.A. Use of ileum as ureteral replacement in urological reconstruction. / Armatys S.A., Mellon M.J., Beck S.D., et al. // J. Urol. – 2009. – Vol. 181. – P. 177 – 181.
- Wolff, B. Long-term functional outcomes after ileal ureter substitution: a single-center experience. / Wolff B., Chartier-KAstler E., Mozer P., et al. // Urology. – 2011. – Vol. 78. – P. 692 – 695.
- Лоран, О.Б. Использование изолированных сегментов кишечника в оперативном лечении лучевых повреждений мочевыводящих путей. / Лоран О.Б., Синякова Л.А., Серегин А.В. и др. // Урология. – 2012. – № 2. – С. 20 – 24.
- Зубань, О.Н. Энтеропластика протяженных стриктур мочеточника туберкулезного и другого генеза. / Зубань О.Н., Скорняков С.Н., Арканов Л.В. и др. // Урология. – 2014. –№ 4. – С.10 – 15.
- Gill, I.S. Laparoscopic ileal ureter. / Gill I.S., Savage S.J., Senagore A.J., Sung G.T. // J. Urol. – 2000. – Vol.163. – P.1199 – 1202.
- Stein, R.J. Laparoscopic assisted ileal ureter: technigue, outcome and comparison to open procedure. / Stein R.J., Turna B., Patel N.S., et al. // J. Urol. – 2009. – Vol. 182. – P. 1032 – 1039.
- Sim, A. Intracorporeal ileal replacement using laparoscopy and robotics. / Sim A., Todenhofer T., Mischinger J., et al. // Cent. European J. Urol. – 2014. – Vol. 67 (4). – P. 420 – 423.
- Sim, A. Totally intracorporeal replacement of the ureter using whole-mount ileum. / Sim A., Todenhofer T., Mischinger J., et al. // J. Endourol. – 2014. – Vol.28(10). – P.1165 – 1167.
- Хатьков, И.Е. Полностью лапароскопическая заместительная пластика праого мочточника участком подвздошной кишки. / Хатьков И.Е., Касаикин А.В., Родин Д.Б., и др. // Эндоскопичекая хирургия. – 2011. – № 1. – С. 41 – 43.
- Комяков, Б.К. Лапароскопическая кишечная пластика мочеточника. / Комяков Б.К., Гулиев Б.Г. // Эндоскопическая хирургия. – 2015. – № 3. – С. 8 – 12.
- Brandao, L.F. Robotic ileal ureter: a completely intracorporeal technigue. / Brandao L.F., Autorino R., Zargar H., et al. // Urology. – 2014. – Vol. 83. – P. 951 – 954.
- Wagber, J.R. Robot-assisted ileal ureter. / Wagber J.R., Schimpf M.O., Cohen J.L. // JSLS. –2008. – Vol. 12(3). – P. 306 – 309.
- Комяков, Б.К. Кишечная и аппендикулярная пластика мочеточников. / Б.К. Комяков. – М. ГОЭТАР-Медиа, 2015. – 415 с.
- Kamat, N. Laparoscopy-assisted ileal ureter creation for multiple tuberculous strictures: report of two cases. / Kamat N., Khandelwal P. // J Endourol. – 2006. – Vol. 20 (6). – P. 388–393.
- Castillo, O. Laparoscsopy-assisted ureter interposition by ileum. / Castillo O., Sunchez-Salas R., Vitagliano G. et al. // J.Endourol. – 2008. – Vol. 22. – P. 687 – 690.
- Baneri, J.S. Total uteterectomy and ileal ureteric replacement for TCC ureter in a solitary kidney. / Baneri J.S., George A.J. // Can. Urol. Assoc. J. – 2014. – Vol. 8 (11 – 12). – P. 938 – 940.
Статья опубликована в журнале "Вестник урологии". Номер №4/2015 стр. 16-29










Комментарии