Рева С.А., Носов А.К., Король В.Д., Арнаутов А.В., Зятчин И.В., Беркут М.В., Петров С.Б.
Сведения об авторах:
- Рева С.А. - к.м.н., заведующий 6 онкологическим отделением (андрологии и онкоурологии), НИЦ Урологии, ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова», Санкт-Петербург, Россия; научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Петрова», Санкт-Петербург; РИНЦ AuthorlD 801853
- Носов А. К. - к.м.н., заведующий отделением онкоурологии, старший научный сотрудник, доцент ФГБУ «НМИЦ онкологии имени Н.Н. Петрова», Санкт-Петербург, Россия;
- Король В.Д. - к.м.н., заведующий отделением урологии ФГБУ ВЦЭРМ и м. А.М. Никифорова МЧС России, Санкт-Петербург, Россия;
- Арнаутов А.В. - клинический ординатор ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова», НИЦ Урологии, 6 онкологическое отделение (андрологии и онкоурологии);
- Зятчин И.В. - студент 6 курса ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова»; РИНЦ AuthorlD 1057059
- Беркут М.В. - врач-уролог, отделение онкоурологии, ФГБУ «НМИЦ онкологии им. Н.Н. Петрова», Санкт-Петербург, Россия; РИНЦ AuthorlD 1045252
- Петров С.Б. - проф., д.м.н., руководитель НИЦ Урологии, ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова», Санкт-Петербург, Россия; ведущий научный сотрудник ФГБУ «НМИЦ онкологии имени Н.Н. Петрова», Санкт-Петербург; РИНЦ AuthorlD 938083
DOI: 10.29188/2222-8543-2020-12-3-36-42
ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) высокого риска является угрожающим жизни заболеванием, склонным к прогрессированию, метастазированию [1]. Среди всех больных РПЖ, к высокому риску (сумма Глисона 8 и более и/или уровень ПСА >20 нг/мл и/или категория местной распространенности >T3a) относят до 30% пациентов [2]. Тем не менее, эти больные представляют собой неоднородную популяцию с существенно различающейся эффективностью различных видов лечения [3, 4].
В более ранних работах, расценивавших хирургическое лечение РПЖ высокого риска как не излечивающее, 10-летняя безрецидивная выживаемость (БРВ) составляла 55% [5]. Однако недавние исследования продемонстрировали хорошие онкологические результаты радикальной простатэктомии (РПЭ) в данной группе больных [6, 7]. В соответствии с этим, в настоящее время клинические рекомендации ведущих ассоциаций рассматривают радикальное хирургическое лечение как возможный метод лечения у ряда пациентов с РПЖ -ВР [2, 8, 9].
Целью нашего исследования была оценка онкологических результатов радикального хирургического лечения у больных с РПЖ-ВР, а также сравнение результатов лечения пациентов внутри группы РПЖ-ВР в зависимости от количества факторов риска по критериям NCCN (National Comprehensive Cancer Network).
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2001 по 2019 год 1069 пациентам с верифицированной аденокарциномой предстательной железы (пПЖ) было проведено радикальное хирургическое лечение по поводу локализованного или местнораспространенного. 237 пациентов исключены из исследования по причине периода послеоперационного наблюдения менее 12 месяцев, неполного набора предоперационных характеристик, отсутствия полной информации о результатах гистологического исследования и послеоперационных данных, а также подозрении на наличие регионарных метастазов (cN1). Стадирование проводилось согласно стандартам NCCN, актуальным на момент включение в исследование [2]. Согласно этим критериям, в окончательный анализ вошли 832 пациента, из них 282 (33,9%) при клинической оценке отнесены к группе высокого риска.
Критериями отнесения к группе РПЖ-ВР были модифицированные NCCN в 2013 году параметры D’Amico – сумма Глисона 8 и более и/или уровень ПСА >20 нг/мл и/или местнораспространенный процесс (далее в статье – как критерий >T3a) и отсутствие метастазов [1, 2]. Пациенты, получившие лечение до 2013 года, были рестадированы согласно критериев NCCN.
Оценка патоморфологического материала проводилась до начала лечения (биопсийный материал) и после него (РПЭ). Степень дифференцировки опухоли оценивалась путем определения суммы баллов по шкале Глисона, с 2005 года – с учетом поправок, принятых международной ассоциацией урологических патологов (ISUP). Местная распространенность до 2010 года оценивалась по данным пальцевого ректального исследования и процента содержания опухоли в биопсийном столбике. С 2011 года во всех клиниках пациентам до оперативного вмешательства для оценки местной распространенности и регионарных метастатического процесса выполнялась магнитно-резонансная томография (МРТ) малого таза (до 2016 года первичная опухоль оценивалась путем оценки целостности капсулы ПЖ в режиме T2W, после – по критериям PIRADS). Для исключения отдаленных метастазов пациентам выполнялись остеосцинтиграфия, компьютерная томография (КТ) и рентгенография грудной клетки.
Хирургическое лечение пациентам с РПЖ-ВР планировалось в объеме открытой (с 2001 по 2013 годы) и лапароскопической (с 2013 по 2019 годы) РПЭ без нервосбережения, с расширенной двухсторонней лимфаденэктомией (рЛАЭ) до бифуркации общих подвздошных сосудов или до бифуркации аорты/нижней брыжеечной артерии (суперрасширенный объем, срЛАЭ). Все операции были выполнены одним из хирургов бригады с опытом выполнения вмешательств (А.Н., С.П., С.Р.).
Уровень ПСА после операции определялся через 1 месяц, далее – каждые 3 месяца в течение первого года, затем каждые 6 мес в течение 3 лет и далее ежегодно. Биохимический рецидив (БХР) определялся при повышении уровня ПСА после оперативного лечения > 0,2 нг/мл минимум в 2 последовательных измерениях. При развитии БХР проводилось обследование и лечение в соответствии с существующими стандартами. При оценке показателей выживаемости оценивалась частота БХР, определены раковоспецифическая (РСВ) и общая выживаемость (ОВ).
Статистический анализ был проведен с использованием программы «GraphPad Prism» (версия 8.0.1; GraphPad Software Inc., LaJolla, CA, USA). Общая, раковоспецифическая и безрецидивная выживаемость (ОВ, РСВ и БРВ) были оценены по методу Каплана-Майера с использованием log-rank-теста. Статистически значимым было принято значение P-value <0,05. Для оценки достоверности различий анализируемых параметров в выборках пациентов были использованы линейные методы статистики: тест Манна-Уитни, t-критерий Стьюдента, критерий Вилкоксона.
РЕЗУЛЬТАТЫ
Распределение пациентов среди всех прооперированных пациентов и в группе высокого риска в зависимости от места проведения лечения представлено на рисунке 1.
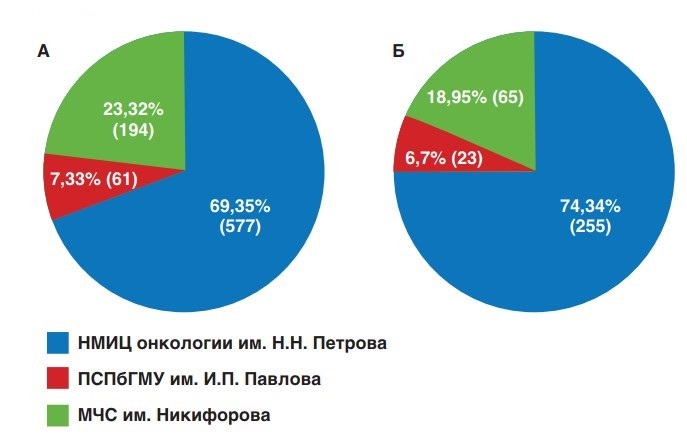
Рис. 1. Распределение пациентов в зависимости от группы риска и места проведения лечения: А) все пациенты после РПЭ; Б) пациенты с РПЖ-ВР
Fig. 1. Distribution of patients depending on the risk group and the place of treatment: А) all patients after RP; Б) patients with high risk PCa
Характеристики пациентов перед лечением представлены в таблице 1. Медиана наблюдения за пациентами, перенесшими РПЭ в группе РПЖ-О и в группе с РПЖ-ВР составила, соответственно, 60,0 (30,9-228,3) и 57,9 (30,7-220,0) месяцев. Средний возраст больных на момент операции составил 63,5 (43-81) лет. Распределение в зависимости от количества факторов риска в группе РПЖ-ВР было следующим: 196 (69,5%) пациентов имели 1 фактор высокого риска, 67 (23,8%) – 2 фактора и 19 (6,7%) – 3 фактора. Количество пациентов с низкодифференцированной опухолью (сумма баллов по Глисону 8 и выше) составило 25,1%.
Таблица 1. Характеристики пациентов до начала лечения
Table 1. Characteristics of patients before treatment
| Характеристика Characteristic |
Значение Value |
|---|---|
| Возраст (лет) (средн (IQR)±SD) Age (years) (mean (IQR)±SD) |
63,5 (59 – 68) ± 6,39 |
| Объём предстательной железы (мл) (средн, (IQR)) Prostate volume (ml) (mean (IQR)) |
54,4 (36 – 66) |
| ПСА, нг/мл (средн (IQR)) PSA, ng/ml (mean (IQR)) |
26,7 (11,3 – 29,6) |
| Гистологическая оценка биоптатов Histological evaluation of biopsies |
|
| Сумма Глисона Gleason sum 6 (3+3), n (%) 7 (3+4), n (%) 7 (4+3), n (%) 8 (4+4), n (%) >9, n (%) |
Оценка Глисона Gleason Score 106 (37,6) 72 (25,5) 29 (10,3) 64 (22,7) 11 (3,9) |
| Клиническая стадия (сTNM) Clinical stage (cTNM) |
|
| ≤T2b, n (%) | 59 (20,9) |
| T2c, n (%) | 67 (23,8) |
| T3a, n (%) | 96 (34,0) |
| ≥T3b, n (%) | 60 (21,3) |
ПСА – простатспецифический антиген; IQR – интерквартильный диапазон; SD - стандартное отклонение
PSA – prostate-specific antigen; IQR - interquartile range; SD - standard deviation
В общей сложности, по результатам патоморфологического исследования к критериям высокого риска соответствовали 343 пациента. Положительный хирургический край (ПХК) обнаружен у 85 (24,8%) пациентов, поражение ЛУ (N+) – у 77 (25,8%) (табл. 2). По результатам патоморфологического исследования, среди всех прооперированных пациентов изменение cT на более высокую pT было отмечено у 83 (10,0%), а итоговый более агрессивный процесс (перераспределение от суммы баллов по Глисону 6-7 к 8 и выше) — у 51 (6,1%). В целом, после операции 115 (20,8%) пациентов, отнесенных до начала лечения к группе низкого или промежуточного риска после РПЭ, отнесены к группе высокого риска. Наоборот, клиническая оценка пациентов как имеющих заболевание высокого риска выявлена у 51 (18,3%) пациентов, по результатам РПЭ отнесенных к группе низкого/промежуточного риска.
Таблица 2. Патоморфологические показатели
Table 2. Morphological characteristics
| Характеристика Characteristic |
Значение Value |
|---|---|
| Частота ПХК, n (%) frequency of positive margins, n (%) |
85 (24,8 %) |
| Количество удаленных лимфоузлов, средн (min-max) Number of removed lymph nodes, mean (min-max) |
13,75 (11-58) |
| Количество позитивных лимфоузлов, средн (min-max) Number of positive lymph nodes, mean (min-max) |
2,35 (0-10) |
| Гистологическая оценка после РПЭ Histological assessment after RP |
|
| Сумма Глисона Gleason sum 6 (3+3), n (%) 7 (3+4), n (%) 7 (4+3), n (%) 8 (4+4), n (%) >9, n (%) |
Gleason Score 55 (16,0) 128 (37,3) 74 (21,6) 57 (16,6) 29 (8,5) |
| Патоморфологическая стадия (pTNM) Pathomorphological stage (pTNM) |
|
| ≤pT2b, n (%) | 15 (4,4) |
| рT2c, n (%) | 105 (30,6) |
| рT3a, n (%) | 104 (30,3) |
| ≥рT3b, n (%) | 119 (34,7) |
| pN1, n (%) | 77 (25,7) |
ПХК – положительный хирургический край;
РПЭ – радикальная простатэктомия RP – radical prostatectomy
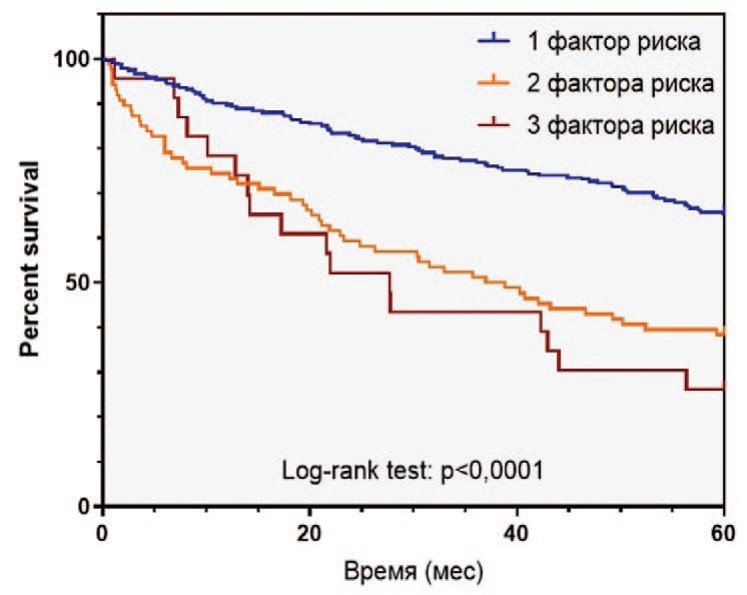
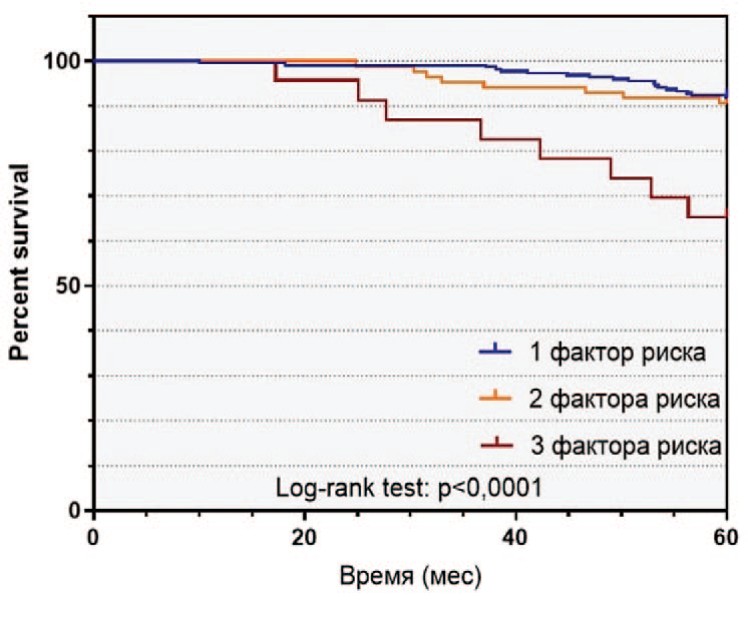
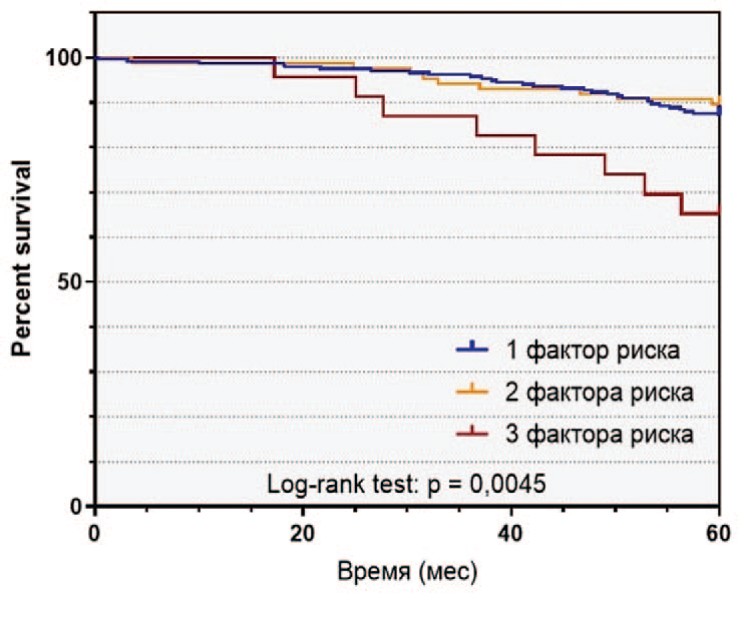
Рис. 2. Выживаемость пациентов с РПЖ высокого риска в зависимости от наличия факторов риска: а - безрецидивная выживаемость, б - раковоспецифическая выживаемость, в - общая выживаемость
Fig. 2 Survival of patients with high-risk prostate cancer depending on the number of risk factors: a - relapse-free survival, b - cancer-specific survival, c - overall survival
За время наблюдения после РПЭ биохимический рецидив в группе РПЖ-BP выявлен у 114 (33,2%) пациентов, 60 (17,5%) больных умерли от PПЖ. 5-летняя БРВ, РСВ и ОВ составили, соответственно, 54,8%, 87,0% и 83,7% 9.
Среди пациентов в группе РПЖ-ВР отмечались различия в выживаемости в зависимости от количества факторов риска. БРВ, РСВ и ОВ в группе РПЖ-ВР различались, соответственно, в зависимости от наличия одного (65,0%, 89,6%, 85,0%), двух (38,4%, 85,9%, 84,9%) и трех (13,0%, 65,2%, 65,2%) факторов риска (рис. 2).
В целом, наличие более одного предоперационного фактора РПЖ-ВР являлось значимым неблагоприятным прогностическим признаком в отношении развития БХР (отношение рисков (ОР) 2,589 (95 % ДИ 1,730 – 3,874, p < 0,001), а наличие более двух факторов – в отношении РСВ (отношение рисков (ОР) 4,254 (95 % ДИ 1,221 – 14,82, p = 0,0016) и ОВ (отношение рисков (ОР) 3,752 (95 % ДИ 1,121 – 12,56, p = 0,0034). При этом различия у пациентов с одним или двумя факторами риска не были достоверными как для РСВ (p=0,3537), так и для и ОВ (p=0,8875).
Адъювантная терапия проведена 11,7% (n=40) пациентам в группе РПЖ-ВР, а при прогрессировании – 12,2% (n=42).
ОБСУЖДЕНИЕ
Возможности хирургического лечения РПЖ высокого риска в настоящее время до сих пор обсуждаются. Онкологическая эффективность РПЭ показана в исследовании S.A. Boorjian и соавт., в котором по результатам анализа лечения 1513 пациентов с РПЖ-ВР 10-летняя БРВ, выживаемость без системной прогрессии и РСВ составили, соответственно, 55%, 89% и 95% [10]. Тем не менее, сегодня хирургическое лечение РПЖ-ВР рассматривается как часть мультимодального подхода [11]. При этом, по различным данным, от 35 до 76% пациентов с РПЖ-ВР в течение 10 лет после РПЭ живут без потребности в проведении какой-либо вторичной терапии по поводу прогрессирования заболевания [12]. Предполагаемые выгоды РПЭ в качестве первой линии терапии в таких ситуациях включают в себя уменьшение опухолевой нагрузки и оптимальный локальный контроль над заболеванием. Кроме того, морфологическое исследование препарата и послеоперационный уровень ПСА помогает индивидуализировать отбор пациентов для адъювантного или «спасительного» лечения (НЛТ, ГТ), частота назначения которого в группе РПЖ-ВР остается высокой как в нашем анализе (23,9%), так и в крупных проспективных исследованиях [13].
Важным моментом является стратификация пациентов с РПЖ в отношении риска прогрессирования. Долгое время для распределения в группу высокого риска являлись критерии D’Amico, а именно – стадия Т2с. Споры о том, пациенты с какой распространенностью могут быть отнесены в группу высокого риска, а какие – промежуточного продолжаются до сих пор. Европейская ассоциация урологов относит к группе РПЖВР больных с локализованным процессом (T2c) и этого критерия придерживались предыдущие авторы, оценивавшие результаты лечения больных с РПЖ-ВР [4]. В то же время, большинство ассоциаций (AUA, NCCN, SUO, ASTRO) с 2013 года акцентирует внимание на прогностической важности местной распространенности (Т3а и выше) РПЖ-ВР [2,14]. В связи с этим, именно критерии NCCN мы выбрали в качестве основы для стратификации пациента. Вторым моментом в этом вопросе является то, что на сегодня оценка риска прогрессирования с позиций классических критериев D’Amico (уровень ПСА, степень дифференцировки по Глисону и местная распространенность) недостаточна [15, 16].
Однако, в нашем анализе мы пользовались только ими, так как не у всех пациентов, включенных в исследование на начальном этапе оценивались другие прогностически значимые показатели – процент пораженных опухолью столбиков, процент опухоли в отдельном столбике, экспрессия иммуногистохимических и молекулярно-генетических маркеров прогрессировали и т.п.
О менее благоприятных онкологических результатах при высоком риске прогрессирования РПЖ известно давно. В нашем анализе результатов лечения больных из нескольких центров, пациенты с РПЖ-ВР имели ПХК в 24,8% случаев и частоту pN+ равную 25,7%. С этим показатели коррелировали и отдаленные онкологические результаты, что говорит о том, что РПЭ в группе высокого риска требует агрессивного хирургического вмешательства, цель которого – максимально возможное удаление опухолевого процесса [5].
В то же время, не все пациенты, отнесенные к группе высокого риска, имеют одинаковый прогноз. Согласно недавней работе S. Butler и соавт, пациенты с благоприятным высоким риском (стадия Т1с с суммой Глисона 8 (4+4) и уровнем ПСА 20 нг/мл) имели более благоприятное течение онкологического процесса по сравнению с больными со стандартными критериями заболевания высокого риска. При медиане наблюдения 5,7 лет (схожей с нашей работой – 5,0 лет для пациентов с высоким риском заболевания), пациенты с благоприятной подгруппой высокого риска имели восьмилетнюю раковоспецифическую смертность 2,2%, по сравнению с больными группы стандартных показателей РПЖ-ВР – 10,8% (aHR, 0.26; 95% CI, 0,09 – 0,73; р = 0,01); при этом благоприятные критерии приближали этих больных по показателям выживаемости к результатам в группе промежуточного риска (2,2% в обеих группах; aHR 0,9; 95% CI, 0,32 – 2,54; р = 0,84) [17]. В своей работе мы не проводили выделение подобной группы, однако провели анализ различия выживаемости в зависимости от наличия одного, двух или трех критериев высокого риска заболевания. БРВ, РСВ и ОВ достоверно отличались в этих трех подгруппах, с наиболее благоприятными показателями при одном факторе риска. Так, пятилетняя БРВ составила 65%, 38,4% и 13% у пациентов с 1, 2 и 3 факторами риска, что соответствует данным G. Ploussard и соавт., показавшим значительное влияние количества предоперационных факторов высокого риска на развитие рецидива после оперативного лечения [18]. В то же время, РСВ и ОВ у пациентов с одним или двумя факторами риска не отличались.
Таким образом, более половины пациентов с РПЖВР (55% по результатам нашего анализа) имеют шанс на излечение с использованием только хирургического способа. Остальным больным (особенно пациентам с тремя факторами риска, имеющими наихудшие онкологические результаты лечения – БРВ, РСВ, ОВ) необходимо выполнение максимально агрессивного хирургического лечения и решение вопроса о проведении неоадъювантной и/или адъювантной терапии [19].
В течение длительного времени РПЭ не рассматривалась как опция у пациентов с РПЖ-ВР. Тем не менее, несколько работ, проведенных в последние десятилетия, показали эффективность, в том числе некоторые из них – при длительном наблюдении [20-22]. Однако, именно мультимодальный подход остается основным для большей части пациентов. Пациенты, получившие последовательно хирургическое лечение с последующей ЛТ имели лучше показатели общей выживаемости (независимо от стадии опухоли, вовлечения лимфоузлов, суммы Глисона) по сравнению с только РПЭ в аналогичных когортах – 10-летняя РСВ у больных со стадией T3a/bN0M0, T3a/bN1M0 и T4N0M0 составила, соответственно, 89%, 76% и 72% [25]. В нашей работе адъювантная терапия пациентам из группы высокого риска была проведена 40 (11,7%) пациентам. Кроме того, 57,5% пациентов, получившие адъювантную терапию, имели два и более факторов риска.
Основными недостатками нашего исследования являются его ретроспективный характер и технические различия в выполнении хирургического вмешательства (сравнение пациентов с проведенной открытой и лапароскопической РПЭ, разный объем лимфодиссекции). Тем не менее, учитывая, что все операции были выполнены одной группой хирургов референсных центров, мы сочли эти различия не влияющими на достоверность результатов. В связи этим, основной проблемой в выводах относительно роли РПЭ у различных пациентов с РПЖ высокого риска является недостаток качественно спланированных проспективных исследований.
Анализ отдаленных онкологических результатов – процесс комплексный, включающий в себя множество параметров, как классических, так и вновь предлагаемых. Акцентировав в этой работе внимание на онкологических показателях, мы осознанно не оценивали их взаимосвязь с прочими характеристиками (например, количество удаленных лимфоузлов, плотность региональных метастазов, протяженность ПХК, и т.д.), так как в современных рекомендациях группа прогноза и объем лечения по-прежнему оцениваются по уровню ПСА, сумме Глисона и распространенности.
Мы представили данные сравнения результатов лечения пациентов с РПЖ, показав, что процент пациентов с высоким риском прогрессирования в современных условиях может быть выше, чем в представленных ранее литературных источниках. Однако течение заболевания при РПЖ-ВР отличается внутри группы в зависимости от различных характеристик, что может быть важным при консультировании пациентов и принятии решения о лечебной тактике. Результаты нашего анализа могут быть применены при выборе подхода к пациентам с РПЖ высокого риска, формируя прогноз относительно онкологических результатов после РПЭ.
ВЫВОДЫ
Многочисленные исследования показывают хорошие отдаленные онкологические результаты при выполнении РПЭ пациентам с РПЖ высокого риска. В сравнении с более ранними данными, в результате развития техники операций (в частности, выполнение лимфодиссекции в большем объеме), нами показано, что у больных с РПЖ-ВР, что два фактора риска по критериям NCCN не являются препятствием для выполнения РПЭ. Пациенты с наличием одного фактора риска имеют шанс на излечение, а 1-2 факторов – выше РСВ и ОВ. Наименее благоприятные онкологические результаты после лечения имеют пациенты с сочетанием всех трех факторов риска, что может быть обоснованием для применения в таких случаях комбинированной тактики (неоадъюватной и/или адъюватной терапии). При наличии одного или двух факторов различий в РСВ и ОВ не отмечено. Возможно, среди пациентов с РПЖ высокого риска целесообразно выделить подгруппу с более благоприятным послеоперационным течением, для чего нужны рандомизированные проспективные исследования.
ЛИТЕРАТУРА
- D’Amico AV, Whittington R, Malkowicz BS, Schultz D, Blank K, Broderick GA, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280(11):969–974. doi: 10.1001/jama.280.11.969.
- Mohler JL, Kantoff PW, Armstrong AJ, Bahnson RR, Cohen M, D'Amico AV, et al. Prostate cancer, version 2.2014. J Natl Compr Canc Netw. 2014;12(5):686–718. doi: 10.6004/jnccn.2014.0072.
- Walz J, Joniau S, Chun FK, Isbarn H, Jeldres C, Yossepowitch O, et al. Pathological results and rates of treatment failure in high-risk prostate cancer patients after radical prostatectomy. BJU Int 2011;107(5):765–770. doi: 10.1111/j.1464-410X.2010.09594.x..
- Велиев Е.И., Соколов Е.А., Лоран О.Б., Петров С.Б. Рак предстательной железы высокого риска: онкологическая эффективность радикальной простатэктомии. Онкоурология 2014;10(1):53-57. doi: 10.17650/1726-9776-2014-10-1-53-57. [Veliyev E.I., Sokolov E.A., Loran O.B., Petrov S.B. High-risk prostate cancer: the onco-logical efficiency of radical prostatectomy. Oncourologia = Cancer Urology 2014;10(1):53-57. doi: 10.17650/1726-9776-2014-10-1-53-57. (In Russian)].
- Loeb S, Schaeffer EM, Trock BJ, Epstein JI, Humphreys EB, Walsh PC. What are the outcomes of radical prostatectomy for high-risk prostate cancer? Urology 2010;76(3):710-714. doi: 10.1016/j.urology.2009.09.014.
- Joniau S, Hsu C-Y, Gontero P, Spahn M, Van Poppel H. Radical prostatectomy in very-high risk prostate cancer: Long-term outcomes and outcome predictors. Scand J Urol Nephrol 2012,46(3):164-171. doi: 10.3109/00365599.2011.637956.
- Touijer KA, Mazzola CR, Sjoberg DD, Scardino PT, Eastham JA. Long-term outcomes of patients with lymph node metastasis treated with radical prostatectomy without adjuvant androgen-deprivation therapy. Eur Urol 2014;65(1):20-25. doi: 10.1016/j.eururo.2013.03.053.
- Thompson I, Thrasher JB, Aus G, Burnett AL, Canby-Hagino ED, Cookson MS, et al. Guideline for the management of clinically localized prostate cancer: 2007 update. J Urol 2007;177(6):2106–131. doi: 10.1016/j.juro.2007.03.003.
- Heidenreich A, Bellmunt J, Bolla M, Joniau S, Mason M, Matveev V, et al. EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localized disease. Eur Urol 2011;59(1):61–71. doi: 10.1016/j.eururo.2010.10.039.
- Boorjian SA, Karnes RJ, Rangel LJ, Bergstralh EJ, Blute ML. Clinic validation of the D'Amico risk group classification for predicting survival following radical prostatectomy. J Urol 2008;179(4):1354–1360. doi: 10.1016/j.juro.2007.11.061.
- Yossepowitch O, Eggener SE, Bianco FJ Jr, Carver BS, Serio A, Scardino PT, et al. Radical prostatectomy for clinically localized, high risk prostate cancer: critical analysis of risk assessment methods. J Urol 2007;178(2):493-499. doi: 10.1016/j.juro.2007.03.105.
- Yossepowitch O, Eggener SE, Serio AM, Carver BS, Bianco FJ Jr, Scardino PT, et al. Secondary therapy, metastatic progression, and cancer specific mortality in men with clinically high-risk prostate cancer treated with radical prostatectomy. Eur Urol 2008; 53(5):950-959. doi: 10.1016/ j.eururo.2007.10.008.
- Dorff TB, Flaig TW, Tangen CM, Hussain MH, Swanson GP, Wood DP Jr, et al. Ad-juvant androgen deprivation for high risk prostate cancer after radical prostatectomy: SWOG S9921 study. J Clin Oncol 2011;29(15):2040–2045. doi: 10.1200/JCO.2010.32.2776.
- Нюшко К.М., Алексеев Б.Я., Крашенинников А.А., Воробьев Н.В., Сафронова Е.Ю., Калпинский А.С., и др. Хирургическое лечение больных локализованным и местнораспространенным раком предстательной железы: результаты одноцентрового исследования. Онкология. Журнал им. П.А. Герцена. 2018;7(1):4-13. doi: 10.17116/onkolog2018714-13. [Njushko K.M., Alekseev B.J., Krasheninnikov A.A., Vorob'ev N.V., Safronova E.J., Kalpinskij A.S., et al. Surgical treatment of patients with localized and locally advanced prostate cancer: results of a single-center study. Onkologiya. Zhurnal imeni P.A. Gertsena = P.A. Herzen Journal of Oncology 2018;7(1):4-13. doi: 10.17116/onkolog2018714-13 (In Russian)].
- Безруков Е.А., Рапопорт Л.М., Шпоть Е.В., Еникеев М.Э., Морозов А.О. Рак простаты высокого онкологического риска. Современные тенденции хирургического лечения. Урология 2017;4:129-134. doi: 10.18565/urol.2017.4.129-134 [Bezrukov E.A., Rapoport L.M., Shpot E.V., Enikeev M.E., Morozov A.O. Prostate cancer of high oncological risk. Current trends in diagnosis and surgical treatment. Urologiya = Urology 2017, (4):129-134 (In Russian)].
- Nosov A, Reva S, Petrov S, Mamijev E, Novikov R, Veliev E, et al. Neoadjuvant chemotherapy using reduced-dose docetaxel followed by radical prostatectomy for patients with intermediate and high-risk prostate cancer: a single-center study. Prostate 2016;76(15):1345-52. doi: 10.1002/pros.23165.
- Butler SS, Dee EC, Lamba N, Sha ST, Mahal BA, Whitbeck A, et al. Validation of a subclassification for high‐risk prostate cancer in a prospective cohort. Cancer 2020;126(10):2132-2138. doi: 10.1002/cncr.32778.
- Ploussard G, Masson-Lecomte A, Beauval JB, Ouzzane A, Bonniol R, Buge F, et al. Radical prostatectomy for high-risk prostate cancer defined by preoperative criteria: oncologic follow-up in national multicenter study in 813 patients and assessment of easy-to-use prognostic substratification. Urology 2011;78(3):607–613. doi: 10.1016/j.urology.2011.05.021.
- Носов А.К., Петров С.Б., Рева С.А., Мамижев Э.М., Новиков Р.В., Велиев Е.И., и др. Исследование безопасности и эффективности химиотерапии доцетакселом перед радикальной простатэктомией у больных раком предстатательной железы промежуточного и высокого риска (наблюдение в течение 11,4 года). Онкоурология 2014;4:52-61. doi: 10.17650/1726-9776-2014-10-4-52-61. [Nosov A.K., Petrov S.B., Reva S.A., Mamizhev E.M., Novikov R.V., Veliev E.I., et al. Results of a unicenter randomized study of the safety and efficiency of docetaxel chemotherapy before radical prostatectomy in patients with intermediate and high-risk prostate cancer: An 11.4-year follow-up. Onkourologiya = Cancer Urology 2014;10(4):52-61. doi: 10.17650/1726- 9776-2014-10-4-52-61. (In Russian)].
- Dell'Oglio P, Karnes RJ, Joniau S, Spahn M, Gontero P, Tosco L. et al. Very long-term survival patterns of young patients treated with radical prostatectomy for high-risk prostate cancer. Urol Oncol 2016;34(5):234.e13-9. doi: 10.1016/j.urolonc.2015.11.018.
- Engel J, Bastian PJ, Baur H, Beer V, Chaussy C, Gschwend JE, et al. Survival benefit of radical prostatectomy in lymph node positive patients. Eur Urol 2010;57(5):754-761. doi: 10.1016/j.eururo.2009.12.034.
- Каприн А.Д., Костин А.А., Филимонов В.Б., Васин Р.В., Иванова А.Ю. Отдаленные результаты радикальной позадилонной простатэктомии. Российский медико-биологический вестник имени академика И.П. Павлова 2015;1:120-129. doi: 10.17816/PAVLOVJ20151120-129. [Kaprin A.D., Kostin A.A., Filimonov V.B., Vasin R.V., Ivanova A.J. Long-term results of radical retropubic prostatectomy. Rossijskij mediko-biologicheskij vestnik imeni akademika I.P. Pavlova = I.P. Pavlov Russian Medical Biological Herald 2015;(1):120-129. doi: 10.17816/PAVLOVJ20151120-129. (In Russian)].
- ang TL, Patel N, Faiena I, Radadia KD, Moore DF, Elsamra SE, et al. Comparative effectiveness of radical prostatectomy with adjuvant radiotherapy versus radiotherapy plus androgen deprivation therapy for men with advanced prostate cancer. Cancer 2018;124(20):4010-4022. doi: 10.1002/cncr.31726










Комментарии