Б.Г. Гулиев1, 2, Б.К. Комяков1 , Р.Р. Болокотов2 , Д.М. Ильин2
1 ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» МЗ РФ; Санкт-Петербург, Россия
2 СПб ГБУЗ «Городская Мариинская больница»; Санкт-Петербург, Россия
Введение
Открытая радикальная цистэктомия (РЦ) в течение длительного времени оставалась основным методом лечения пациентов с мышечно-инвазивным раком мочевого пузыря (РМП) [1 - 3]. Она также показана при рецидивирующих поверхностных опухолях с высоким риском прогрессии, при БЦЖ-резистентном раке in situ, T1 G3 [1]. Активное развитие медицинских технологий привело к эволюции малоинвазивных операций в лечении РМП. За последние десятилетия активно внедряются лапароскопическая и робот-ассистированная РЦ. В литературе имеются публикации об их эффективности и относительной безопасности с превосходящими результатами по объёму кровопотери, раннему восстановлению кишечной функции, времени госпитализации и реабилитации [4 - 9].
Робот-ассистированная хирургия получила широкое развитие в урологии, в основном, за счёт часто выполняемых радикальных простатэктомий. За последнее десятилетие стали применять робот-ассистированный доступ при РЦ. До 2010 года количество центров, выполняющих эту операцию, было лимитировано. В последние годы количество публикаций увеличилось, включая широкие серии, что отражает растущее признание этого доступа при РЦ [7 - 8, 10 - 11]. Однако РЦ с деривацией мочи остаётся одной из сложных операций в урологии. Она ассоциируется с высоким уровнем осложнений даже в руках опытной хирургической бригады. Как показано некоторыми авторами, их количество уменьшается с опытом, хотя они остаются высокими даже в специализированных урологических центрах [5, 10 - 12]. Время операции при робот-ассистированной РЦ, по сравнению с открытым доступом, остаётся достаточно длительным. С накоплением опыта можно уменьшить продолжительность вмешательства за счёт оптимизации методики выполнения отдельных этапов РЦ, среди которых выделяют цистпростатэктомию с тазовой лимфодиссекцией (I этап) и кишечную деривацию мочи (II этап). В этой статье мы приводим этапы робот-ассистированной РЦ, дополнительно описывая методику нервосберегающей РЦ у мужчин и орган-сохраняющей операцией у женщин.
Цель исследования. Описать этапы и интраоперационные результаты робот-ассистированной РЦ.
Материалы и методы
На базе кафедры урологии Северо-Западного ГМУ имени И.И. Мечникова в центре урологии с робот-ассистированной хирургией Мариинской больницы с июня по ноябрь 2018 г. робот-ассистированная РЦ с интракорпоральной ортотопической цистопластикой выполнена 10 пациентам (8 мужчин, 2 женщины), возраст — 64-76 лет. Индекс массы тела — 25,6±4,5 кг/м2 . Предоперационное обследование включало ультразвуковое исследование (УЗИ) и спиральную компьютерную томографию (СКТ) органов брюшной полости и малого таза, СКТ лёгких, лабораторные исследования. Сканирование костей выполняли у больных с болями в костях или высокой концентрацией щелочной фосфатазы в сыворотке крови. Перед операцией всем пациентам выполняли уретроцистоскопию, которая позволяла уточнить размеры и локализацию опухоли мочевого пузыря, исключить её наличие в шейке мочевого пузыря (МП) и простатическом отделе уретры, провести биопсию для гистологической верификации.
Основные этапы робот-ассистированной РЦ
Робот-ассистированная РЦ у мужчин
Положение больного и локализация троакаров. Пациента укладывают в дорзальное литотомическое положение, руки располагают вдоль тела, нижние конечности разводят в стороны настолько, чтобы было возможно подвести робот. Пациента адекватно фиксируют к столу и устанавливают в положение Trendelenburg под 30-450 (рис. 1).
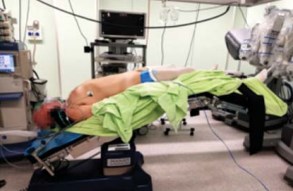
Рисунок 1. Положение больного на операционном столе
После индукции общей анестезии обрабатывают операционное поле, устанавливают назогастральный зонд и стерильный катетер Foley. Правильное расположение троакаров является очень важным для успешности операции. Мы использовали технику с 6 троакарами, порт для камеры располагали на 5 см выше пупка по срединной линии. После инсуффляции брюшной полости до 10-12 мм рт. ст. под контролем зрения устанавливали два роботических троакара по линии пупка справа и слева латеральнее прямых мышц живота. Левый порт устанавливается на 8 см, а правый — на 10-11 см от средней линии, что обеспечивает большее пространство для троакара ассистента. Третий из них устанавливается на 7-10 см латеральнее от левого порта и 5-7 см выше от гребня подвздошной кости. При выполнении интракорпоральной деривации мочи этот порт заменяют на 15 см троакар для сшивающего аппарата, что обеспечивает лучший угол для резекции тонкой кишки и формирования межкишечного анастомоза. Два ассистентских порта располагают с обеих сторон от правого роботического порта. Расположение троакаров приведено на рис. 2.
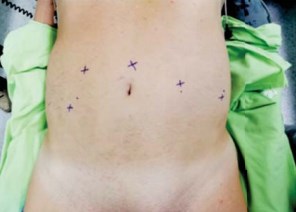
Рисунок 2. Положение троакаров
Задняя диссекция. В начале проводится мобилизация обоих мочеточников на протяжении нижней трети от зоны пересечения с подвздошными сосудами до МП. Ближе к юкставезикальному отделу мочеточника накладываются две клипсы Hem-o-lock, между ними он пересекается и часть его отправляется на патоморфологическое исследование (рис. 3).
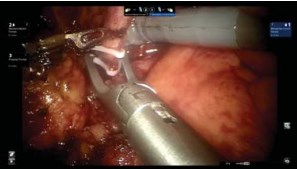
Рисунок 3. Мобилизован левый мочеточник на протяжении нижней трети и клипирован
На проксимальную клипсу накладывается лигатура, которая облегчает дальнейшую манипуляцию при анастомозировании мочеточника с резервуаром. Затем выделяются семявыносящие протоки и семенные пузырьки, проводится мобилизация стенки МП позади пузырьков до фасции Denonvilliers, которая вскрывается, и дальнейшая диссекция выполняется между ней и прямой кишкой (рис. 4).
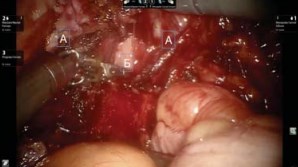
Рисунок 4. Задняя диссекция МП. А) Семенные пузырьки. Б) Прямая кишка.
Ретропростатическая диссекция должна проводиться кпереди от преректальной жировой клетчатки во избежание травмы прямой кишки. При несохранении нервно-сосудистых пучков семенные пузырьки оставляются неизменёнными на МП. В случае нервосберегающей РЦ они выделяются ближе к простате, тем самым избегая повреждения нервно-сосудистых пучков, которые располагаются латеральнее и близко к пузырькам.
Мобилизация МП и простаты с двух сторон. После отделения МП от прямой кишки проводится мобилизация МП с обеих сторон. Медиальные пупочные связки идентифицируются ближе к абдоминальному паховому кольцу. Брюшина пересекается латерально к связкам, распространяющимся на медиальные участки наружной подвздошной артерии и на Retzii пространство. Используя комбинацию острой и тупой диссекций пространство между латеральной поверхностью МП и боковой стенкой таза расширяется до достижения тазовой фасции (рис. 5).
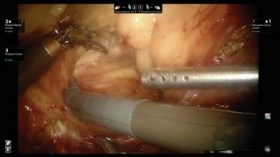
Рисунок 5. Выделение мочевого пузыря по боковой поверхности до простаты
При этом не следует пересекать урахус и пупочные связки, чтобы МП не проваливался в операционное поле. Эндопельвикальная фасция затем вскрывается, выделяется латеральная поверхность простаты.
Клипирование и пересечение сосудов МП. Семявыносящие протоки пересекаются для открытия доступа медиальнее от наружных подвздошных сосудов, и продолжается латеральная диссекция. Используя четвёртую руку, МП отводят краниально. При достаточной ретракции латеральные ножки могут быть хорошо идентифицированы для пересечения с помощью LigaSure или клипирования клипсами Hemo-lock. В начале выделяют и клипируют верхнюю пузырную артерию (рис. 6).
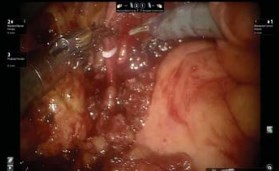
Рисунок 6. Клипирование пузырных сосудов
Далее проводят мобилизацию нижней пузырной и везикопростатических артерий. Выделение ножек МП заканчивается на верхне-латеральном участке простаты рядом с семенными пузырьками при сохранении нерво-сосудистых пучков. Они располагаются в задне-латеральной части простаты и легко выделяются на всем протяжении до апекса простаты. Нервосохраняющая диссекция при РЦ может быть выполнена по аналогичной методике, как при робот-ассистированной простатэктомии. Инцизия выполняется в перипростатической фасции и продолжается дистально к верхушке простаты. При этом нужно избегать термальной травмы или чрезмерной тракции нейро-сосудистых пучков. Далее выделяются сосудистые ножки простаты, которые рассекаются между клипсами Hem-o-lock. Эта техника эффективно сохраняет латеральную перипростатическую фасцию. У пациентов с низким уровнем простат-специфического антигена мы выполняли инфрафасциальную диссекцию, и в нашей серии РЦ у них не было рака простаты.
Мобилизация передней стенки МП и уретры. Урахус и медиальные пупочные связки коагулируются биполярным диссектором и пересекаются. Выделяются передняя стенка МП и простаты. Дорзальный венозный комплекс перевязывается и пересекается, проводится апикальная диссекция простаты и уретры на протяжении (рис. 7).
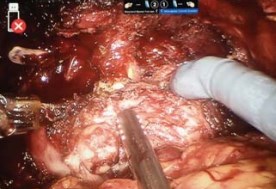
Рисунок 7. Мобилизация простаты и уретры
Далее удаляется катетер Foley и на уретру ближе к простате накладывается клипса Hem-o-lock для исключения попадания мочи или опухолевых клеток. Альтернативно подобная клипса может быть наложена на катетер Foley после подтягивания его баллона, который помогает в тракции МП с простатой (рис. 8).
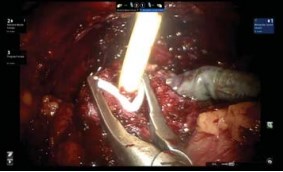
Рисунок 8. После отсечения уретры, на катетер Foley наложена клипса
Освобождённый препарат помещается в эндомешок. Малый таз промывается раствором антисептика и производится гемостаз путём коагуляции или прошивания кровоточащих сосудов. После установления дренажа препарат извлекается через расширенную рану одного из портов.
Робот-ассистированная РЦ у женщин
Положение больной на операционном столе, локализация троакаров и техника тазовой лимфодиссекции идентичны как у мужчин. У женщин возможны две модификации операции — с удалением матки и яичников (передняя экзентерация) или с их сохранением.
Задняя диссекция. Техника задней диссекции у женщин зависит от того, планируется ли орган-сохраняющая операция или нет. При передней экзентерации производится поперечная инцизия брюшины под соединением матки и задней стенки влагалища, которая расширяется билатерально над общими подвздошными сосудами. Матка отводится кпереди с помощью 4 роботической руки. Связки вдоль ножки яичника идентифицируются, клипируются клипсами Hem-o-lock или пересекаются с помощью LigaSure. Далее выделяются маточные артерии, которые клипируются и пересекаются. Матка отводится проксимально, что улучшает идентификацию зоны между влагалищем и маткой Этот этап облегчается с помощью манипуляции вагинальным тампоном. После инцизии заднего свода влагалища мобилизуется его передняя стенка вместе с маткой до шейки МП. Инцизия в передней стенке влагалища продолжается дистальнее до уровня шейки МП. Тем самым часть передней стенки влагалища удаляется в блоке вместе с МП. Тщательное закрытие и реконструкция вагины являются необходимым для предотвращения пролапса тазовых органов и развития мочеполового свища. Для достижения хороших функциональных результатов необходимо сохранить автономные нервы вдоль латеральной стенки влагалища, которые отвечают за сексуальную функцию.
Роботическая орган-сохраняющая цистэктомия у женщин. При отсутствии опухолевой инвазии ближе к матке планируется операция с сохранением её и влагалища, а также поддерживающих связок и сосудов яичников. Брюшина между маткой и МП поперечно вскрывается, стенка МП отделяется кпереди от шейки матки, идентифицируется передний свод влагалища. Далее ближе к шейке матки вскрывается передняя стенка влагалища, часть её удаляется вместе с МП. Мобилизация проводится до выделения шейки МП и уретры от влагалища.
Латеральная диссекция МП. После задней диссекции МП латеральнее к пупочным связкам проводится мобилизация МП с двух сторон, что позволяет идентифицировать сосудистые ножки. МП аккуратно отводится с помощью четвёртой руки, что позволяет натянуть сосуды МП, выделить их, клипировать или пересечь с помощью LigaSure. В начале купируется верхняя пузырная артерия, затем — нижняя.
Передняя мобилизация МП и диссекция уретры. Латеральная диссекция продолжается ниже к периректальному пространству и далее вдоль лонной кости. Эндопельвикальная фасция вскрывается, МП затем отделяется от передней брюшной стенки, как описано выше. Уретра идентифицируется и дорзальный венозный комплекс перевязывается. При планировании ортотопической цистопластики уретра пересекается ниже шейки МП для сохранения механизма удержания мочи.
Послеоперационное лечение
Все пациенты после робот-ассистированной РЦ находились под динамическим наблюдением. Желудочный зонд обычно удаляли при экстубации пациента или на следующий день при длительной операции. Пациентам без вздутия живота на следующий день разрешали пить воду. Для стимуляции кишечной функции со второго послеоперационного дня использовали свечи Бисакодил по 10 мг дважды в день. Профилактику тромбоэмболических осложнений проводили компрессией глубоких вен ног, назначением эноксипарина подкожно в первый день после операции в дополнение к профилактике тромбоза глубоких вен, зависящий от коморбидности пациента и/или способности к активизации. В послеоперационном периоде пациенты получали антибактериальную терапию и анальгетики. Дренажи удаляли при количестве отделяемого по ним менее 100 мл за сутки. Пациенты выписывались домой при отсутствии осложнений операции.
Результаты
Робот-ассистированная РЦ с кишечной деривацией мочи успешно выполнена 10 больным. В данной работе мы рассматривали технику только самой РЦ. Конверсии в открытое вмешательство не было. Время РЦ (от установки троакаров до удаления МП) — от 100 до 240 мин, среднее время — 120 мин. Объём кровопотери — от 250 до 800 мл (средний 370 мл), и, в основном, кровопотеря отмечалась на этапе мобилизации простаты и дорзального венозного комплекса, его прошивании и пересечении. Гемотрансфузия проводилась 3 больным. Послеоперационные осложнения были связаны с деривацией мочи, поэтому в этой работе мы их не рассматривали. При патоморфологическом исследовании рТ2 стадия выявлена у 6, рТ3 — у 4 пациентов. У 3 больных также выявлена аденокарцинома простаты. Удалённые лимфоузлы были негативными у всех пациентов.
Обсуждение
Робот-ассистированная РЦ постепенно занимает своё место в оперативном лечении больных с мышечно-инвазиным РМП. Робот-ассистированный доступ позволяет снизить количество интра- и послеоперационных осложнений, в первую очередь уменьшить объём кровопотери, сократить сроки госпитализации и реабилитации пациентов [5, 8, 10, 11]. Сложность РЦ усугубляется коморбидностью пациентов, которые часто являются пожилыми. РЦ является длительным вмешательством, включающим три определяющих этапа: удаление МП, тазовая лимфодиссекция и деривация мочи [4, 6, 8]. В начале освоения методики робот-ассистированной РЦ мы стремились сравнительно упростить операцию, разбив каждый этап на небольшие шаги. При их выполнении старались соблюдать определённую очерёдность выполнения, то есть к каждому последующему этапу переходили после завершения предыдущего. При данном структурированном подходе существуют несколько основных преимуществ. Во-первых, упрощается техника РЦ и улучшаются её результаты. Работая в одной определённой области, прежде чем перейти к следующему шагу, внимание хирурга сосредоточивалось на единственной на тот момент задаче. Важным является достижение адекватного гемостаза на всех этапах РЦ, что обеспечивает хорошую визуализацию и снижает объём кровопотери. Даже на основании своего первоначального опыта мы убедились, что систематический подход при выполнении РЦ позволял сократить время операции. Во-вторых, на наш взгляд, подробным описанием индивидуальных шагов операции легко учить молодых специалистов и проводить адекватное мониторирование обучения.
Открытая РЦ с расширенной лимфодиссекцией остаётся золотым стандартом лечения РМП, обеспечивающий отличный местный контроль опухоли с 50- 70 % пятилетнего раково-специфической выживаемостью [13-16]. Роль роботической хирургии в лечении РМП продолжает развиваться с нарастающей популярностью и поддерживается хорошими ближайшими или среднесрочными результатами [10, 12, 17]. В первую очередь РЦ выполняется по поводу онкологического заболевания, и поэтому об эффективности любого доступа будут судить на основании отдалённых результатов выживаемости. Робот-ассистированная РЦ в некоторых клиниках выполняется уже более 15 лет, данные робот-ассистированной РЦ с анализом по Kaplan-Meier опубликовали на 36 и 60 месяцы, сравнимыми с сериями после открытой РЦ [5, 8, 11]. Так, по данным Collins J.W. et al. [8] пятилетняя раковоспецифическая выживаемость составила 67%.
РЦ при различных доступах ассоциируется с определённым количеством периоперативных осложнений и выраженной морбидностью [13-16]. По данным различных авторов при открытой РЦ их количество колеблется от 49 % до 64 % [6, 10, 13-17]. Осложнения высокой степени по Clavien-Dindo наблюдаются от 13 % до 40 %, а 90-дневная смертность — от 0 % до 4,5 % [13, 16]. При робот-ассистированной РЦ также отмечается высокий уровень осложнений, но относительно меньшее количество, по сравнению с открытой РЦ [12, 18-20]. Collins J.W. et al. [8] ранние осложнения (0- 30 дней) наблюдали у 54 (47,8 %), 3 степени по ClavienDindo — у 37 (32,7 %) пациентов. Поздние осложнения (более 30 дней) имели место у 30 (26,5 %), 3 степени по Clavien-Dindo — у 20 (17,7 %), умер 1 (0,9 %) больной от эмболизации лёгочной артерии. Недавний метаанализ показал, что робот-ассистированная РЦ по сравнению с открытой РЦ ассоциируется с меньшим числом периоперативных осложнений, высоким количеством удалённых лимфоузлов, длительным временем операции, снижением объёма кровопотери и меньшим количеством гемотрансфузий, а также коротким периодом госпитализации [12]. Дальнейшие проспективные исследования результатов робот-ассистированной РЦ с длительным сроком наблюдения позволят подтвердить данные этого анализа.
Заключение
Робот-ассистированная РЦ является современным малоинвазивным методом лечения больных с мышечно-инвазивным РМП. Поэтапный систематический подход при выполнении РЦ позволяет сократить время операции, а также количество интра- и послеоперационных осложнений. Дальнейшее накопление клинического опыта и анализ отдалённых результатов позволят установить роль робот-ассистированной РЦ в лечении больных с мышечно-инвазивным РМП.
ЛИТЕРАТУРА
- Stenzl A, Cowan NC, De Santis M, Jakse G, Kuczyk MA, Merseburger AS, Ribal MJ, Sherif A, Witjes JA. The updated EAU guidelines on muscle-invasive and metastatic bladder cancer. Eur Urol. 2009;55(4):815-825. DOI: 10.1016/j. eururo.2009.01.002
- Gakis G, Efstathiou J, Lerner SP, Cookson MS, Keegan KA, Guru KA, Shipley WU, Heidenreich A, Schoenberg MP, Sagaloswky AI, Soloway MS, Stenzl A; International Consultation on Urologic Disease-European Association of Urology Consultation on Bladder Cancer 2012. ICUD-EAU International Consultation on Bladder Cancer 2012: Radical cystectomy and bladder preservation for muscle-invasive urothelial carcinoma of the bladder. Eur Urol. 2013;63(1):45-57. DOI: 10.1016/j.eururo.2012.08.009
- Kiss B, Burkhard FC, Thalmann GN. Open radical cystectomy: still the gold standard for muscle invasive bladder cancer. World J Urol. 2016;34(1):33-39. DOI: 10.1007/s00345-015- 1729-7
- Davis JW, Castle EP, Pruthi RS, Ornstein DK, Guru KA. Robot-assisted radical cystectomy: an expert panel review of the current status and future direction. Urol Oncol. 2010;28(5):480-486. DOI: 10.1016/j.urolonc.2009.11.014
- Pruthi RS, Nielsen ME, Nix J, Smith A, Schultz H, Wallen EM. Robotic radical cystectomy for bladder cancer: surgical and pathological outcomes in 100 consecutive cases. J Urol. 2010;183(2):510-514. DOI: 10.1016/j.juro.2009.10.027
- Challacombe BJ, Bochner BH, Dasgupta P, Gill I, Guru K, Herr H, Mottrie A, Pruthi R, Redorta JP, Wiklund P. The role of laparoscopic and robotic cystectomy in the management of muscle-invasive bladder cancer with special emphasis on cancer control and complications. Eur Urol. 2011;60(4):767- 775. DOI: 10.1016/j.eururo.2011.05.012
- Jonsson MN, Adding LC, Hosseini A, Schumacher MC, Volz D, Nilsson A, Carlsson S, Wiklund NP. Robot-assisted radical cystectomy with intracorporeal urinary diversion in patients with transitional cell carcinoma of the bladder. Eur Urol. 2011;60(5):1066-1073. DOI: 10.1016/j.eururo.2011.07.035
- Collins JW, Tyritzis S, Nyberg T, Schumacher M, Laurin O, Khazaeli D, Adding C, Jonsson MN, Hosseini A, Wiklund NP. Robot-assisted radical cystectomy: description of an evolved approach to radical cystectomy. Eur Urol. 2013;64(4):654- 663. DOI: 10.1016/j.eururo.2013.05.020
- Albisinni S, Oderda M, Fossion L, Varca V, Rassweiler J, Cathelineau X, Chlosta P, De la Taille A, Gaboardi F, Piechaud T, Rimington P, Salomon L, Sanchez-Salas R, Stolzenburg JU, Teber D, Van Velthoven R. The morbidity of laparoscopic radical cystectomy: analysis of postoperative complications in a multicenter cohort by the European Association of Urology (EAU)-Section of Uro-Technology. World J Urol. 2016;34(2):149-156. DOI: 10.1007/s00345-015-1633-1
- Smith AB, Raynor M, Amling CL, Busby JE, Castle E, Davis R, Nielsen M, Thomas R, Wallen EM, Woods M, Pruthi RS. Multi-institutional analysis of robotic radical cystectomy for bladder cancer: perioperative outcomes and complications in 227 patients. J Laparoendosc Adv Surg Tech A. 2012;22(1):17-21. DOI: 10.1089/lap.2011.0326
- Treiyer A, Saar M, Butow Z, Kamradt J, Siemer S, Stockle M. Robotic-assisted laparoscopic radical cystectomy: surgical and oncological outcomes. Int Braz J Urol. 2012;38(3):324- 329. PMID: 22765865
- Li K, Lin T, Fan X, Xu K, Bi L, Duan Y, Zhou Y, Yu M, Li J, Huang J. Systematic review and meta-analysis of comparative studies reporting early outcomes after robot-assisted radical cystectomy versus open radical cystectomy. Cancer Treat Rev. 2013;39(6):551-560. DOI: 10.1016/j.ctrv.2012.11.007
- Novara G, De Marco V, Aragona M, Boscolo-Berto R, Cavalleri S, Artibani W, Ficarra V. Complications and mortality after radical cystectomy for bladder transitional cell cancer. J Urol. 2009;182(3):914-921. DOI: 10.1016/j.juro.2009.05.032
- Комяков Б.К., Гулиев Б.Г., Сергеев А.В., Фадеев В.А., Ульянов А.Ю., Савашинский Я.С., Касьяненко С.С. Выживаемость больных раком мочевого пузыря после радикальной цистэктомии. Онкоурология. 2016;12(1):29-35. DOI: 10.17650/1726-9776-2016-12-1-29-35
- Lawrentschuk N, Colombo R, Hakenberg OW, Lerner SP, Månsson W, Sagalowsky A, Wirth MP. Prevention and management of complications following radical cystectomy for bladder cancer. Eur Urol. 2010;57(6):983-1001. DOI: 10.1016/j.eururo.2010.02.024
- Schiavina R, Borghesi M, Guidi M, Vagnoni V, Zukerman Z, Pultrone C, Passareƫ G, Romagnoli D, Bianchi L, MorselliLabate A, Brunocilla E, Garofalo M, Manferrari F, Conceƫ S, Martorana G. Perioperative complications and mortality after radical cystectomy when using a standardized reporting methodology. Clin Genitourin Cancer. 2013;11(2):189-197. DOI: 10.1016/j.clgc.2012.12.003
- Ng CK, Kauff man EC, Lee MM, OƩ o BJ, Portnoff A, Ehrlich JR, Schwartz MJ, Wang GJ, Scherr DS. A comparison of postoperative complications in open versus robotic cystectomy. Eur Urol. 2010;57(2):274-281. DOI: 10.1016/j.eururo.2009.06.001
- Martin AD, Nunez RN, Castle EP. Robot-assisted radical cystectomy versus open radical cystectomy: a complete cost analysis. Urology. 2011;77(3):621-625. DOI: 10.1016/j.urology.2010.07.502
- Knox ML, El-Galley R, Busby JE. Robotic versus open radical cystectomy: idenƟfi cation of patients who benefi t from the robotic approach. J Endourol. 2013;27(1):40-44. DOI: 10.1089/end.2012.0168
- Johar RS, Hayn MH, Stegemann AP, Ahmed K, Agarwal P, Balbay MD, Hemal A, Kibel AS, Muhletaler F, Nepple K, Pattaras JG, Peabody JO, Palou Redorta J, Rha KH, Richstone L, Saar M, Schanne F, Scherr DS, Siemer S, Stökle M, Weizer A, Wiklund P, Wilson T, Woods M, Yuh B, Guru KA. Complications aŌ er robot-assisted radical cystectomy: results from the International Robotic Cystectomy Consortium. Eur Urol. 2013;64(1):52-57. DOI: 10.1016/j.eururo.2013.01.010
Статья опубликована в журнале "Вестник урологии" № 4 2018, стр. 13-20










Комментарии