Ф.Р. Асфандияров1 , В.Ю. Старцев2 , А.Ю. Колмаков1
1 ФГБОУ ВО «Астраханский государственный медицинский университет» МЗ РФ; Астрахань, Россия
2 ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» МЗ РФ; Санкт-Петербург, Россия
Введение
Шистосомоз – паразитарное заболевание, занимающее по распространённости второе место в мире после малярии. Около 95% случаев инфицирования вызваны Schistosoma haematobium, основным известным возбудителем мочеполового шистосомоза (МШ), и Schistosoma mansoni [1]. Согласно данным ВОЗ в 2016 году профилактическое лечение шистосомоза проводилось лишь 88 млн. человек из 206,5 млн. инфицированных. Группы населения с высоким и средним риском инфицирования шистосомозом проживают в 52 странах, 92% людей, нуждающихся в лечении, живут в Африке [2]. По свидетельству Брико Н. И. и Покровского В.И. [3] глобализация меняет существо эпидемического процесса, влияет на все его составные элементы, в ряде случаев существенно ускоряя появление и распространение инфекционных болезней. Данное обстоятельство способствует распространению «экзотических» инфекций из стран тропического пояса на территорию нашей страны и страны Европы [4-6]. Рядом исследователей описаны спорадические случаи МШ на территории Российской Федерации, а также источники инфицирования данным заболеванием [7, 8].
Инфицирование S. Haematobium, возбудителя МШ, происходит при использовании инфицированной воды в хозяйственных целях. Попадая в кровеносную систему, шистосома проникает в органы малого таза, откладывая яйца в подслизистом слое мочевого пузыря либо половых органах. Под воздействием сокращения гладкой мускулатуры часть яиц выделяется в просвет мочевого пузыря, а затем в окружающую среду. Оставшиеся яйца вызывают тканевое асептическое воспаление, что в свою очередь, приводит к образованию специфических гранулем за счёт механизма активной пролиферации иммунокомпетентных клеток [9].
Формирование гранулём претерпевает ряд фаз. В ранней фазе в поражённых шистосомами участках преобладают воспалительные процессы. Клетки гранулём активно секретирует хемокины, цитокины и другие противовоспалительные медиаторы, постепенно переходя в фазу паренхиматозно – мезенхимальной трансформация клеток, с преобладанием элементов фиброза с отложением кальция в гранулёмах [10].
Описанные процессы способствуют возникновению ряда типичных для МШ урологических осложнений, таких как: кальцификация стенки мочевого пузыря, специфические гранулёмы, плоскоклеточной метаплазии (ПМ), что в свою очередь может приводить к развитию контрактуры шейки мочевого пузыря, стриктурам мочеточников, уменьшению объёма мочевого пузыря. Дальнейшее развитие осложнений МШ может стать причиной смертельного исхода в результате нарастающей почечной недостаточности вследствие восходящего инфицирования верхних мочевыводящих путей и развития гидронефроза [11]. Мочеполовой шистосомоз часто сопровождается хронической бактериальной суперинфекцией, способствующей плоскоклеточной трансформации клеток уротелия [12]. Наиболее неблагополучным осложнением МШ, непосредственно влияющим на число случаев смерти, является рак мочевого пузыря (РМП). Международным агентством по изучению рака (МАИР) S. haematobium признана биологическим агентом, входящим в группу биологических канцерогенов [1].
Нами изучены и проанализированы данные о диагностике и лечении МШ и его осложнений среди жителей провинции Бенгела (республика Ангола), проживающих в нескольких эндемичных регионах МШ.
Материалы и методы
Анализируются результаты наблюдения 181 больного провинции Бенгела (республика Ангола), впервые обратившихся с жалобами на примесь крови в моче, с 2009 по 2010 гг.
Всем больным МШ выполнялось комплексное исследование, включавшее в себя: цитологическое исследование осадка мочи (ЦИОМ), ультразвуковое исследование почек и малого таза (УЗИ), и эндоскопическую диагностику (цистоскопия, или ЦС). В результате проведённых мероприятий всем пациентам установлен диагноз: «Мочеполовой шистосомоз»: в 142 (78,5%) случаях подтверждён МШ, у 39 (21,5%) пациентов выявлен шистосомный РМП (шРМП). Все пациенты шРМП были оперированы в урологическом отделении регионального госпиталя. Характеристики больных макрогематурией представлены в таблице 1.
Таблица 1. Характеристики пациентов c макрогематурией, находившихся под наблюдением с 2009–2010 гг.
| Характеристики пациентов | Число больных, абс |
| Средний возраст, лет | 29,3 |
| мужчины | 27,2 |
| женщины | 31,4 |
| Пол | |
| мужской | 108 |
| женский | 73 |
| Продолжительность макрогематурии (мес.) | |
| -3-6 | 147 |
| -6-12 | 33 |
| -12-18 | 1 |
| >18 | - |
| Расовая принадлежность | 181 |
| негроидная раса | - |
| белая раса/ | |
| Место проживания | |
| город | 23 |
| - сельская местность | 158 |
| Распространённость поражения слизистой оболочки*: | |
| единичные участки (<2 см) | 107 |
| множественные участки (>2 см) | 35 |
Примечания: * – участки слизистой оболочки мочевого пузыря с пролиферативными воспалительными изменениями у больных с МШ.
Как следует из таблицы 1, основной контингент пациентов МШ составили жители сельской местности, трудоспособного возраста 25-27 лет, с незначительным преобладанием мужчин. У наибольшего количества пациентов продолжительность макрогематурии составляла от 3 до 6 месяцев, а изменения уротелия характеризовались участками, не превышающими 2 см.
Как следует из таблицы 1, основной контингент пациентов МШ составили жители сельской местности, трудоспособного возраста 25-27 лет, с незначительным преобладанием мужчин. У наибольшего количества пациентов продолжительность макрогематурии составляла от 3 до 6 месяцев, а изменения уротелия характеризовались участками, не превышающими 2 см.
Результаты исследования
Комплексное обследование пациентов МШ (n=142) проводилось в амбулаторных условиях. Цитологическое исследование осадка мочи (ЦИОМ) подтвердило наличие шистосом у 38 (26,8%) пациентов. При проведении УЗИ органов малого таза наличие специфических гранулём слизистой оболочки мочевого пузыря установлено у 28 (19,7%) больных, в 7 (4,9%) случаях обнаружен гидронефроз, а кальцификация и утолщение стенки мочевого пузыря – в 10 (7%) и в 99 (69,7%) случаях, соответственно. При эндоскопическом исследовании гранулематозные изменения мочевого пузыря выявлены у 68 (47,9%) больных. Результаты выполнения диагностических мероприятий отражены в таблице 2.
Таблица 2. Итоги диагностических мероприятий у больных с МШ
| Вид исследования | Показатель | Число больных (%) с учетом периода наблюдения |
| ЦИОМ | Число позитивных ответов | 38 (26,8) |
| Гранулематозные изменения | 28 (19,7) | |
| УЗИ | Гидронефроз | 7 (4,9) |
| Кальцификация стенки | 10 (7) | |
| Утолщение стенки | 99 (69,7) | |
| ЦС | ПМ | 101 (71,1) |
| «Песчаные участки» | 142 (100) | |
| Пролиферативные изменения (<2 см) | 33 (23,2) | |
| Пролиферативные изменения (>2 см) | 35 (24,6) |
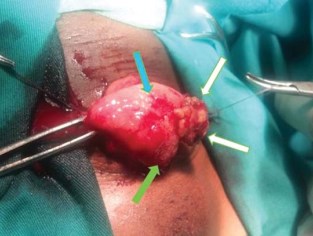
Рисунок 1. Интраоперационная макроскопическая картина шистосомной опухоли мочевого пузыря, у пациента П., 10 лет. Видны геморрагические участки слизистой оболочки мочевого пузыря, обусловленные острым шистосомным воспалением (обозначено синей стрелкой), гранулематозные образования (белые стрелки) и участки плоскоклеточной метаплазии (зелёная стрелка). В просвете органа опухолевидное образование, более 1 см в диаметре, на фоне неизменённой слизистой оболочки.
Как следует из результатов наблюдений, стандартный и наиболее распространённый метод верификации МШ методом ЦИОМ не всегда позволяет подтвердить наличие у больного данного заболевания. Ультразвуковой метод позволяет выявить наиболее типичные признаки МШ, такие, как утолщение и кальцификацию стенки мочевого пузыря, наличие гранулематозных изменений уротелия. Тем не менее, диагностика небольших <2 см гранулематозных образований может быть затруднительна, что говорит о необходимости выполнения ЦС всем больным МШ, при необходимости дополняемой «холодной» или трансуретральной биопсией с последующим гистологическим исследованием. При выполнении ЦС у 33 (23,2%) пациентов были обнаружены «песчаные участки» и специфические гранулёмы слизистой оболочки мочевого пузыря <2 см, крупные гранулематозные изменения размерами свыше 2 см верифицированы у 35 (24,6%) пациентов. ПМ была выявлена у большинства пациентов в 101 (71,1) случаях.
Типичную картину гранулематозных изменений слизистой оболочки мочевого пузыря при МШ иллюстрирует клинический случай (рис. 1) пациента П., 10 лет (мальчик), оперированного в связи с профузной макрогематурией, анемией II степени, ранее получавшего препарат «Празиквантел».
Все пациенты МШ распределены в две группы с учётом планируемой тактики лечения и дальнейшего динамического наблюдения. В I группу вошли 74 (52,1%) пациента с неосложнённым МШ, у которых отсутствовали выраженные пролиферативные образования мочевого пузыря и верхних мочевых путей по данным УЗИ, а при ЦС выявлялись специфические для МШ «песчаные участки» уротелия. Во II группу отнесены больные МШ с гранулематозными пролиферативными воспалительными изменениями (n=68; 47,9%), либо при сочетании этих изменений с гидронефрозом (n=7; 4,9%).
Обследование и лечение больных I, II категорий оказывалось в дневном стационаре (ДС), развёрнутом на базе регионального госпиталя с входящим в его состав урологическим отделением. Подготовка больных к ЦС осуществлялась с учётом возможного проведения трансуретральной резекции мочевого пузыря (ТУРМП).
Для выработки единых показаний к выполнению ТУРМП использовали рекомендации Европейской Ассоциации Урологов (ЕАU), согласно которым операция допустима в случаях:
- Эндовезикальных пролиферативных воспалительных образований.
- Язвенных образований (допускается выполнение коагуляции и биопсии).
- Опухолевых образований (без сквозной перфорации стенки мочевого пузыря, в случаях планируемой радикальной цистэктомии).
- «Песчаных пятен» уротелия (могут быть подвергнуты только биопсии) [13].
Пациенты I группы (n=74) получали празиквантел в стандартной дозировке (40 мг/кг) в сочетании с пероральной антибактериальной терапией, в результате которой достигнут положительный клинический эффект: купирование макрогематурии и дизурических расстройств. Контрольные ЦС выполняли в этой серии исследований 46 (32,4%) пациентам в среднем через 14±1,2 дней после окончания лечения и показали полную регрессию патологических изменений слизистого слоя мочевого пузыря.
Во II группе (n=68) 35 (24,6%) пациентам, у которых по данным ЦС выявлены гранулёмы >2 см в диаметре, сливного либо множественного характера, выполнена ТУРМП, сочетавшаяся с эндоскопическим рассечением устья мочеточника в 4 (2,8%) случаях. Всем больным проводилась терапия препаратом празиквантел (40 мг/кг) до операции, и антибактериальная терапия в течение 7 дней антибактериальными препаратами фторхинолонового ряда. Контрольные исследования в этой группе включали в себя ЦИОМ с тестом на МШ, УЗИ мочевого пузыря и почек. Повторную ЦС выполняли в среднем через 35±2,5 дней. Результаты контрольных наблюдений показали восстановление нормальной структуры слизистого слоя мочевого пузыря у всех больных после ТУРМП, умеренный гидронефроз сохранялся у 1 (0,7%) пациента. Из 33 (23,2%) больных, получавших только антибактериальную и антипротозойную терапию, гранулёмы сохранялись у 7 (4,9%) пациентов, в связи с чем, выполнен ТУРМП, контрольные исследования этим больным осуществлялись в том же режиме, с результатом в виде полной регрессии образований.
Средняя продолжительность пребывания в стационаре ДС составила 2,3±1,1 дня. При проведении эндоскопического лечения осложнений не зафиксировано. По окончании лечения обязательным было проведение беседы с больным о профилактике развития МШ.
Обсуждение
Наиболее доступный лабораторный тест мочи на шистосомоз, а также УЗИ не всегда позволяет верифицировать данное заболевание. Применение комплексного подхода, включающего в себя взаимодополняющие методы исследования, такие как ЦИОМ, УЗИ, ЦС и, по показаниям, ТУР мочевого пузыря, с последующим гистологическим исследованием позволяют добиться наиболее полной картины поражения мочевого пузыря при МШ, а также оценить состояние верхних мочевых путей. Как показало данное исследование, в ряде случаев консервативная терапия не приводит к полному регрессу гранулематозных изменений. По свидетельству Gentile J.M., значительные морфологические изменения стенки мочевого пузыря при осложнённом МШ приводят к нарушению пассажа мочи, что обуславливает дополнительный канцерогенный риск в плане возникновения шРМП [14]. Таким образом, активная хирургическая тактика оправдана при крупных гранулематозных образованиях и, вероятно, способна снизить канцерогенный риск у данного контингента больных. Применение эндоскопической аппаратуры даёт возможность выполнять этот вид вмешательства с минимальным количеством осложнений. Динамическое наблюдение за пациентами МШ позволяет оценить результаты лечения на любом этапе и применить малоинвазивные хирургические методики при неэффективности консервативной терапии. Мы считаем проведение контрольной ЦС у больных при неосложнённом МШ нецелесообразным, при условии правильного выполнения инициальной ЦС, адекватных показаний к консервативному лечению и адекватной терапии пациента.
Выводы
Обследование пациентов МШ с использованием комплекса указанных диагностических методов позволяет наиболее полно оценить объем патологических изменений в стенке мочевого пузыря, что даёт возможность выбора хирургического метода лечения, дополняющего антипаразитарную и антибактериальную терапию. Эндоскопические методы диагностики на основе выработанных показаний целесообразно выполнять всем больным МШ и при необходимости должны дополняться биопсией поражённых участков.
Литература
- International Agency for Research on Cancer. Schistosomes, liver flukes and Helicobacter pylori. IARC Monogr. Eval. Carcinog. Risks Hum.1994;61:45-100.
- World Health Organization. Fact sheet N.115: Schistosomiasis. Электронный ресурс. WHO. Электрон, текстовые дан. – Режим доступа: http://www.who.int/mediacentre/ factsheets/fs115/en/. Accessed October 2017
- Брико Н.И., Покровский В.И. Глобализация и эпидемический процесс. Эпидемиология и инфекционные болезни. 2010;4:6.
- Maestro MA, Gonzalez ER, Garcia PD et al. Bladder schistosomiasis: case report and bibliographic review. Arch. Esp. Urol. 2010;63(7):554-558. PMID: 20945592
- Boissier J, Grech-Angelini S, Webster BL et al. Outbreak of urogenital schistosomiasis in Corsica (France): an epidemiological case study. Lancet Infect. Dis. 2016;16(8):971-979. DOI: 10.1016/S1473-3099(16)00175-4
- Бронштейн А.М., Малышев Н.А., Жаров С.Н. Острый мочеполовой шистосомоз у туриста, посетившего Уганду и Кению: описание случая и обзор литературы. Эпидемиология и инфекционные болезни. 2012;5:47-50.
- Катаханова Л.Л., Савин В.А., Исаева Я.В, Болотская Т.Г. Случай мочеполового шистосомоза у ребенка 10 лет. Вестник Сургута. 2013;1(15):59-61.
- Шахулина Л.Р., Валшин Д. А., Хунафина Д.Х., Галиева А.Т. Мочеполовой шистосомоз, клинический случай. Инфекционные болезни. 2017;15(1):317.
- Brito de PA, Kazura JW, Mahmoud AA. Host granulomatous response in Schistosomiasis mansoni Antibody and cellmediated damage of parasite eggs in vitro. J. Clin. Invest. 1984;74(5):1715–1723. DOI: 10.1172/JCI111589
- Savioli L, Renganathan E, Montresor A et al. Division of control of Tropical Diseases, Schistomiasis and Intestinal Parasites unit, World Health Organization. Control of schistosomiasis—a global picture. Parasitol. Today.1997;13:444–448
- 11. Alwan MH, Al-Shukri S, Lafi MO. Bilharzial Anuria. Bahrain Medical Bulletin. 1984;6(3):78-80.
- 12. Shokeir AA. Squamous cell carcinoma of the bladder: pathology, diagnosis and treatment. BJU Int. 2004;93:216–220. PMID: 14690486
- 13. Bichler КH, Savatovsky I, Members of the Urinary Tract Infection (UTI) Working Group of the Guidelines Offi ce of the European Association of Urology (EAU): Naber KG, Bischop MC, Bjerklund-Johansen TE, Botto H, Cek M, Grabe M, Lobel B, Redorta JP, Tenke P. EAU Guidelines for the Management of Urogenital Schistosomiasis. Eur Urol. 2006. 49(6):998- 1003. DOI: 10.1016/j.eururo.2006.02.022
- 14. Gentile JM. Schistosome related cancers: a possible role for genotoxins. Environ. Mutagen.1985;7:775–785. DOI: 10.1002/em.2860070514
Статья опубликована в журнале "Вестник урологии" №3 2018, стр. 5-11










Комментарии